В физических науках , A фаза представляет собой область пространства (а термодинамическая систему ), в течение которых все физические свойства материала, по существу , однородные. [1] [2] : 86 [3] : 3 Примеры физических свойств включают плотность , показатель преломления , намагниченность.и химический состав. Простое описание состоит в том, что фаза - это область материала, которая является химически однородной, физически отличной и (часто) механически разделяемой. В системе, состоящей из льда и воды в стеклянной банке, кубики льда являются одной фазой, вода - второй фазой, а влажный воздух - третьей фазой над льдом и водой. Стакан баночки - еще один отдельный этап. (См. Состояние вещества § Стекло )
Термин фаза иногда используется как синоним состояния вещества , но может быть несколько несмешивающихся фаз одного и того же состояния вещества. Кроме того, термин фаза иногда используется для обозначения набора состояний равновесия, разграниченных в терминах переменных состояния, таких как давление и температура, границей фаз на фазовой диаграмме . Поскольку фазовые границы связаны с изменениями в организации материи, такими как переход от жидкости к твердому телу или более тонкое изменение от одной кристаллической структуры к другой, это последнее использование аналогично использованию слова «фаза» как синонима состояния иметь значение. Однако использование состояния вещества и фазовой диаграммы не соизмеримо. с формальным определением, данным выше, и предполагаемое значение должно быть определено частично из контекста, в котором используется термин.
Типы фаз [ править ]
Отдельные фазы можно описать как различные состояния вещества, такие как газ , жидкость , твердое тело , плазма или конденсат Бозе-Эйнштейна . Полезные мезофазы между твердым телом и жидкостью образуют другие состояния вещества.
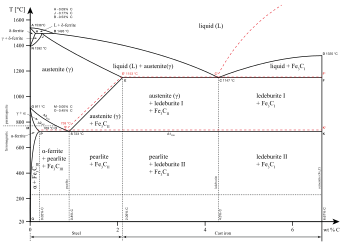
Отдельные фазы могут также существовать в данном состоянии материи. Как показано на диаграмме для сплавов железа, существует несколько фаз как для твердого, так и для жидкого состояний. Фазы также можно различать в зависимости от растворимости, как полярные (гидрофильные) или неполярные (гидрофобные). Смесь воды (полярная жидкость) и масла (неполярная жидкость) спонтанно разделится на две фазы. Вода имеет очень низкую растворимость (нерастворима) в масле, а масло имеет низкую растворимость в воде. Растворимость - это максимальное количество растворенного вещества, которое может раствориться в растворителе до того, как растворенное вещество перестанет растворяться и останется в отдельной фазе. Смесь может разделяться более чем на две жидкие фазы, и концепция разделения фаз распространяется на твердые вещества, то есть твердые вещества могут образовывать твердые растворы.или кристаллизоваться в отдельные кристаллические фазы. Взаимно растворимые пары металлов могут образовывать сплавы , а пары металлов, которые взаимно нерастворимы, не могут.
Наблюдается до восьми несмешивающихся жидких фаз . [a] Взаимно несмешивающиеся жидкие фазы образуются из воды (водная фаза), гидрофобных органических растворителей, перфторуглеродов ( фтористая фаза ), силиконов, нескольких различных металлов, а также из расплавленного фосфора. Не все органические растворители полностью смешиваются, например, смесь этиленгликоля и толуола может разделиться на две отдельные органические фазы. [b]
Фазы не нуждаются в макроскопическом самопроизвольном разделении. Эмульсии и коллоиды являются примерами комбинаций несмешивающихся пар фаз, которые физически не разделяются.
Фазовое равновесие [ править ]
Оставленные для уравновешивания, многие композиции образуют единую однородную фазу, но в зависимости от температуры и давления даже одно вещество может разделиться на две или более отдельных фаз. Внутри каждой фазы свойства одинаковы, но свойства между двумя фазами различаются.
Вода в закрытой банке с воздушным пространством над ней образует двухфазную систему. Большая часть воды находится в жидкой фазе, где она удерживается за счет взаимного притяжения молекул воды. Даже в состоянии равновесия молекулы постоянно находятся в движении, и время от времени молекула в жидкой фазе приобретает достаточно кинетической энергии, чтобы оторваться от жидкой фазы и войти в газовую фазу. Точно так же время от времени молекула пара сталкивается с поверхностью жидкости и конденсируется в жидкость. В состоянии равновесия процессы испарения и конденсации точно уравновешиваются, и нет чистого изменения объема любой фазы.
При комнатной температуре и давлении сосуд с водой достигает равновесия, когда воздух над водой имеет влажность около 3%. Этот процент увеличивается с повышением температуры. При 100 ° C и атмосферном давлении равновесие не достигается, пока воздух не состоит на 100% из воды. Если жидкость нагреть чуть более 100 ° C, переход от жидкости к газу будет происходить не только на поверхности, но и во всем объеме жидкости: вода закипает.
Количество фаз [ править ]
Для данного состава возможны только определенные фазы при данной температуре и давлении. Количество и тип фаз, которые образуются, трудно предсказать и обычно определяется экспериментально. Результаты таких экспериментов можно представить в виде фазовых диаграмм .
Показанная здесь фазовая диаграмма предназначена для однокомпонентной системы. В этой простой системе возможные фазы зависят только от давления и температуры . Маркировка показывает точки, в которых две или более фазы могут сосуществовать в равновесии. При температурах и давлениях, отличных от маркировки, будет только одна фаза в состоянии равновесия.
На диаграмме синяя линия, обозначающая границу между жидкостью и газом, не продолжается бесконечно, а заканчивается в точке, называемой критической точкой . По мере приближения температуры и давления к критической точке свойства жидкости и газа становятся все более похожими. В критической точке жидкость и газ становятся неразличимы. Выше критической точки больше нет отдельных жидких и газовых фаз: есть только общая жидкая фаза, называемая сверхкритической жидкостью . В воде критическая точка находится примерно при 647 К (374 ° C или 705 ° F) и 22,064 МПа .
Необычной особенностью фазовой диаграммы воды является то, что линия твердой и жидкой фаз (показанная пунктирной зеленой линией) имеет отрицательный наклон. Для большинства веществ наклон положительный, о чем свидетельствует темно-зеленая линия. Эта необычная особенность воды связана с тем, что лед имеет меньшую плотность, чем жидкая вода. Повышение давления переводит воду в фазу с более высокой плотностью, что вызывает таяние.
Другой интересной, хотя и не необычной особенностью фазовой диаграммы является точка, где линия твердой и жидкой фаз встречается с линией фазы жидкость-газ. Пересечение называется тройной точкой . В тройной точке все три фазы могут сосуществовать.
Экспериментально фазовые линии относительно легко отобразить из-за взаимозависимости температуры и давления, которая возникает при образовании нескольких фаз. См. Правило фаз Гиббса. Рассмотрим испытательную установку, состоящую из закрытого и хорошо изолированного цилиндра, снабженного поршнем. Контролируя температуру и давление, систему можно переместить в любую точку фазовой диаграммы. Из точки в области стабильности твердого тела (левая часть диаграммы) увеличение температуры системы приведет к тому, что жидкость или газ будут находиться в равновесной фазе (в зависимости от давления). Если поршень опускается медленно, система будет отслеживать кривую увеличения температуры и давления в газовой области фазовой диаграммы. В точке, где газ начинает конденсироваться в жидкость, направление кривой температуры и давления резко изменится, чтобы проследить вдоль фазовой линии, пока вся вода не сконденсируется.
Межфазные явления [ править ]
Между двумя фазами, находящимися в состоянии равновесия, существует узкая область, в которой свойства не соответствуют ни одной из фаз. Хотя эта область может быть очень тонкой, она может иметь значительные и легко наблюдаемые эффекты, например заставлять жидкость проявлять поверхностное натяжение . В смесях некоторые компоненты могут предпочтительно двигаться к границе раздела . С точки зрения моделирования, описания или понимания поведения конкретной системы, может оказаться эффективным рассматривать межфазную область как отдельную фазу.
Кристаллические фазы [ править ]
Один материал может иметь несколько различных твердых состояний, способных образовывать отдельные фазы. Вода - хорошо известный пример такого материала. Например, водяной лед обычно находится в гексагональной форме льда I h , но может также существовать в виде кубического льда I c , ромбоэдрического льда II и многих других форм. Полиморфизм - это способность твердого тела существовать в более чем одной кристаллической форме. Для чистых химических элементов полиморфизм известен как аллотропия . Например, алмаз , графит и фуллерены - это разные аллотропы углерода .
Фазовые переходы [ править ]
Когда вещество претерпевает фазовый переход (переход из одного состояния вещества в другое), оно обычно либо поглощает, либо выделяет энергию. Например, когда вода испаряется, увеличение кинетической энергии по мере того, как испаряющиеся молекулы избегают сил притяжения жидкости, отражается в понижении температуры. Энергия, необходимая для индуцирования фазового перехода, берется из внутренней тепловой энергии воды, которая охлаждает жидкость до более низкой температуры; следовательно, испарение полезно для охлаждения. См. Энтальпия испарения . Обратный процесс, конденсация, выделяет тепло. Тепловая энергия или энтальпия, связанная с переходом твердого тела в жидкость, представляет собой энтальпию плавления, а то, что связано с переходом твердого тела в газ, являетсяэнтальпия сублимации .
Фазы из равновесия [ править ]
В то время как фазы вещества традиционно определяются для систем, находящихся в тепловом равновесии, работа над квантовыми многочастичными локализованными (MBL) системами обеспечила основу для определения фаз, находящихся в состоянии вне равновесия. Фазы MBL никогда не достигают теплового равновесия и могут допускать новые формы порядка, недопустимые в равновесии, через явление, известное как квантовый порядок с защитой от локализации. Переходы между различными фазами MBL, а также между фазами MBL и термализации представляют собой новые динамические фазовые переходы, свойства которых являются активной областью исследований.
Заметки [ править ]
- ^ Одна из таких систем сверху: минеральное масло , силиконовое масло , вода , анилин , перфтор (диметилциклогексан) , белый фосфор , галлий и ртуть . Система остается разделенной на неопределенное время при45 ° C , где галлий и фосфор находятся в расплавленном состоянии. Из Reichardt, C. (2006). Растворители и их действие в органической химии . Wiley-VCH . С. 9–10. ISBN 978-3-527-60567-5.
- ^ Это явление можно использовать для повторного использования катализатора при винилировании Хека . См. Bhanage, BM; и другие. (1998). «Сравнение активности и селективности различных комплексных катализаторов металл-TPPTS в двухфазных реакциях винилирования этиленгликоля и толуола по Хеку иодбензола». Буквы тетраэдра . 39 (51): 9509–9512. DOI : 10.1016 / S0040-4039 (98) 02225-4 .
Ссылки [ править ]
- ^ Modell, Майкл; Роберт С. Рид (1974). Термодинамика и ее приложения . Энглвуд Клиффс, Нью-Джерси: Прентис-Холл. ISBN 978-0-13-914861-3.
- ↑ Энрико Ферми (25 апреля 2012 г.). Термодинамика . Курьерская корпорация. ISBN 978-0-486-13485-7.
- ↑ Клемент Джон Адкинс (14 июля 1983 г.). Равновесная термодинамика . Издательство Кембриджского университета. ISBN 978-0-521-27456-2.
Внешние ссылки [ править ]
| Викискладе есть медиафайлы, связанные с фазой (материей) . |
- Французские физики нашли раствор, который обратимо затвердевает при повышении температуры - α- циклодекстрин , вода и 4-метилпиридин.
