Поверхность потенциальной энергии ( ПЭС ) описывает энергию системы, в частности набор атомов, с точки зрения некоторых параметров, как правило, положения атомов. Поверхность может определять энергию как функцию одной или нескольких координат; если есть только одна координата, поверхность называется кривой потенциальной энергии или профилем энергии . Примером может служить потенциал Морзе / дальнего действия .
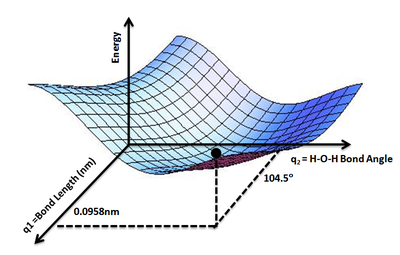
Полезно использовать аналогию с ландшафтом: для системы с двумя степенями свободы (например, двумя длинами связей) значение энергии (аналогия: высота земли) является функцией двух длин связей (аналогия: координаты положения на местности). [1]
Концепция PES находит применение в таких областях, как химия и физика, особенно в теоретических разделах этих предметов. Его можно использовать для теоретического исследования свойств структур, состоящих из атомов, например, для определения минимальной энергетической формы молекулы или вычисления скорости химической реакции.
Математическое определение и вычисления [ править ]
Геометрия набора атомов может быть описана вектором r , элементы которого представляют положения атомов. Вектор r может быть набором декартовых координат атомов или также набором межатомных расстояний и углов.
При заданном r энергия как функция позиций, E ( r ) , является значением E ( r ) для всех интересующих r . Используя аналогию с ландшафтом из введения, E дает высоту «энергетического ландшафта», так что возникает концепция поверхности потенциальной энергии .
Чтобы изучить химическую реакцию с использованием ППЭ в зависимости от положения атомов, необходимо рассчитать энергию для каждого интересующего расположения атомов. Методы вычисления энергии определенного расположения атомов хорошо описаны в статье по вычислительной химии , и здесь упор будет сделан на поиск приближений E ( r ) для получения детальной информации об энергетическом положении.
Для очень простых химических систем или когда делаются упрощающие приближения к межатомным взаимодействиям, иногда можно использовать аналитически полученное выражение для энергии как функции положения атомов. Примером может служить потенциал Лондона - Эйринга - Поланьи- Сато [2] [3] [4] для системы H + H 2 как функция трех расстояний HH.
Для более сложных систем расчет энергии определенного расположения атомов часто требует слишком больших вычислительных ресурсов, чтобы можно было представить крупномасштабные представления поверхности. Для этих систем возможный подход состоит в том, чтобы вычислить только сокращенный набор точек на PES, а затем использовать более дешевый в вычислительном отношении метод интерполяции, например, интерполяцию Шепарда , чтобы заполнить пробелы. [5]
Заявление [ править ]
PES - это концептуальный инструмент для анализа геометрии молекул и динамики химических реакций . После того, как необходимые точки оценены на PES, точки могут быть классифицированы в соответствии с первой и второй производными энергии относительно положения, которые соответственно являются градиентом и кривизной . Стационарные точки (или точки с нулевым градиентом) имеют физический смысл: минимумы энергии соответствуют физически стабильным химическим соединениям, а седловые точки соответствуют переходным состояниям , точке с наивысшей энергией на координате реакции (которая представляет собой путь с наименьшей энергией, соединяющий химический реагент с химический продукт).
Привлекательные и отталкивающие поверхности [ править ]
Поверхности потенциальной энергии для химических реакций можно классифицировать как притягивающие или отталкивающие , сравнивая удлинения длин связей в активированном комплексе с таковыми у реагентов и продуктов. [6] [7] Для реакции типа A + B-C → A-B + C удлинение длины связи для вновь образованной связи A-B определяется как R * AB = R AB - R 0 AB , где R AB - длина связи A-B в переходном состоянии, а R 0 AB в молекуле продукта. Аналогично для связи, которая разрывается в реакции, R * BC = R BC - R 0 BC., где R 0 BC относится к молекуле реагента. [8]
Для экзотермических реакций ППЭ классифицируется как привлекательный (или рано спускающийся ), если R * AB > R * BC , так что переходное состояние достигается, когда реагенты приближаются друг к другу. После переходного состояния длина связи A-B продолжает уменьшаться, так что большая часть высвободившейся энергии реакции преобразуется в колебательную энергию связи A-B. [8] [9] Примером может служить гарпунная реакция K + Br 2 → K-Br + Br, в которой начальное дальнодействующее притяжение реагентов приводит к активированному комплексу, напоминающему K + ••• Br - ••• Br. [8]Колебательно-возбужденные популяции молекул продуктов могут быть обнаружены с помощью инфракрасной хемилюминесценции . [10] [11]
Напротив, PES для реакции H + Cl 2 → HCl + Cl является отталкивающим (или поздним спадом ), потому что R * HCl <R * ClCl, и переходное состояние достигается, когда продукты разделяются. [8] [9] Для этой реакции, в которой атом A (здесь H) легче, чем B и C, энергия реакции выделяется в основном как поступательная кинетическая энергия продуктов. [8] Для такой реакции, как F + H 2 → HF + H, в которой атом A тяжелее, чем B и C, происходит смешанное высвобождение энергии, как колебательное, так и поступательное, даже несмотря на то, что ППЭ является отталкивающим. [8]
Для эндотермических реакций тип поверхности определяет тип энергии, который наиболее эффективно вызывает реакцию. Поступательная энергия реагентов наиболее эффективна для инициирования реакций с притягивающей поверхностью, в то время как колебательное возбуждение (до более высокого колебательного квантового числа v) более эффективно для реакций с отталкивающей поверхностью. [8] В качестве примера последнего случая, реакция F + HCl (v = 1) → Cl + HF примерно в пять раз быстрее, чем F + HCl (v = 0) → Cl + HF для той же полной энергии HCl. . [12]
История [ править ]
Концепция поверхности потенциальной энергии для химических реакций была впервые предложена французским физиком Рене Марселином в 1913 году. [13] Первый полуэмпирический расчет поверхности потенциальной энергии был предложен для реакции H + H 2 Генри Эйрингом и Майклом. Поланьи в 1931 году. Эйринг использовал поверхности потенциальной энергии для расчета констант скорости реакции в теории переходного состояния в 1935 году.
H + H 2 двумерный PES [ править ]
Поверхности потенциальной энергии обычно изображаются в виде трехмерных графиков, но они также могут быть представлены двухмерными графиками, на которых развитие реакции отображается с помощью изоэнергетических линий. Коллинеарная система H + H 2 представляет собой простую реакцию, которая позволяет легко и понятно построить двухмерный PES. В этой реакции атом водорода (H) реагирует с молекулой дигидрогена (H 2 ), образуя новую связь с одним атомом молекулы, которая, в свою очередь, разрывает связь исходной молекулы. Это обозначается как H a + H b –H c → H a –H b + H c.. Развитие реакции от реагентов (H + H₂) к продуктам (HHH), а также энергия частиц, которые принимают участие в реакции, хорошо определены на соответствующей поверхности потенциальной энергии. Профили энергии описывают потенциальную энергию как функцию геометрических переменных (ППЭ в любом измерении не зависят от времени и температуры).
У нас есть разные соответствующие элементы в 2-D PES:
- Двухмерный график показывает точки минимума, в которых мы находим реагенты , продукты и седловую точку или переходное состояние .
- Переходное состояние - это максимум по координате реакции и минимум по координате, перпендикулярной пути реакции.
- Ход времени описывает траекторию каждой реакции. В зависимости от условий реакции процесс будет показывать разные способы получения продукта, нанесенные между двумя осями.
См. Также [ править ]
- Вычислительная химия
- Минимизация энергии (или оптимизация геометрии)
- Энергетический профиль (химия)
- Координата реакции
Ссылки [ править ]
- ^ Потенциально-энергия (реакция) поверхность в Сборнике химической терминологии, 2-е изд. («Золотая книга»). Составлено AD McNaught и A. Wilkinson. Научные публикации Блэквелла, Оксфорд (1997)
- ^ Сато, С. (1955). «Новый метод рисования поверхности потенциальной энергии» . Бюллетень химического общества Японии . 28 (7): 450–453. DOI : 10.1246 / bcsj.28.450 .Сато, Шин (1955). «О новом методе рисования поверхности потенциальной энергии». Журнал химической физики . 23 (3): 592–593. Bibcode : 1955JChPh..23..592S . DOI : 10.1063 / 1.1742043 .
- ^ Кейт Дж. Лэйдлер , Химическая кинетика (3-е изд., Harper & Row 1987), стр.68-70 ISBN 0-06-043862-2
- ^ Steinfeld JI, Francisco JS и Hase WL Химическая кинетика и динамика (2-е изд., Prentice-Hall 1998) стр.201-2 ISBN 0-13-737123-3
- ^ Улучшенная интерполяция Шепарда методом наименьших квадратов для быстрых маршевых и струнных методов, Burger SK1, Liu Y, Sarkar U, Ayers PW, J Chem Phys. 2009 130 (2) 024103. DOI: 10.1063 / 1.2996579.
- ^ Привлекательная поверхность потенциальной энергии в Сборнике химической терминологии, 2-е изд. («Золотая книга»). Составлено AD McNaught и A. Wilkinson. Научные публикации Блэквелла, Оксфорд (1997)
- ^ Отталкивающая поверхность потенциальной энергии в Сборнике химической терминологии, 2-е изд. («Золотая книга»). Составлено AD McNaught и A. Wilkinson. Научные публикации Блэквелла, Оксфорд (1997)
- ^ a b c d e f g Кейт Дж. Лэйдлер , Химическая кинетика (3-е изд., Harper & Row, 1987), стр. 461-8 ISBN 0-06-043862-2
- ^ a b Steinfeld JI, Francisco JS и Hase WL Химическая кинетика и динамика (2-е изд., Prentice-Hall 1998) с.272-4 ISBN 0-13-737123-3
- ^ Steinfeld JI, Francisco JS и Hase WL Химическая кинетика и динамика (2-е изд., Prentice-Hall 1998) стр.263 ISBN 0-13-737123-3
- ^ Аткинс П. и де Паула Дж. Физическая химия (8-е изд., WHFreeman 2006) стр.886 ISBN 0-7167-8759-8
- ^ Аткинс П. и де Паула Дж. Физическая химия (8-е изд., WHFreeman 2006) стр. 889-890 ISBN 0-7167-8759-8
- ^ Вычислительная химия: Введение в теорию и приложения молекулярной и квантовой механики Эррол Г. Льюарс, 2-е изд. (Springer 2011) стр.21 ISBN 978-9048138616