 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Энол-Лютеовис |
| Другие названия | W-3399; 3-циклопентиленоловый эфир прогестерона; PCPE; 3-Циклопентилоксипрегна-3,5-диен-20-он |
| Пути администрирования | Устно |
| Класс препарата | Гестаген ; Прогестин ; Эфир прогестагена ; Нейростероид |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
| Формула | С 26 Н 38 О 2 |
| Молярная масса | 382,588 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
Квингестрон , также известный как прогестерон-3-циклопентиленоловый эфир ( PCPE ) и продаваемый под торговой маркой Enol-Luteovis , представляет собой прогестиновый препарат, который ранее использовался в противозачаточных таблетках в Италии, но теперь больше не продается. [1] [2] [3] [4] [5] Принимается внутрь . [6]
Quingestrone является прогестин, или синтетический прогестаген , и , следовательно , является агонистом из рецептора прогестерона , то биологическая мишень прогестагенов как прогестерон . [1] [7] [8] Обладает слабой глюкокортикоидной активностью. [9] [10] [11]
Квингестрон был введен для использования в медицине в 1962 году. [6] [12] Он больше не доступен. [13]
Медицинское использование [ править ]
Квингестрон ранее использовался в комбинации с этинилэстрадиолом или местранолом в комбинированных противозачаточных таблетках в Италии . [2] [3] Препарат изучался с точки зрения клинической профилактики выкидыша во время беременности , но наблюдалась недостаточная эффективность в оцененной дозировке (100 мг / день перорально). [14] [15] [16] [17]
Побочные эффекты [ править ]
Фармакология [ править ]
Фармакодинамика [ править ]
Наряду с производным ретропрогестерона дидрогестероном , квингестрон был описан как «истинное» производное прогестерона или прогестоген из-за его близкого сходства с природным прогестероном. [18] [12] Как и прогестерон, дидрогестерон и гидроксипрогестерон капроат , квингестрон является чистым прогестогеном и не обладает андрогенными эффектами. [19] Таким образом, он не представляет риска андрогенных побочных эффектов или вирилизирующих тератогенных эффектов на плод женского пола. [19] Квингестрон влияет на гипоталамо-гипофизарно-надпочечниковую систему.аналогично прогестерону и медроксипрогестерона ацетату , подавляя надпочечники при достаточно высоких дозах, и это предполагает, что он обладает слабой глюкокортикоидной активностью, как и прогестерон. [9] [10] [11]
Квингестрон - очень слабый гестаген. [8] [11] При пероральном или внутрибрюшинном введении животным препарат демонстрировал 1/80 и 1/20 эффективность подкожно введенного прогестерона, соответственно. [8] Точно так же пероральные дозы квингестрона, в 10-20 раз превышающие дозу подкожного прогестерона, были недостаточны для поддержания беременности у животных, а пероральные или внутрибрюшинные дозы квингестрона, в 20-40 раз превышающие пероральные или внутрибрюшинные дозы прогестерона, не могли усиливать действие гексобарбитала. анестезия у животных (которую действует и, как полагают, делает прогестерон, подавляя печеночную Метаболизм из барбитуратов ). [8] При пероральном введении равных доз прогестерона и квингестрона животным в 3–4 раза меньше прегнандиола было извлечено из мочи с кингестроном. [8] Тот факт, что квингестрон более эффективен при внутрибрюшинном, чем при пероральном введении животным, предполагает, что в кишечнике он превращается в менее активный метаболит . [8]
Эффективная дозировка квингестрона в тесте на задержку менструального цикла была изучена. [20]
Квингестрон не оказывает обезболивающего действия на животных, в отличие от прогестерона. [21] [22]
Фармакокинетика [ править ]
Было высказано предположение, что квингестрон действует как пролекарство прогестерона посредством медленного гидролиза в организме. [14] [23] Действительно, он производит аналогичные метаболиты (например, прегнандиолы и аллопрегнандиолы ), что и прогестерон, [14] [24], хотя и с разными соотношениями, [25] [4] и, в частности, является единственным прогестином, который, как известно, производит прегнандиол как метаболит. [6] Последующие исследования поставили под сомнение представление о том, что квингестрон является пролекарством прогестерона, и показали, что вместо этого он непосредственно метаболизируется в прегнандиолы безпромежуточное превращение в прогестерон. [8] На основании своей химической структуры квингестрон может превращаться в 3α-дигидропрогестерон и / или 3β-дигидропрогестерон, а затем метаболизироваться в прегнанолоны и прегнандиолы. Сообщалось, что 3β-дигидропрогестерон обладает примерно такой же прогестагенной активностью, что и прогестерон в тесте Клауберга , тогда как 3α-дигидропрогестерон не оценивался. [26] [27]
По отношению к прогестерону, quingestrone показывает , улучшается фармакокинетика , в том числе более высокой потенции , [25] оральной активности , [28] и более терминала полураспада и , следовательно , продолжительность действия . [23] Считается, что это связано с его более высокой липофильностью , [23] накапливается и медленно высвобождается из жира . [5] [14] Квингестрон также показывает более медленный метаболизм и более стабильные уровни в крови, с более длительным временем достижения пиковых концентраций и менее интенсивным пиком по сравнению с прогестероном. [7]Биодоступность квингестрона наиболее высока, когда он вводится в виде раствора кунжутного масла (по сравнению с масляной суспензией (примерно в 2 раза меньше) или микронизированной (примерно в 7 раз меньше)). [24]
Простые эфиры C3 енола прогестерона в меньшей степени подходят для использования посредством инъекций депо по сравнению со сложными эфирами прогестагена, такими как гидроксипрогестерона капроат, из-за их чувствительности к окислительному метаболизму . [29]
Проведен обзор фармакокинетики квингестрона. [21]
Химия [ править ]
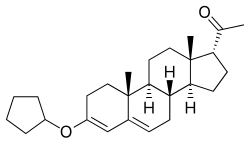
Quingestrone, также известный как прогестерон 3-циклопентили енольный эфир (PCPE) или как 3-cyclopentyloxypregna-3,5-диен-20-он, является синтетическим прегнан стероидом и производный от прогестерона . [1] Это, в частности, 3- циклопентиленоловый эфир прогестерона. [1] Квингестрон тесно связан с 3- ацетиленольным эфиром прогестерона и ацетатом пентагестрона (17α-ацетоксипрогестерон-3-циклопентиленоловый эфир). [1]
Синтез [ править ]
Опубликованы результаты химического синтеза квингестрона. [21]
История [ править ]
Квингестрон, по-видимому, был впервые синтезирован в 1936 году. [30] Он был введен для медицинского применения в Италии в 1962 году. [6] [12]
Общество и культура [ править ]
Общие имена [ править ]
Quingestrone - это общее название препарата с его МНН и USAN . [1] Он также известен под кодовым названием W-3399 . [1]
Торговые марки [ править ]
Quingestrone продавался под торговой маркой Enol-Luteovis. [1] [13]
Доступность [ править ]
Quingestrone больше не продается и, следовательно, больше не доступен ни в одной стране. [13] Ранее он был доступен в Италии . [13]
Ссылки [ править ]
- ^ a b c d e f g h Дж. Элкс (14 ноября 2014 г.). Elks, J; Ганеллин, С. Р. (ред.). Словарь лекарств: химические данные: химические данные, структуры и библиографии . Springer. п. 1058. DOI : 10.1007 / 978-1-4757-2085-3 . ISBN 978-1-4757-2085-3. OCLC 898564124 .
- ^ a b Международная федерация планируемого родительства. Медицинский комитет. Устная консультативная группа (1965). Справочник по оральной контрацепции . Маленький, Браун. п. 18. OCLC 2717593 .
- ^ a b Ларри Д., Женева Дж., Пессайр Д., Мачаехи Дж. П., Деготт С., Бенхаму Дж. П. (1987). «Длительный холестаз после острого гепатита, вызванного ципрогептадином». J. Clin. Гастроэнтерол . 9 (1): 102–4. DOI : 10.1097 / 00004836-198702000-00026 . ISSN 0192-0790 . PMID 3559100 .
С 1980 года она принимала оральные контрацептивы, сочетающие этинилэстрадиол и кингестрон.
- ^ а б Денис Фрэнк Хокинс (1974). Акушерская терапия: клиническая фармакология и терапия в акушерской практике . Байер Тиндаль. с. 129, 138, 145. ISBN 978-0-7020-0471-1.
- ^ а б П. Дж. Бентли (1980). Эндокринная фармакология: физиологические основы и терапевтическое применение . КУБОК Архив. С. 274–. ISBN 978-0-521-22673-8.
- ^ a b c d Современная медицина и наркотики . 1962. ISSN 0590-4048 .
Enol Luteovis (3-циклопентиленоловый эфир прогестерона) является единственным пероральным прогестином, продуцирующим прегнандиол в качестве метаболита.
Он не очень эффективен и, вероятно, имеет очень небольшой риск вызвать вирилизирующий эффект на плод женского пола.
Таким образом, он более тесно связан с прогестероном, чем другие синтетические прогестины.
- ^ a b Caie, E .; Клоппер, А. (1964). «Выведение с мочой прегнандиола после приема перорального гестагена (прогестерон циклопентилэноловый эфир)». Журнал эндокринологии . 28 (2): 221–222. CiteSeerX 10.1.1.1028.4921 . DOI : 10,1677 / joe.0.0280221 . ISSN 0022-0795 . PMID 14112260 .
- ^ a b c d e f g Meli, A .; Wolff, A .; Лакер, МЫ; Стейнец, Б.Г. (1965). «Биологический профиль эфира прогестерона 3-циклопентил енола по сравнению с профилем прогестерона». Экспериментальная биология и медицина . 118 (3): 714–717. DOI : 10.3181 / 00379727-118-29947 . ISSN 1535-3702 . PMID 14264537 . S2CID 11891451 .
- ^ а б Лучано Мартини (1966). Нейроэндокринология . Академическая пресса. п. 331. ISBN. 9780124753525. LCCN 66026256 .
- ^ a b Steinetz, BG; Пляж, ВЛ; DiPasquale, G .; Баттиста, СП (1965). «Влияние различных типов гестагенных стероидов на уровни свободных кортикостероидов в плазме у крыс, получавших АКТГ». Стероиды . 5 (1): 93–108. DOI : 10.1016 / 0039-128X (65) 90134-0 . ISSN 0039-128X .
- ^ a b c Gaunt R, Steinetz BG, Chart JJ (1968). «Фармакологическое изменение функций стероидных гормонов». Clin. Pharmacol. Ther . 9 (5): 657–81. DOI : 10.1002 / cpt196895657 . PMID 4175595 .
Интересным веществом, которому уделяется мало внимания, является 3-циклопентиленоловый эфир прогестерона (квингестрон). Это очень слабый прогестагент, требующий 50 мг. на крысу для поддержания беременности. 100 В этой дозе кингестрон снижает массу надпочечников у самцов крыс до уровня, наблюдаемого после гипофизэктомии, и предотвращает любое повышение уровня кортикостероидов в плазме в ответ на максимально стимулирующую дозу АКТГ. секреция. Однако сомнительно, что прогестагенты оказывают клинически важное действие на надпочечники человека в обычно используемых дозах. Тем не менее, учитывая длительное воздействие гестогенов в качестве контрацептивов на женщин, этот фактор заслуживает постоянного наблюдения.
- ^ a b c Appleby B (февраль 1962 г.). «Норэтистерон в контроле симптомов менопаузы». Ланцет . 1 (7226): 407–9. DOI : 10.1016 / s0140-6736 (62) 91363-6 . PMID 13861933 .
Доктор Эпплби оказал бы научную услугу, если бы он продлил свое испытание, [...] используя предпочтительно истинное производное прогестерона, такое как [...] циклопентиленоловый эфир прогестерона («Enol Luteovis», Vister).
- ^ а б в г http://www.micromedexsolutions.com/micromedex2/
- ^ a b c d Бертон, Юнис Р.; Вахтель, Эрика Г. (1967). «Клинические испытания и цитологическая оценка Enol Luteovis в лечении угрожающего и рецидивирующего аборта». BJOG: Международный журнал акушерства и гинекологии . 74 (4): 533–536. DOI : 10.1111 / j.1471-0528.1967.tb03986.x . ISSN 1470-0328 . PMID 5340429 . S2CID 31602503 .
- ^ Витамины и гормоны . Академическая пресса. 9 февраля 1973 г. С. 332–. ISBN 978-0-08-086627-7.
- ↑ Ян С. Фрейзер (1998). Эстрогены и прогестагены в клинической практике . Черчилль Ливингстон. ISBN 978-0-443-04706-0.
- ^ Голдштейн, Питер; Берье, Джейн; Розен, Скотт; Мешки, Генри С .; Чалмерс, Томас К. (1989). «Метаанализ рандомизированных контрольных исследований прогестагентов при беременности». BJOG: Международный журнал акушерства и гинекологии . 96 (3): 265–274. DOI : 10.1111 / j.1471-0528.1989.tb02385.x . ISSN 1470-0328 . PMID 2653414 . S2CID 72030836 .
- ↑ Эрика Г. Вахтель (1969). Эксфолиативная цитология в гинекологической практике . Appleton-Century-Crofts. п. 134. LCCN 77008744 .
- ^ а б Дугальд Бэрд; Джон Мартин Манро Керр (1969). Комбинированный учебник акушерства и гинекологии для студентов и практиков . Э. и С. Ливингстон. LCCN 70360656 .
- ^ Эдгрен RA, Sturtevant FM (август 1976). «Возможности оральных контрацептивов». Являюсь. J. Obstet. Гинеколь . 125 (8): 1029–38. DOI : 10.1016 / 0002-9378 (76) 90804-8 . PMID 952300 .
- ^ a b c Junkmann, Карл (1968). Die Gestagene . Springer-Verlag. с. 10, 275, 524. ISBN 978-3-642-99941-3.
- ^ Эрколи, Альберто; Гарди, Ринальдо (1960). «Δ 4-3 -кето-стероидные эфиры энола. Парадоксальная зависимость их эффективности от пути введения». Журнал Американского химического общества . 82 (3): 746–748. DOI : 10.1021 / ja01488a062 . ISSN 0002-7863 .
- ^ a b c Чарман, Уильям Н .; Портер, Кристофер JH (1996). «Липофильные пролекарства, предназначенные для лимфатического транспорта кишечника». Расширенные обзоры доставки лекарств . 19 (2): 149–169. DOI : 10.1016 / 0169-409X (95) 00105-G . ISSN 0169-409X .
- ^ a b Fatouros DG, Karpf DM, Nielsen FS, Mullertz A (2007). «Клинические исследования слаборастворимых соединений на липидной основе для перорального применения» . Ther Clin Risk Manag . 3 (4): 591–604. PMC 2374933 . PMID 18472981 .
- ^ a b «Пенсия ПОПЛАЙН» . 2019-09-06.
- ^ Junkermann H, Runnebaum B, Lisboa BP (июль 1977). «Новые метаболиты прогестерона в миометрии человека». Стероиды . 30 (1): 1–14. DOI : 10.1016 / 0039-128X (77) 90131-3 . PMID 919010 . S2CID 28420255 .
В биоанализе Клауберга 3β-гидрокси-4-прегнен-20-он показывает примерно такую же эффективность, что и прогестерон (34).
Относительно биологической активности 3α-эпимера данные отсутствуют.
- Перейти ↑ Pincus G, Miyake T, Merrill AP, Longo P (ноябрь 1957 г.). «Биопроба прогестерона» . Эндокринология . 61 (5): 528–33. DOI : 10,1210 / эндо-61-5-528 . PMID 13480263 .
- ↑ Джозеф Боливар Де Ли (1965). "... Ежегодник акушерства и гинекологии" . Ежегодник акушерства и гинекологии (O) . Издательство ежегодника : 150. ISSN 0084-3911 . LCCN cdr38000020 .
- ^ Junkmann, Карл (1954). «Гестагены пролонгированного действия». Naunyn-Schmiedebergs Archiv für Pharmakologie und Experimentelle Pathologie . 223 : 244–53. ISSN 0365-5423 .
Среди больших нет. производных прегнана. сложные эфиры 17-α-гидроксипрогестерона (I), самого слабого лютеинового гормона, обладают сильным и длительным действием гестагена. Оптимальные результаты достигаются с I caproate. Это позволяет вводить депо-дозы в прозрачных растворах. В используемом диапазоне доз андрогенного эффекта не отмечалось. Он не влияет на рост и вторичные половые признаки у инфантильных и взрослых кастрированных самцов крыс. 3-енольные эфиры прогестерона, которые обладают несколько пролонгированным действием, менее подходят для введения депо из-за их окисляемости.
- ^ Вестфаль, Ульрих (1936). «Убер энолацетат прогестеронов и тестостеронов». Die Naturwissenschaften . 24 (44): 696–697. DOI : 10.1007 / BF01491541 . ISSN 0028-1042 . S2CID 41442733 .