| Ромбовидный | ||||||||
|---|---|---|---|---|---|---|---|---|
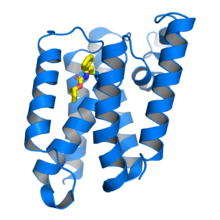 Ромбовидная протеаза GlpG Escherichia coli в комплексе сингибитором бета-лактама (желтый), связанным с каталитическимостатком серина . Из PDB : 3ZMH . [1] | ||||||||
| Идентификаторы | ||||||||
| Символ | Ромбовидный | |||||||
| Pfam | PF01694 | |||||||
| Клан пфам | CL0207 | |||||||
| ИнтерПро | IPR002610 | |||||||
| МЕРОПЫ | S54 | |||||||
| SCOP2 | 144092 / СФЕРА / СУПФАМ | |||||||
| OPM суперсемейство | 165 | |||||||
| Белок OPM | 2ic8 | |||||||
| ||||||||
В ромбовидных протеаз представляют собой семейство ферментов , которые существуют практически во всех видах. Это протеазы : они перерезают полипептидную цепь других белков. Это протеолитическое расщепление необратимо в клетках и является важным типом клеточной регуляции. Хотя протеазы являются одним из самых ранних и наиболее изученных классов ферментов, ромбоиды принадлежат к гораздо более недавно открытому типу: внутримембранным протеазам . Что уникально внутримембранных протеаз является то , что их активные участки захоронены в липидный бислой из клеточных мембран , и они расщепляют другие трансмембранных белков в пределах ихтрансмембранные домены . [2] Около 30% всех белков имеют трансмембранные домены, и их регулируемый процессинг часто имеет серьезные биологические последствия. Соответственно, ромбовидные тела регулируют многие важные клеточные процессы и могут быть вовлечены в широкий спектр заболеваний человека.
Интрамембранные протеазы [ править ]
Ромбовидные тела - это внутримембранные сериновые протеазы . [3] [4] [5] Другими типами внутримембранных протеаз являются аспартил- и металлопротеазы соответственно. Семейство пресенилинов и сигнальных пептидазоподобных пептидаз , которые представляют собой внутримембранные аспартилпротеазы, расщепляют субстраты, которые включают рецептор Notch и белок-предшественник амилоида , который участвует в болезни Альцгеймера . Семейство протеаз сайта 2 , которые представляют собой внутримембранные металлопротеиназы, регулируют, помимо прочего, биосинтез холестерина и стрессовые реакции в организме человека.бактерии . Различные семейства внутримембранных протеаз эволюционно и механистически не связаны, но есть четкие общие функциональные темы, которые их связывают. Ромбовидные, пожалуй, наиболее охарактеризованный класс.
История [ править ]
Ромбовидные были первые названы после того, как мутация в плодовой мушки дрозофилы , обнаруженная в известном генетическом скрининге , что привело к Нобелевской премии по Нюсляйн-Фольхард и Эрик Wieschaus . [6] На этом скрининге они обнаружили ряд мутантов со схожими фенотипами: «заостренные» скелеты головы эмбриона. Они назвали каждого из них остроконечным именем - одно из них было ромбовидным. Позже генетический анализ подтвердил, что эта группа генов является членами сигнального пути рецептора эпидермального фактора роста (EGF) [7] [8] и что ромбовидный элемент необходим для генерации сигнала, активирующего рецептор EGF. [9] [10]Молекулярная функция ромбовидных тел потребовалось немного больше времени, чтобы раскрыть их, но сочетание генетики и молекулярных методов привело к открытию, что ромбовидные дрозофилы и другие члены этого семейства были первыми известными внутримембранными сериновыми протеазами. [3]
Функция [ править ]
Ромбоиды были впервые обнаружены как протеазы, которые регулируют передачу сигналов рецептора EGF у дрозофилы . Высвобождая внеклеточный домен фактора роста Spitz из его трансмембранного предшественника, ромбовидный запускает передачу сигналов. [3] С тех пор были предложены многие другие важные биологические функции. [11] [12]
- Хотя это менее хорошо установлено, чем у Drosophila, есть некоторые доказательства того, что ромбовидные тела могут участвовать в передаче сигналов фактора роста у млекопитающих, включая человека. [13] Они также участвуют в передаче сигналов эфрина [14], расщеплении антикоагулянтного белка тромбомодулина [15] и заживлении ран . [16]
- У всех эукариот есть митохондриальный ромб. У дрожжей это, как было показано, контролирует функцию и морфологию митохондрий, регулируя слияние мембран посредством расщепления динамин- подобной GTPase, называемой Mgm1p, ортолога человеческого OPA1 . [17] [18] У дрозофилы митохондриальный ромбовид также регулирует слияние митохондриальных мембран. [19] У млекопитающих также нарушена функция митохондрий у мутантов PARL , митохондриального ромбовидного тела , но спектр функций более сложен. PARL регулирует ремоделирование митохондриальных крист , [20]участвуют в клеточной гибели [20] и обмен веществ , [21] , и есть все больше свидетельств о важной роли в болезни Паркинсона ; [22] [23] [24]
- Apicomplexan паразиты, такие как Plasmodium (агент, вызывающий малярию ) и Toxoplasma, по- видимому, используют ромбовидные формы для расщепления белков клеточной поверхности, которые участвуют в процессе инвазии хозяина. [25] [26] [27] [28] [29] [30] Ромбовидные формы также вовлечены в патогенность других паразитов. [31]
- Ромбовидный элемент у грамотрицательной бактерии Providencia stuartii необходим для функционирования механизма транслокации белков двойного аргинина (ТАТ). [32]
Структура [ править ]
Ромбоиды были первыми внутримембранными протеазами, для которых была решена кристаллическая структура с высоким разрешением . [33] [34] [35] [36] [37] Эти структуры подтвердили предсказания о том, что ромбоиды имеют ядро из шести трансмембранных доменов и что каталитический сайт зависит от каталитической диады серина и гистидина. Структуры также объяснили, как протеолитическая реакция, для которой требуются молекулы воды, может происходить в гидрофобной среде липидного бислоя: одна из центральных загадок внутримембранных протеаз. [38] Активный центр ромбовидной протеазы находится в гидрофильном углублении, в принципе доступном для воды из основного раствора. [33] [34] [35] [36][37] Однако было высказано предположение, что может существовать вспомогательный механизм для облегчения доступа молекул воды к каталитической диаде на дне активного центра для обеспечения каталитической эффективности. [39]
Активный центр ромбовидной протеазы защищен латерально от липидного бислоя шестью составляющими его трансмембранными спиралями, что позволяет предположить, что доступ субстрата к активному центру ромбовидной железы регулируется. Одной из областей неопределенности был путь доступа к субстрату . Первоначально предлагалось ввести субстраты между трансмембранными сегментами (TMS) 1 и 3, [33] [36], но имеющиеся данные убедительно подтверждают альтернативную точку доступа, между TMS 2 и 5. [34] [35] [37] [40] [41] Это мнение также подтверждается тем фактом, что мутации в TMS 5 имеют лишь незначительное влияние на термодинамическую стабильность ромбовидной формы, в отличие от других областей молекулы. [42]Совсем недавно первая в истории сокристаллическая структура внутримембранной протеазы - ромбовидной протеазы Escherichia coli GlpG - и пептида, полученного из субстрата, связанного в активном сайте [43], подтверждает и расширяет эту модель доступа к субстрату и дает представление о механизме действия субстрата. другие белки ромбовидного суперсемейства. [44] Однако детали того, как субстрат TMS может распознаваться ромбовидной структурой, все еще неясны. Некоторые авторы предполагают, что доступ к субстрату включает большое латеральное смещение TMS 5, чтобы открыть сердцевину ромбовидной кости. [34] [40] В других сообщениях вместо этого предполагается, что большого бокового движения TMS 5 не требуется, [45]и предполагают, что поверхность TMS 2 и 5 скорее служит «внутримембранным экзосайтом», опосредующим распознавание субстрата TMS. [43] [46]
Ферментативная специфичность [ править ]
Ромбовидные клетки не расщепляют все трансмембранные домены. Фактически, они очень специфичны, с ограниченным количеством субстратов. Большинство известных к настоящему времени природных ромбовидных субстратов представляют собой белки с одним трансмембранным доменом типа 1, амино-концы которых находятся в просвете / внеклеточном компартменте. Однако недавние исследования показали, что мембранный белок типа 2 (т.е. с противоположной топологией: амино-конец является цитоплазматическим) [47] или даже многопроходные мембранные белки могут действовать как ромбовидные субстраты. [48] Специфичность ромбовидных тел лежит в основе их способности контролировать функции в широком диапазоне биологических процессов и, в свою очередь, понимание того, что делает конкретный трансмембранный домен ромбовидным субстратом, может пролить свет на функцию ромбовидной формы в различных контекстах.
Первоначальная работа показала, что ромбовидные формы распознают нестабильность трансмембранной альфа-спирали в месте расщепления в качестве основной детерминанты субстрата. [49] Совсем недавно было обнаружено, что ромбовидные субстраты определяются двумя отдельными элементами: трансмембранным доменом и мотивом первичной последовательности в нем или непосредственно рядом с ним. [46] Этот мотив распознавания определяет место расщепления субстрата, которое может происходить как внутри, так и вне трансмембранного домена, в прилегающей к мембране области. [46] В первом случае дестабилизирующие спираль остатки в субстрате TMS также необходимы для эффективного расщепления. [46]Подробный анализ кинетики ферментов фактически показал, что взаимодействия мотива распознавания с активным центром ромбовидной формы определяют k cat расщепления субстрата. [50] Принципы распознавания субстрата TMS ромбовидными остаются плохо изученными, но многочисленные доказательства указывают на то, что ромбоиды (и, возможно, также другие внутримембранные протеазы ) каким-то образом распознают структурную гибкость или динамику трансмембранного домена своих субстратов. [39] [51] Полное понимание задействованных биофизических и структурных принципов потребует структурной характеристики комплекса ромбовидного с полным трансмембранным субстратом. [52]В качестве первого шага к этой цели недавняя сокристаллическая структура фермента в комплексе с производным от субстрата пептидом, содержащим основанный на механизме ингибитор, объясняет наблюдаемые предпочтения последовательностей мотива распознавания в ромбовидных субстратах структурно и обеспечивает значительный прогресс в нынешних условиях. понимание ромбовидной специфичности и механизма белков ромбовидного семейства. [43]
У некоторых грамотрицательных бактерий, включая Shewanella и Vibrio , до тринадцати белков обнаруживаются с GlyGly-CTERM, C-концевым доменом гомологии, состоящим из богатого глицином мотива, высокогидрофобной трансмембранной спирали и кластера основных остатков. Этот домен, по-видимому, является последовательностью узнавания для ромбосортазы, ответвления семейства ромбовидных протеаз, ограниченного только бактериями с доменом GlyGly-CTERM. [53]
Медицинское значение [ править ]
Уже известно, что разнообразие биологических функций, зависящих от ромбовидных тел, отражено в доказательствах того, что ромбовидные тела играют роль в различных заболеваниях, включая рак , паразитарные инфекции и диабет . [12] [54] Важно отметить, однако, что еще не установлено ни одного случая, когда точное медицинское значение было бы полностью подтверждено.
О лекарствах, которые модулируют активность ромбовидной железы, еще не сообщалось, хотя недавнее исследование выявило низкомолекулярные ингибиторы, основанные на механизме, которые могут стать основой для разработки будущих лекарств. [55]
Ромбовидная семья [ править ]
Ромбовидные протеазы, по-видимому, консервативны у всех эукариот и подавляющего большинства прокариот . Биоинформатический анализ подчеркивает, что у некоторых членов семейства ромбовидных нет аминокислотных остатков, необходимых для протеолиза, что означает, что они не могут расщеплять субстраты. Эти «псевдопротеазы» включают подсемейство, названное iRhoms [56] (также известное как RHBDF1 и RHBDF2 ). iRhoms может способствовать ER-ассоциированной деградации (ERAD) лигандов рецептора EGF у дрозофилы, тем самым обеспечивая механизм регуляции активности рецептора EGF в головном мозге. [57]Это означает, что фундаментальный механизм контроля качества клеток используется многоклеточными организмами для регулирования передачи сигналов между клетками. У мышей iRhoms являются ключевыми шаперонами трафика, необходимыми для экспорта ADAM17 / TACE в ER и его созревания. Таким образом, iRhoms необходимы для передачи сигналов рецепторами TNF-альфа и EGF , что делает их очень привлекательными с медицинской точки зрения. [57] [58] [59] [60] [61]
Филогенетический анализ показывает, что ромбоиды на самом деле являются членами более крупного ромбовидного суперсемейства или клана, которое включает белки дерлина , также участвующие в ERAD. [62]
Ссылки [ править ]
- ^ Vinothkumar KR, Pierrat О.А., Большой JM, Freeman M (июнь 2013). «Структура ромбовидной протеазы в комплексе с ингибиторами β-лактама определяет полость S2 '» . Структура . 21 (6): 1051–8. DOI : 10.1016 / j.str.2013.03.013 . PMID 23665170 .
- Перейти ↑ Brown MS, Ye J, Rawson RB, Goldstein JL (февраль 2000 г.). «Регулируемый внутримембранный протеолиз: механизм контроля, сохраняющийся от бактерий к человеку». Cell . 100 (4): 391–8. DOI : 10.1016 / S0092-8674 (00) 80675-3 . PMID 10693756 . S2CID 12194770 .
- ^ a b c Urban S, Ли JR, Freeman M (октябрь 2001 г.). «Drosophila rhomboid-1 определяет семейство предполагаемых внутримембранных сериновых протеаз». Cell . 107 (2): 173–82. DOI : 10.1016 / s0092-8674 (01) 00525-6 . PMID 11672525 . S2CID 9026083 .
- Перейти ↑ Lemberg MK, Menendez J, Misik A, Garcia M, Koth CM, Freeman M (февраль 2005 г.). «Механизм внутримембранного протеолиза исследован с очищенными ромбовидными протеазами» . Журнал EMBO . 24 (3): 464–72. DOI : 10.1038 / sj.emboj.7600537 . PMC 548647 . PMID 15616571 .
- ↑ Urban S, Wolfe MS (февраль 2005 г.). «Восстановление внутримембранного протеолиза in vitro показывает, что чистого ромбоида достаточно для катализа и специфичности» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (6): 1883–8. Bibcode : 2005PNAS..102.1883U . DOI : 10.1073 / pnas.0408306102 . PMC 548546 . PMID 15684070 .
- ^ Г. Юргенс, Е. Wieschaus, С. Nüsslein-Фольхард, Х. Kluding, Вильгельм Ру Arch» Dev Biol. 1984; 193, 283
- ^ М. А. Стертевэнт, М. Роарк, Е. Bier, Genes Dev. 7, 961 (1993)
- ↑ Freeman M (октябрь 1994 г.). «Ген шпица необходим для определения фоторецепторов в глазу дрозофилы, где он взаимодействует с рецептором EGF». Механизмы развития . 48 (1): 25–33. DOI : 10.1016 / 0925-4773 (94) 90003-5 . PMID 7833286 . S2CID 40396109 .
- ^ Вассерман JD, Urban S, M Freeman (июль 2000). «Семейство ромбоподобных генов: Drosophila rhomboid-1 и roughoid / rhomboid-3 взаимодействуют для активации передачи сигналов рецептора EGF» . Гены и развитие . 14 (13): 1651–63. PMC 316740 . PMID 10887159 .
- ^ Банг AG, Кинтнер C (январь 2000). «Ромбовидная форма и звездочка способствуют представлению и переработке шпица, гомолога TGF-альфа дрозофилы» . Гены и развитие . 14 (2): 177–86. PMC 316351 . PMID 10652272 .
- ↑ Freeman M (1 января 2008 г.). «Ромбовидные протеазы и их биологические функции». Ежегодный обзор генетики . 42 : 191–210. DOI : 10.1146 / annurev.genet.42.110807.091628 . PMID 18605900 .
- ^ a b Urban S (июнь 2009 г.). «Делая разрез: центральные роли внутримембранного протеолиза в патогенных микроорганизмах» . Обзоры природы. Микробиология . 7 (6): 411–23. DOI : 10.1038 / nrmicro2130 . PMC 2818034 . PMID 19421188 .
- ^ Adrain C, Strisovsky K, Zettl M, L Ху, Лемберг М.К., Freeman M (май 2011). «Активация рецептора EGF млекопитающих ромбовидной протеазой RHBDL2» . EMBO Reports . 12 (5): 421–7. DOI : 10.1038 / embor.2011.50 . PMC 3090019 . PMID 21494248 .
- ^ Паскол JC, Brown KD (апрель 2004). «Интрамембранное расщепление эфринаB3 протеазой ромбовидного семейства человека, RHBDL2». Сообщения о биохимических и биофизических исследованиях . 317 (1): 244–52. DOI : 10.1016 / j.bbrc.2004.03.039 . PMID 15047175 .
- ^ Lohi O, S Urban, Freeman M (февраль 2004). «Различные механизмы распознавания субстрата для ромбов; тромбомодулин расщепляется ромбами млекопитающих». Текущая биология . 14 (3): 236–41. DOI : 10.1016 / j.cub.2004.01.025 . PMID 14761657 . S2CID 17760607 .
- ↑ Cheng TL, Wu YT, Lin HY, Hsu FC, Liu SK, Chang BI, Chen WS, Lai CH, Shi GY, Wu HL (декабрь 2011 г.). «Функции протеазы ромбовидного семейства RHBDL2 и тромбомодулина в заживлении ран» . Журнал следственной дерматологии . 131 (12): 2486–94. DOI : 10.1038 / jid.2011.230 . PMID 21833011 .
- ^ Herlan М, Vogel Ж, Bornhovd С, Нойперт Вт, Reichert А.С. (июль 2003 г.). «Процессинг Mgm1 протеазой Pcp1 ромбовидного типа необходим для поддержания морфологии митохондрий и митохондриальной ДНК» . Журнал биологической химии . 278 (30): 27781–8. DOI : 10,1074 / jbc.m211311200 . PMID 12707284 .
- ^ McQuibban Г.А., Saurya S, M Freeman (май 2003). «Ремоделирование митохондриальной мембраны, регулируемое консервативной ромбовидной протеазой». Природа . 423 (6939): 537–41. Bibcode : 2003Natur.423..537M . DOI : 10,1038 / природа01633 . PMID 12774122 . S2CID 4398146 .
- ^ McQuibban Г.А., Ли JR, Чжэн L, M Juusola, Freeman M (май 2006). «Нормальная митохондриальная динамика требует ромбоида-7 и влияет на продолжительность жизни дрозофилы и функцию нейронов». Текущая биология . 16 (10): 982–9. DOI : 10.1016 / j.cub.2006.03.062 . PMID 16713954 . S2CID 18751418 .
- ^ a b Циполат S, Рудка Т., Хартманн Д., Коста V, Сернелс Л., Краессертс К., Мецгер К., Фрезза С., Аннаерт В., Д'Адамио Л., Деркс С., Дежегер Т., Пеллегрини Л., Д'Хуге Р., Скоррано Л., Де Строопер Б. (июль 2006 г.). «Митохондриальный ромбовидный PARL регулирует высвобождение цитохрома с во время апоптоза посредством OPA1-зависимого ремоделирования крист». Cell . 126 (1): 163–75. DOI : 10.1016 / j.cell.2006.06.021 . PMID 16839884 . S2CID 6396519 .
- ^ Civitarese А.Е., Маклин П.С., Карлинг S, Керр-Bayles л, Макмиллэн Р.П., Пирс А, Беккер ТС, Moro С, Финлэйсоном Дж, Лефорт Н, Newgard СВ, Mandarino л, Чефал Вт, Walder К, Коллир ГР, Hulver МВт , Смит С.Р., Равуссин Э. (май 2010 г.). «Регулирование окислительной способности скелетных мышц и передачи сигналов инсулина митохондриальной ромбовидной протеазой PARL» . Клеточный метаболизм . 11 (5): 412–26. DOI : 10.1016 / j.cmet.2010.04.004 . PMC 3835349 . PMID 20444421 .
- ↑ Whitworth AJ, Lee JR, Ho VM, Flick R, Chowdhury R, McQuibban GA (2008). «Ромбоид-7 и HtrA2 / Omi действуют по общему пути с факторами болезни Паркинсона Pink1 и Parkin» . Модели и механизмы заболеваний . 1 (2–3): 168–74, обсуждение 173. doi : 10.1242 / dmm.000109 . PMC 2562193 . PMID 19048081 .
- ^ Deas E, Plun-Favreau H, Gandhi S, Desmond H, Kjaer S, Loh SH, Renton AE, Harvey RJ, Whitworth AJ, Martins LM, Abramov AY, Wood NW (март 2011 г.). «Расщепление PINK1 в положении A103 митохондриальной протеазой PARL» . Молекулярная генетика человека . 20 (5): 867–79. DOI : 10,1093 / HMG / ddq526 . PMC 3033179 . PMID 21138942 .
- ^ Мейснера C, Lorenz H, Weihofen A, Selkoe DJ, Лемберг MK (июнь 2011). «Митохондриальная внутримембранная протеаза PARL расщепляет Pink1 человека, чтобы регулировать трафик Pink1» . Журнал нейрохимии . 117 (5): 856–67. DOI : 10.1111 / j.1471-4159.2011.07253.x . PMID 21426348 .
- Перейти ↑ Urban S, Freeman M (июнь 2003 г.). «Субстратная специфичность ромбовидных внутримембранных протеаз регулируется разрушающими спираль остатками в трансмембранном домене субстрата». Молекулярная клетка . 11 (6): 1425–34. DOI : 10.1016 / s1097-2765 (03) 00181-3 . PMID 12820957 .
- ^ Baker RP, Wijetilaka R, S Urban (октябрь 2006). «Две ромбовидные протеазы Plasmodium предпочтительно расщепляют различные адгезины, участвующие во всех инвазивных стадиях малярии» . PLOS Патогены . 2 (10): e113. DOI : 10.1371 / journal.ppat.0020113 . PMC 1599764 . PMID 17040128 .
- ^ O'Donnell RA, Hackett F, Howell SA, Treeck M, N Поразило, Krnajski Z, Холка-Martinez C, Gilberger TW, Blackman MJ (сентябрь 2006). «Интрамембранный протеолиз опосредует выделение ключевого адгезина во время инвазии эритроцитов малярийным паразитом» . Журнал клеточной биологии . 174 (7): 1023–33. DOI : 10,1083 / jcb.200604136 . PMC 2064393 . PMID 17000879 .
- ^ Сантос JM, Фергюсон DJ, Blackman MJ, Soldati-Фавр D (январь 2011). «Интрамембранное расщепление AMA1 заставляет Toxoplasma переключаться из инвазивного режима в репликативный» . Наука . 331 (6016): 473–7. Bibcode : 2011Sci ... 331..473S . DOI : 10.1126 / science.1199284 . PMID 21205639 . S2CID 26806264 .
- ^ Сринивазан P, Коппенс I, Jacobs-Lorena M (январь 2009). «Отличительные роли Plasmodium rhomboid 1 в развитии паразитов и патогенезе малярии» . PLOS Патогены . 5 (1): e1000262. DOI : 10.1371 / journal.ppat.1000262 . PMC 2607553 . PMID 19148267 .
- ^ Lin JW, Meireles P, Prudêncio M, Engelmann S, Annoura T, Sajid M, Chevalley-Maurel S, Ramesar J, Nahar C, Avramut CM, Koster AJ, Matuschewski K, Waters AP, Janse CJ, Mair GR, Khan SM (Апрель 2013). «Анализ потери функции определяет жизненно важные и избыточные функции семейства ромбовидных протеаз Plasmodium» . Молекулярная микробиология . 88 (2): 318–38. DOI : 10.1111 / mmi.12187 . PMID 23490234 .
- ^ Бакст Л. Бейкер Р.П., Singh U, S Urban (июнь 2008). «Ромбовидная протеаза Entamoeba histolytica с атипичной специфичностью расщепляет поверхностный лектин, участвующий в фагоцитозе и уклонении от иммунитета» . Гены и развитие . 22 (12): 1636–46. DOI : 10,1101 / gad.1667708 . PMC 2428061 . PMID 18559479 .
- ^ Стивенсон LG, Стрисовский K, Клеммер KM, Bhatt S, Freeman M, скорее PN (январь 2007). «Ромбовидная протеаза AarA опосредует восприятие кворума у Providencia stuartii, активируя TatA транслоказы близнецов аргинина» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (3): 1003–8. Bibcode : 2007PNAS..104.1003S . DOI : 10.1073 / pnas.0608140104 . PMC 1783354 . PMID 17215357 .
- ^ a b c Ван И, Чжан И, Ха И (ноябрь 2006 г.). «Кристаллическая структура внутримембранной протеазы ромбовидного семейства». Природа . 444 (7116): 179–80. Bibcode : 2006Natur.444..179W . DOI : 10,1038 / природа05255 . PMID 17051161 . S2CID 4350345 .
- ^ a b c d Wu Z, Yan N, Feng L, Oberstein A, Yan H, Baker RP, Gu L, Jeffrey PD, Urban S, Shi Y (декабрь 2006 г.). «Структурный анализ внутримембранной протеазы ромбовидного семейства выявляет стробирующий механизм для входа субстрата». Структурная и молекулярная биология природы . 13 (12): 1084–91. DOI : 10.1038 / nsmb1179 . PMID 17099694 . S2CID 8308111 .
- ^ a b c Бен-Шем А., Фасс Д., Биби Е. (январь 2007 г.). «Структурные основы внутримембранного протеолиза ромбовидными сериновыми протеазами» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (2): 462–6. Bibcode : 2007PNAS..104..462B . DOI : 10.1073 / pnas.0609773104 . PMC 1766407 . PMID 17190827 .
- ^ a b c Lemieux MJ, Fischer SJ, Cherney MM, Bateman KS, James MN (январь 2007 г.). «Кристаллическая структура ромбовидной пептидазы из Haemophilus influenzae дает представление о внутримембранном протеолизе» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (3): 750–4. Bibcode : 2007PNAS..104..750L . DOI : 10.1073 / pnas.0609981104 . PMC 1783385 . PMID 17210913 .
- ^ a b c Виноткумар KR (март 2011 г.). «Структура ромбовидной протеазы в липидной среде» . Журнал молекулярной биологии . 407 (2): 232–47. DOI : 10.1016 / j.jmb.2011.01.029 . PMC 3093617 . PMID 21256137 .
- Перейти ↑ Lemberg MK, Freeman M (декабрь 2007 г.). «Разрезание белков внутри липидных бислоев: ромбовидная структура и механизм». Молекулярная клетка . 28 (6): 930–40. DOI : 10.1016 / j.molcel.2007.12.003 . PMID 18158892 .
- ↑ a b Moin SM, Urban S (ноябрь 2012 г.). «Мембранная иммерсия позволяет ромбовидным протеазам достичь специфичности путем считывания динамики трансмембранного сегмента» . eLife . 1 : e00173. DOI : 10.7554 / eLife.00173 . PMC 3494066 . PMID 23150798 .
- ^ a b Baker RP, Young K, Feng L, Shi Y, Urban S (май 2007 г.). «Ферментативный анализ ромбовидной внутримембранной протеазы предполагает использование трансмембранной спирали 5 как латеральных ворот субстрата» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (20): 8257–62. DOI : 10.1073 / pnas.0700814104 . PMC 1895938 . PMID 17463085 .
- ^ Ван Y, Maegawa S, Акияма Y, Y Ha (декабрь 2007). «Роль петли L1 в механизме ромбовидной внутримембранной протеазы GlpG» . Журнал молекулярной биологии . 374 (4): 1104–13. DOI : 10.1016 / j.jmb.2007.10.014 . PMC 2128867 . PMID 17976648 .
- ↑ Baker RP, Urban S (сентябрь 2012 г.). «Архитектурные и термодинамические принципы, лежащие в основе функции внутримембранной протеазы» . Природа Химическая биология . 8 (9): 759–68. DOI : 10.1038 / nchembio.1021 . PMC 4028635 . PMID 22797666 .
- ^ a b c Zoll S, Stanchev S, Began J, Skerle J, Lepšík M, Peclinovská L, Majer P, Strisovsky K (октябрь 2014 г.). «Связывание субстрата и специфичность ромбовидной внутримембранной протеазы, выявленная структурами комплекса субстрат-пептид» . Журнал EMBO . 33 (20): 2408–21. DOI : 10.15252 / embj.201489367 . PMC 4253528 . PMID 25216680 .
- Перейти ↑ Freeman M (2014). «Ромбовидное суперсемейство: молекулярные механизмы и биологические роли» . Ежегодный обзор клеточной биологии и биологии развития . 30 : 235–54. DOI : 10,1146 / annurev-cellbio-100913-012944 . PMID 25062361 .
- ↑ Xue Y, Ha Y (июнь 2013 г.). «Большое боковое движение трансмембранной спирали S5 не требуется для доступа субстрата к активному центру ромбовидной внутримембранной протеазы» . Журнал биологической химии . 288 (23): 16645–54. DOI : 10.1074 / jbc.M112.438127 . PMC 3675599 . PMID 23609444 .
- ^ a b c d Стрисовский К., Шарп Х. Дж., Фриман М (декабрь 2009 г.). «Последовательно-специфический внутримембранный протеолиз: идентификация мотива распознавания в ромбовидных субстратах» . Молекулярная клетка . 36 (6): 1048–59. DOI : 10.1016 / j.molcel.2009.11.006 . PMC 2941825 . PMID 20064469 .
- ^ Tsruya R, Wojtalla A, S Carmon, Йогев S, Reich A, Биби E, Merdes G, Schejter E, Шило BZ (март 2007). «Ромбовидный разрез рассекает Стар, чтобы регулировать уровень секретируемого шпица» . Журнал EMBO . 26 (5): 1211–20. DOI : 10.1038 / sj.emboj.7601581 . PMC 1817629 . PMID 17304216 .
- ^ Флейг L, Bergbold N, P Sahasrabudhe, Geiger B, Kaltak L, Лемберг MK (август 2012). «Убиквитин-зависимая внутримембранная ромбовидная протеаза способствует ERAD мембранных белков» . Молекулярная клетка . 47 (4): 558–69. DOI : 10.1016 / j.molcel.2012.06.008 . PMID 22795130 .
- ^ Akiyama Y, Maegawa S (май 2007). «Особенности последовательности субстратов, необходимых для расщепления GlpG, ромбовидной протеазой Escherichia coli». Молекулярная микробиология . 64 (4): 1028–37. DOI : 10.1111 / j.1365-2958.2007.05715.x . PMID 17501925 . S2CID 33930463 .
- ^ Дики SW, Baker RP, Cho S, S Urban (декабрь 2013 года). «Протеолиз внутри мембраны - это реакция с регулируемой скоростью, которая не зависит от сродства к субстрату» . Cell . 155 (6): 1270–81. DOI : 10.1016 / j.cell.2013.10.053 . PMC 3917317 . PMID 24315097 .
- ^ Langosch D, Scharnagl С, Штайнер Н, Лемберг МК (июнь 2015). «Понимание внутримембранного протеолиза: от динамики белка к кинетике реакции». Направления биохимических наук . 40 (6): 318–27. DOI : 10.1016 / j.tibs.2015.04.001 . PMID 25941170 .
- ^ Стрисовский K (апрель 2013). «Структурные и механистические принципы внутримембранного протеолиза - уроки ромбовидной формы». Журнал FEBS . 280 (7): 1579–603. DOI : 10.1111 / febs.12199 . PMID 23432912 . S2CID 6316872 .
- ^ Haft DH, Varghese N (2011). «GlyGly-CTERM и ромбосортаза: сигнал процессинга C-концевого белка в паре« многие к одному »с внутримембранной сериновой протеазой ромбовидного семейства» . PLOS ONE . 6 (12): e28886. Bibcode : 2011PLoSO ... 628886H . DOI : 10.1371 / journal.pone.0028886 . PMC 3237569 . PMID 22194940 .
- ^ < Freeman M (2008). «Ромбовидные протеазы и их биологические функции». Ежегодный обзор генетики . 42 : 191–210. DOI : 10.1146 / annurev.genet.42.110807.091628 . PMID 18605900 .
- ^ Pierrat О.А., Strisovsky К, Christova Y, Большой J, Ansell К, Bouloc Н, Smiljanic Е, М Freeman (апрель 2011). «Моноциклические β-лактамы являются селективными механическими ингибиторами ромбовидных внутримембранных протеаз» . ACS Химическая биология . 6 (4): 325–35. DOI : 10.1021 / cb100314y . PMC 3077804 . PMID 21175222 .
- Перейти ↑ Lemberg MK, Freeman M (ноябрь 2007 г.). «Функциональные и эволюционные последствия расширенного геномного анализа ромбовидных внутримембранных протеаз» . Геномные исследования . 17 (11): 1634–46. DOI : 10.1101 / gr.6425307 . PMC 2045146 . PMID 17938163 .
- ^ a b Зеттл М., Адрейн С., Стрисовский К., Ластун В., Фриман М. (апрель 2011 г.). «Псевдопротеазы семейства ромбовидных используют механизм контроля качества ER для регулирования межклеточной передачи сигналов» . Cell . 145 (1): 79–91. DOI : 10.1016 / j.cell.2011.02.047 . PMC 3149277 . PMID 21439629 .
- ^ Adrain С, Зеттл М, Christova Y, Тейлор Н, М Freeman (январь 2012). «Передача сигналов фактора некроза опухоли требует, чтобы iRhom2 способствовал передаче и активации TACE» . Наука . 335 (6065): 225–8. Bibcode : 2012Sci ... 335..225A . DOI : 10.1126 / science.1214400 . PMC 3272371 . PMID 22246777 .
- ^ McIlwain DR, Lang PA, Maretzky T, Hamada K, Ohishi K, Maney SK, Berger T, Murthy A, Duncan G, Xu HC, Lang KS, Häussinger D, Wakeham A, Itie-Youten A, Khokha R, Ohashi PS , Блобель С.П., Мак Т.В. (январь 2012 г.). «iRhom2 регуляция TACE контролирует TNF-опосредованную защиту против Listeria и ответы на LPS» . Наука . 335 (6065): 229–32. Bibcode : 2012Sci ... 335..229M . DOI : 10.1126 / science.1214448 . PMC 4250273 . PMID 22246778 .
- ^ Christova Y, Adrain С, Р Бамбругх Ибрагим А, М Freeman (октябрь 2013 г. ). «IRhoms млекопитающих выполняют различные физиологические функции, включая важную роль в регуляции ТАСЕ» . EMBO Reports . 14 (10): 884–90. DOI : 10.1038 / embor.2013.128 . PMC 3807218 . PMID 23969955 .
- ^ Li X, Maretzky T, Weskamp G, Monette S, Цин X, Issuree PD, Crawford HC, McIlwain DR, Mak TW, Salmon JE, Блобель CP (май 2015). «iRhoms 1 и 2 являются важными вышестоящими регуляторами ADAM17-зависимой передачи сигналов EGFR» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (19): 6080–5. Bibcode : 2015PNAS..112.6080L . DOI : 10.1073 / pnas.1505649112 . PMC 4434755 . PMID 25918388 .
- ^ «Клан: ромбовидный (CL0207)» . Pfam .
Внешние ссылки [ править ]
- http://merops.sanger.ac.uk/cgi-bin/famsum?family=S54
- http://expasy.org/enzyme/3.4.21.105