 | |
| Имена | |
|---|---|
| Название ИЮПАК Оксалат натрия и железа (III) | |
| Другие названия Ферриоксалат натрия Оксалат натрия, железа и | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.008.267 |
| Номер ЕС |
|
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 6 Fe Na 3 O 12 | |
| Молярная масса | 388,868 г · моль -1 |
| Плотность | 1,97 г / см 3 при 17 ° C |
| 32,5 пункта на 100 пунктов растворителя, холодная вода, 182 пункта на 100 пунктов, кипящая вода [1] | |
| Состав | |
| восьмигранный | |
| 0 Д | |
| Опасности | |
| Основные опасности | Едкий. Раздражает глаза, органы дыхания и кожу. |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H302 , H312 | |
| P264 , P270 , P280 , P301 + 312 , P302 + 352 , P312 , P322 , P330 , P363 , P501 | |
| Родственные соединения | |
Другие анионы | Ферриоксалат калия |
Родственные соединения | Оксалат железа (II) Оксалат железа (III) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
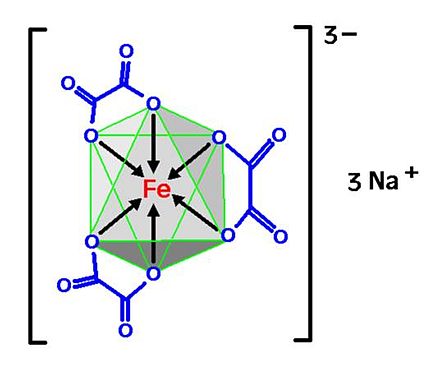
Ферриоксалат натрия - это химическое соединение с формулой Na
3Fe (C
2О
4)
3. Его также называют оксалатоферратом натрия или трисоксалатоферратом натрия .
Соединение представляет собой соль, состоящую из анионов ферриоксалата , [Fe (C
2О
4)
3] 3– и катионы натрия Na + . Анион представляет собой комплекс переходного металла, состоящий из атома железа в степени окисления +3 и трех бидентатных оксалат- ионов C
2О2-
4анионы, действующие как лиганды .
Анион ферриоксалата чувствителен к свету и электромагнитному излучению более высокой энергии , которое вызывает разложение одного оксалата до диоксида углерода CO.
2 и восстановление атома железа (III) до железа (II).
Свойства [ править ]
Растворимость [ править ]
Это соединение хорошо растворимо в горячей воде (182 части на 100 частей растворителя по массе), но гораздо менее растворимо в холодной воде (32 части на 100 частей растворителя) относительно растворимости хлорида натрия. Он плохо растворяется в этаноле или смесях этанола с водой, которые содержат более 50% этанола по массе. Он несколько лучше растворяется в воде, чем соответствующая калиевая соль . [ необходима цитата ]
Подготовка [ править ]
Ferrioxalate натрия может быть получен путем смешивания растворов оксалата натрия и железа оксалата , и ждать несколько часов для коричневого цвета трехвалентного оксалата быть заменен зеленым цветом комплексного аниона.
- 3 Na
2C
2О
4+ Fe
2(C
2О
4)
3 → 2 Na
3[Fe (C
2О
4)
3]
Равновесие достигается медленно при комнатной температуре. Затем продукт можно кристаллизовать путем выпаривания раствора при температуре чуть ниже кипения до появления мелких кристаллов, а затем дать ему остыть. Продукт также можно осаждать, добавляя к раствору метанол или этанол .
Во время процесса может происходить некоторое разложение оксалата железа (III) , в результате чего образуется нерастворимый оксалат железа (II) канареечно-желтого цвета . Небольшие количества перекиси водорода H
2О
2 может быть добавлен, чтобы поддерживать железо в степени окисления 3+.
См. Также [ править ]
Известен ряд других оксалатов железа.
- Оксалат железа (II)
- Оксалат железа (III)
- Ферриоксалат калия
Ссылки [ править ]
- ^ Weast, Роберт С., изд. (1981). CRC Справочник по химии и физике (62-е изд.). Бока-Ратон, Флорида: CRC Press. п. Б-149. ISBN 0-8493-0462-8.