| Имена | |||
|---|---|---|---|
| Имена ИЮПАК Хлорид ванадия (III) Трихлорид ванадия | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.859 | ||
PubChem CID | |||
| Номер RTECS |
| ||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| VCl 3 | |||
| Молярная масса | 157,30 г / моль | ||
| Внешность | фиолетовые кристаллы парамагнитные | ||
| Плотность | 3,0 г / см 3 (20 ° С) | ||
| Температура плавления | > 300 ° C (572 ° F, 573 K) (разлагается) | ||
| растворимый | |||
| + 3030,0 · 10 −6 см 3 / моль | |||
| Структура | |||
| Тригональный , ч 24 | |||
| Р-3, №148 | |||
| Опасности | |||
| Паспорт безопасности | Хлорид ванадия (III) | ||
| Пиктограммы GHS |   [1] [1] | ||
| Сигнальное слово GHS | Опасность [1] | ||
| H302 , H314 [1] | |||
| P280 , P305 , P351 , P338 , P310 [1] | |||
| точка возгорания | Негорючий | ||
| Родственные соединения | |||
Другие анионы | ванадия трифторид , ванадий (III) сульфид , ванадий трибромид | ||
Другие катионы | трихлорид титана , хром (III) хлорид , ниобий трихлорид , тантал трихлорид | ||
Родственные соединения | ванадия дихлорид , ванадий тетрахлорид | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Трихлорид ванадия представляет собой неорганическое соединение с формулой VCl 3 . Эта пурпурная соль является обычным предшественником других комплексов ванадия (III). [2]
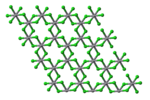
Структура [ править ]
VCl 3 имеет общую структуру BiI 3 , мотив, который имеет гексагонально плотноупакованный хлоридный каркас с ионами ванадия, занимающими октаэдрические отверстия. VBr 3 и VI 3 имеют одинаковую структуру, но VF 3 имеет структуру, более близкую к ReO 3 . VCl 3 является парамагнитной и имеет два неспаренных электронов.
Подготовка и реакции [ править ]
VCl 3 получают нагреванием VCl 4 при 160–170 ° C в потоке инертного газа, который вымывает Cl 2 . Ярко-красная жидкость превращается в пурпурное твердое вещество.
При нагревании VCl 3 разлагается с улетучиванием VCl 4 , оставляя VCl 2 . [3] При нагревании в атмосфере H 2 при 675 ° C (но менее 700 ° C) VCl 3 восстанавливается до зеленоватого цвета VCl 2 .
- 2 VCl 3 + H 2 → 2 VCl 2 + 2 HCl
Компропорционирование трихлорида ванадия и оксидов ванадия (V) дает оксидихлорид ванадия : [4]
- V 2 O 5 + VOCl 3 + 3 VCl 3 → 6 VOCl 2
Трихлорид ванадия катализирует реакцию пинакольного сочетания бензальдегида (PhCHO) с 1,2-дифенил-1,2-этандиолом с помощью различных металлов-восстановителей, таких как цинк: [5]
- Zn + 2 H 2 O + 2 PhCHO → (PhCH (OH)) 2 + Zn (OH) 2
Комплексы [ править ]
VCl 3 образует красочные аддукты и производные с широким спектром лигандов. VCl 3 растворяется в воде с образованием гексагидрата , но формула обманчива. Соль описывается формулой [VCl 2 (H 2 O) 4 ] Cl . 2H 2 O. Другими словами, две молекулы воды не связаны с ванадием, структура которого напоминает соответствующее производное Fe (III). Удаление двух связанных хлоридных лигандов из [VCl 2 (H 2 O) 4 ] + в водном растворе дает зеленый ион [V (H 2 O) 6 ] 3+.. [6]
С тетрагидрофураном VCl 3 образует красный / розовый аддукт VCl 3 (THF) 3 . [8] Хлорид ванадия (III) реагирует с ацетонитрилом с образованием зеленого аддукта VCl 3 (MeCN) 3 . При обработке KCN VCl 3 превращается в [V (CN) 7 ] 4– (ранние металлы обычно имеют координационные числа больше 6 с компактными лигандами). Кроме того, более крупные металлы могут образовывать комплексы с довольно объемными лигандами. Этот аспект иллюстрируется выделением VCl 3 (NMe 3 ) 2 , содержащего два объемных NMe 3 лиганды.
Металлоорганические производные [ править ]
Реактивная форма V ( мезитил ) 3 образуется из VCl 3 . [9]
- VCl 3 (THF) 3 + 3 LiC 6 H 2 -2,4,6-Me 3 → V (C 6 H 2 -2,4,6-Me 3 ) 3 (THF) + 3 LiCl
Этот вид связывает CO и, при соответствующих условиях, N 2 .
Ссылки [ править ]
- ^ a b c d "ДСН хлорида ванадия (III)" . Американские элементы . Проверено 17 августа 2018 .
- ^ Holleman, AF; Виберг, E.Академическая пресса неорганической химии : Сан-Диего, 2001. ISBN 0-12-352651-5 .
- ^ Янг, RC; Смит, М. Е. Неорганические синтезы "хлорид ванадия (III)",том IV, стр. 128–130, 1953. doi : 10.1002 / 9780470132357.ch43
- ^ Г. Брауэр (1963). «Оксидихлорид ванадия». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Нью-Йорк: Academic Press. п. 1263.
- ^ Катализированная ванадием реакция связывания пинакола в воде Xiaoliang Xu и Toshikazu Hirao J. Org. Chem. ; 2005 ; 70 (21) pp 8594–96. DOI : 10.1021 / jo051213f
- ^ Донован, Уильям Ф .; Смит, Питер В. (1975). "Кристаллическая и молекулярная структура комплексов аквагалогенованадия (III). Часть I. Рентгеновская кристаллическая структура дигидрата транс- тетракисквадибром-ванадия (III) бромида и изоморфного хлорсодержащего соединения". Журнал химического общества, Dalton Сделки (10): 894. DOI : 10.1039 / DT9750000894 .
- ^ FACotton, SADuraj, GLPowell, WJRoth (1986). "Сравнительные структурные исследования сольватов тетрагидрофурана хлорида первого ряда раннего переходного металла (III)". Неорг. Чим. Acta . 113 : 81. DOI : 10.1016 / S0020-1693 (00) 86863-2 .CS1 maint: использует параметр авторов ( ссылка )
- ^ Manzer, LE (1982). Тетрагидрофурановые комплексы избранных металлов с ранним переходом . Неорганические синтезы. 21 . С. 135–140. DOI : 10.1002 / 9780470132524.ch31 .
- ^ Виванко, М .; Ruiz, J .; Floriani, C .; Кьези-Вилла, А .; Риццоли, К. «Химия сигма-связи ванадий-углерод. 1. Введение монооксида углерода, изоцианидов, диоксида углерода и гетерокумуленов в связь VC трис (мезитил) ванадия (III)» Organometallics 1993, том 12, 1794 –1801. DOI : 10.1021 / om00029a042