В медицине венепункция или венепункция - это процесс получения внутривенного доступа с целью забора венозной крови (также называемого флеботомией ) или внутривенной терапии . В сфере здравоохранения, эта процедура осуществляется медицинскими лабораторными учеными , врачами , некоторые ЕМТ , фельдшеров , Phlebotomists , диализных техников и других медицинского персонала. [1] В ветеринарии эту процедуру проводят ветеринары и ветеринарные техники..
Для получения точных лабораторных результатов важно следовать стандартной процедуре взятия образцов крови. Любая ошибка при сборе крови или наполнении пробирок может привести к ошибочным результатам лабораторных исследований. [2]
Венепункция является одной из наиболее часто выполняемых инвазивных процедур и проводится по любой из пяти причин:
- для получения крови для диагностических целей;
- контролировать уровни компонентов крови; [3]
- для назначения терапевтического лечения, включая лекарства, питание или химиотерапию;
- для удаления крови из-за повышенного уровня железа или эритроцитов ( красных кровяных телец ); или же
- для сбора крови для последующего использования, главным образом , переливания либо у донора или в другом человеке .
Анализ крови - важный диагностический инструмент, доступный врачам в сфере здравоохранения.
Кровь чаще всего получают из поверхностных вен верхней конечности. [1] медианная локтевая вена , которая находится в пределах локтевой ямки переднего до локтя, находится близко к поверхности кожи без многих больших нервов расположена поблизости. Другие вены, которые можно использовать в локтевой ямке для венепункции, включают головную , базиликовую и срединную передние вены . [4]
Небольшие количества крови могут быть взяты из пальца и взяты у младенцев с помощью укола пятки или из вен черепа с помощью крылатой иглы для инфузии .
Флеботомия (надрез вены) также является лечением некоторых заболеваний, таких как гемохроматоз, первичная и вторичная полицитемия .
Осложнения [ править ]
Исследование доноров крови 1996 года (при сдаче крови используется более крупная игла, чем при рутинной венепункции) обнаружило, что 1 из 6300 доноров получил повреждение нерва. [5]
Оборудование [ править ]
Существует много способов забора крови из вены, и используемый метод зависит от возраста человека, доступного оборудования и типа необходимых анализов.
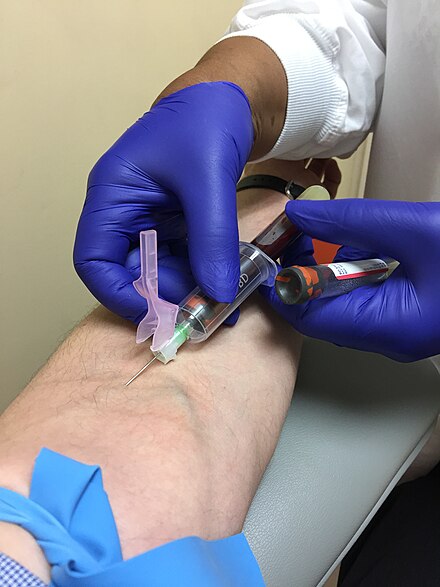
Большая часть забора крови в США, Великобритании, Канаде и Гонконге осуществляется с помощью системы эвакуированных пробирок (две распространенные системы - Vacutainer (Becton, Dickinson и компания)) и Vacuette (Greiner Bio-One). Оборудование состоит из пластикового адаптера , также известный как трубка или иглодержатель / втулка, игла для подкожных инъекций и вакуумная трубка. При определенных обстоятельствах можно использовать шприц, часто с иглой-бабочкой , которая представляет собой пластиковый катетер, прикрепленный к короткой игле. Во всем мире система откачанных трубок является предпочтительным методом забора крови
С откачанными или вакуумными трубками [ править ]
Greiner Bio-One произвела первую в истории пластиковую вакуумную пробирку для забора крови в 1985 году под торговой маркой VACUETTE. Сегодня многие компании продают электронные лампы, поскольку патент на это устройство теперь является общественным достоянием. Эти трубки изготавливаются с определенным объемом газа, удаляемым из герметичной трубки. Когда в пробку вставляется игла из втулки или передаточного устройства, вакуум трубки автоматически втягивает необходимый объем крови.
Базовая система вакуумных трубок (ETS) состоит из иглы, держателя трубок и вакуумированных трубок. Игла прикрепляется к держателю трубки флеботомистом перед забором или может поступать от производителя как единое целое. Игла проходит через конец держателя трубки и имеет иглу на каждом конце. После первой очистки места венепункции и наложения жгута флеботомист снимает колпачок с иглы, прикрепленной к держателю трубки, вводит иглу в вену, затем вставляет эвакуированные трубки в держатель трубки, где пробка трубки протыкается задним концом трубки. иголка. Затем вакуум в трубке автоматически забирает необходимую кровь прямо из вены. К одной игле можно присоединять и снимать несколько вакуумных трубок по очереди, что позволяет получить несколько образцов за одну процедуру.Это возможно благодаря многогранной втулке для образцов, которая представляет собой гибкую резиновую накладку на задний конец иглы.канюля, которая закрывает иглу до тех пор, пока она не будет вытолкнута из пути. Это препятствует свободному стеканию крови из задней части иглы, вставленной в вену, поскольку каждая пробирка удаляется, а следующая прокалывается. Правила безопасности OSHA требуют, чтобы иглы или держатели для трубок были оснащены предохранительным устройством, закрывающим иглу после процедуры, чтобы предотвратить случайное повреждение иглой. [6]
Также доступны фитинги и переходники, используемые для заполнения вакуумированных трубок из наборов игл-бабочек и шприцев.
Флеботомист может выбрать из нескольких игл. Наиболее часто используются следующие: игла 21 г (зеленый верх), игла 22 г (черный верх), игла-бабочка 21 г (зеленая этикетка), игла-бабочка 23 г (голубая этикетка) и игла-бабочка 25 г (оранжевая или темная). синяя этикетка) игла-бабочка (однако эта игла используется только в педиатрии или в крайних случаях, поскольку она настолько мала, что часто может привести к гемолизу образца крови). Существуют также пробирки и бутылки различных размеров и объемов для различных требований к испытаниям. [7]
Добавки и порядок розыгрыша [ править ]
Пробирки, в которые собирается кровь, могут содержать одну или несколько из нескольких добавок. Как правило, тесты, требующие цельной крови, требуют отбора образцов крови в пробирки, содержащие антикоагулянт ЭДТА в той или иной форме . ЭДТА хелатирует кальций для предотвращения свертывания крови. ЭДТА предпочтительнее для гематологических тестов, потому что она наносит минимальный ущерб морфологии клеток. Цитрат натрия - это антикоагулянт, используемый в образцах, собранных для тестов на коагуляцию. Большинство химических и иммунологических тестов проводится на сыворотке, которая образуется путем свертывания и последующего отделения образца крови на центрифуге. Эти образцы собирают либо в пробирку без добавок, либо в пробирку, содержащую активатор свертывания . Этот активатор свертывания крови может мешать проведению некоторых анализов., поэтому в этих случаях рекомендуется использовать простую трубку, но это задержит тестирование. Пробирки, содержащие гепарин лития или гепарин натрия, также обычно используются для различных химических тестов, поскольку они не требуют свертывания крови и могут быть центрифугированы сразу после сбора. Комбинация фторида натрия и оксалата калия используется для тестов на глюкозу, так как эти добавки предотвращают свертывание крови и останавливают гликолоз, так что уровень глюкозы в крови сохраняется после сбора. [8] Другая специальная пробирка - непрозрачная пробирка янтарного цвета, используемая для сбора крови на светочувствительные аналиты, такие как билирубин.
Пробирки помечены добавкой, которую они содержат, но пробки на каждой пробирке также имеют цветовую маркировку в соответствии с добавкой. Хотя цвета у разных производителей различаются, цвета пробок обычно связаны с каждой добавкой, как указано ниже. Поскольку добавки из каждой пробирки можно оставлять на игле, используемой для заполнения пробирок, их нужно набирать в определенном порядке, чтобы гарантировать, что перекрестное загрязнение не повлияет отрицательно на тестирование образцов, если необходимо взять несколько пробирок одновременно. «Порядок розыгрыша» зависит от метода сбора. Ниже в порядке извлечения, который обычно требуется для метода сбора с помощью системы вакуумных трубок (ETS), приведены наиболее распространенные пробирки с указанием добавок и цветов: [9] [10]
| Цвет или тип крышки пробирки | Добавка | Использование и комментарии |
|---|---|---|
| Бутылка для посева крови | Полианетолсульфонат натрия ( антикоагулянт ) и питательная среда для микроорганизмов | Обычно рисуется в первую очередь для минимального риска загрязнения. [11] Обычно за один забор крови собирают две бутылки; один для аэробных организмов и один для анаэробных организмов . [12] |
| Светло-синий | Цитрат натрия (антикоагулянт) | Тесты на коагуляцию, такие как протромбиновое время (PT), частичное тромбопластиновое время (PTT) и тромбиновое время (TT). Трубка должна быть заполнена на 100%. |
| Простой красный | Без добавки | Сыворотка : общая активность комплемента , криоглобулины. |
| Золото | Активатор свертывания и гель для отделения сыворотки [13] | Пробирка для отделения сыворотки : переворачивание пробирки способствует свертыванию. Большинство биохимических, эндокринных и серологических тестов, включая гепатит и ВИЧ . |
| Темно-зеленый | Натрий гепарин (антикоагулянт) | Хромосомное тестирование, аммиак , лактат , HLA- типирование |
| мятно-зеленый | Литий гепарин (антикоагулянт) | Плазма . Переворачивание трубок предотвращает свертывание |
| Лаванда («пурпурный») | ЭДТА ( хелатор / антикоагулянт) | Цельная кровь : общий анализ крови , СОЭ , уровни такролимуса и циклоспорина в крови, антитела к тромбоцитам, тест Кумбса , проточная цитометрия. |
| Розовый | ЭДТА (хелатор / антикоагулянт) | Определение группы крови и перекрестное сопоставление , прямой тест Кумбса ,вирусная нагрузка ВИЧ |
| Королевский синий | ЭДТА (хелатор / антикоагулянт) | Микроэлементы, тяжелые металлы, уровень большинства наркотиков, токсикология |
| Загар | ЭДТА (хелатор / антикоагулянт) | Вести |
| серый |
| Глюкоза , лактат [14] |
| Желтый | Кислота-цитрат-декстроза А (антикоагулянт) | Типирование тканей , исследования ДНК, культуры ВИЧ |
| Жемчужно-белый") | Разделение геля и (K 2 ) EDTA | ПЦР на аденовирус , токсоплазму и HHV-6 |
У детей [ править ]
Использование лидокаина с ионтофорезом эффективно для уменьшения боли и облегчения стресса во время венепункции у детей. [15] Было показано, что безыгольная система доставки порошка лигнокаина уменьшает боль при венепункции у детей. [16] [17]Быстрая кожная анестезия может быть достигнута путем инфильтрации местного анестетика, но она может вызвать беспокойство у детей, напуганных иглами, или деформировать кожу, затрудняя доступ к сосудам и увеличивая риск контакта игл с медицинскими работниками. Кожная анестезия также может быть достигнута без игл путем местного применения местных анестетиков или ионтофореза лидокаина. Напротив, неинвазивная дермальная анестезия может быть установлена за 5-15 минут без искажения подлежащих тканей с помощью лидокаин-ионтофореза, когда постоянный электрический ток способствует проникновению через кожу положительно заряженных молекул лидокаина при помещении под положительным электродом.
Одно исследование пришло к выводу, что ионтофоретическое введение лидокаина было безопасным и эффективным для обеспечения кожной анестезии при венепункции у детей 6-17 лет. Этот метод применим не ко всем детям. Будущие исследования могут предоставить информацию о минимальной эффективной дозе ионтофоретика для кожной анестезии у детей и сравнение анестезирующей эффективности и удовлетворенности лидокаином ионтофореза с местными анестезирующими кремами и подкожной инфильтрацией. [15]
Немедикаментозные методы лечения боли, связанной с венепункцией у детей, включают гипноз и отвлечение внимания. Эти методы лечения уменьшали боль, о которой сообщал сам человек, а в сочетании с когнитивно-поведенческой терапией (КПТ) уменьшение боли было еще большим. Другие вмешательства оказались неэффективными, и это внушение, выдувание воздуха и отвлечение внимания с помощью наставничества родителей не отличалось от контроля боли и дистресса. [18]
С иглой и шприцем [ править ]
Некоторые медицинские работники предпочитают использовать шприц- иглу для венепункции. Компания Sarstedt производит систему взятия крови (S-Monovette), в которой используется этот принцип. [19]Этот метод может быть предпочтительным для пожилых людей, людей с онкологическими заболеваниями, тяжелыми ожогами, ожирением или с ненадежными или хрупкими венами. Поскольку шприцы управляются вручную, степень всасывания можно легко контролировать. Это особенно полезно, когда вены маленькие, которые могут разрушиться при отсасывании откачанной трубки. У детей или при других обстоятельствах, когда количество взятой крови может быть ограничено, может быть полезно знать, сколько крови можно получить, прежде чем распределять ее среди различных добавок, которые потребуются лаборатории. Другой альтернативой является забор крови через постоянные канюли. [20]
Посев крови [ править ]
Бывают случаи, когда требуется забор крови. Посев определит, есть ли в крови патогены. Обычно кровь стерильна. При заборе крови из посевов используйте стерильный раствор, такой как бетадин, а не спирт . Это делается в стерильных перчатках, не вытирая хирургический раствор, не касаясь места прокола и не нарушая стерильный процесс. Жизненно важно, чтобы процедура выполнялась как можно более стерильно, поскольку постоянное присутствие кожных комменсалов в культурах крови может указывать на эндокардит.но чаще всего они обнаруживаются как загрязнители. Рекомендуется использовать абразивный метод подготовки кожи. Это удаляет верхние слои омертвевших клеток кожи вместе с заражающими их бактериями. [21] Повидон-йод традиционно использовался, но в Великобритании 2% хлоргексидин в 70% растворе этанола или изопропилового спирта предпочтительнее, и нужно дать ему время высохнуть. Крышки любых емкостей, используемых при взятии посевов крови, также следует продезинфицировать аналогичным раствором. Некоторые лаборатории будут активно препятствовать использованию йода там, где считается, что йод разрушает резиновую пробку, через которую кровь попадает в бутылку, позволяя загрязнениям попадать в контейнер.
Кровь собирается в специальные транспортные бутыли, которые похожи на вакуумные трубки, но имеют другую форму. Флакон для гемокультуры содержит транспортную среду для сохранения любых присутствующих микроорганизмов во время их транспортировки в лабораторию для посева. Поскольку неизвестно, являются ли патогены анаэробными (живущими без кислорода) или аэробными (живущими с кислородом), кровь собирается для проверки обоих. Сначала наполняется аэробный баллон, а затем анаэробный баллон. Однако, если сбор проводится с помощью шприца, сначала заполняется анаэробная бутылка. Если используется набор для сбора бабочек, сначала заполняется аэробный баллон, чтобы весь воздух из трубки попал в кислородсодержащий баллон.
Специально разработанные флаконы для забора культур крови исключают необходимость использования шприца или метода забора бабочки. Эти специально разработанные флаконы имеют длинные горлышки, которые подходят для держателей вакуумированных пробирок, используемых для регулярного взятия венепункций. Эти бутыли также позволяют собирать другие образцы крови через откачанные пробирки без дополнительной венепункции.
Количество собираемой крови имеет решающее значение для оптимального восстановления микроорганизмов. Типично до 10 мл крови, но может варьироваться в зависимости от рекомендаций производителя емкости для забора крови. Сбор от младенцев и детей от 1 до 5 мл. Если будет собрано слишком мало крови, соотношение крови и питательного бульона будет препятствовать росту микроорганизмов. Если будет собрано слишком много крови, существует риск развития анемии, вызванной больницей, и соотношение крови и питательных веществ изменится в противоположном направлении, что также не способствует оптимальному росту.
Затем флаконы инкубируют в специализированных отделениях в течение 24 часов, прежде чем лаборант изучит и / или протестирует их. Этот шаг позволяет очень небольшому количеству бактерий (потенциально 1 или 2 организма) размножаться до уровня, достаточного для идентификации +/- тестирования устойчивости к антибиотикам. Современные флаконы для посева крови имеют индикатор в основании, который меняет цвет при наличии роста бактерий и может автоматически считываться машиной. (По этой причине наклейки со штрих-кодом, найденные на этих бутылках, не следует удалять, поскольку они используются автоматизированными системами лаборатории.)
Взятие образцов крови у животных [ править ]
Образцы крови живых лабораторных животных могут быть собраны с использованием следующих методов: [22] [23]
- Сбор крови без анестезии:
- Подкожная вена (крыса, мыши, морская свинка)
- Дорсальная педальная вена (крыса, мыши)
- Сбор крови, требующий анестезии (местная / общая анестезия):
- Хвостовая вена (крыса, мыши)
- Хвост (мыши)
- Глазничный синус (крысы, мыши) [24]
- Яремная вена (крыса, мыши)
- Временная канюля (крыса, мыши)
- Канюляция кровеносных сосудов (морская свинка, хорек)
- Вена предплюсны (морская свинка)
- Краевая ушная вена или артерия (кролик)
- Терминальная процедура:
- Пункция сердца (крыса, мыши, морская свинка, кролик, хорек)
- Орбитальный синус (крысы, мыши)
- Задняя полая вена (крысы, мыши)
У экспериментальных животных очень важен объем забора крови. Весь нетерминальный забор крови без замены жидкости ограничивается до 10% от общего объема циркулирующей крови у здоровых, нормальных взрослых животных за один раз, и сбор может быть повторен через три-четыре недели. Если через короткие промежутки времени требуются повторные пробы крови, каждые 24 часа можно брать максимум 0,6 мл / кг / день или 1,0% от общего объема крови животного. Расчетный объем крови у взрослых животных составляет от 55 до 70 мл / кг массы тела. Следует проявлять осторожность с животными старшего возраста и с ожирением. Если объем сбора крови превышает более 10% от общего объема крови, может потребоваться восполнение жидкости. Раствор Рингера с лактатом (LRS) рекомендован Национальными институтами здравоохранения (NIH) как лучший заменитель жидкости.Если объем забираемой крови превышает более 30% от общего объема циркулирующей крови, следует принять соответствующие меры, чтобы животное не страдало гиповолемией.[23]
Тесты на алкоголь в крови [ править ]
Обычно не рекомендуется использовать изопропиловый спирт для очистки места венепункции при получении образца для анализа крови на алкоголь . Это было связано в основном с потенциальными правовыми последствиями, связанными с использованием чистящих средств на спиртовой основе, которые теоретически могут повлиять на анализ. Было продано множество полицейских наборов для сбора алкоголя, которые включают консервант фторид натрия / оксалат калия и очищающие средства на безалкогольной основе для обеспечения надлежащего сбора. В этом случае рекомендуется использовать горячую воду с мылом или тампон с повидон-йодом, как альтернативу изопропиловому спирту.
См. Также [ править ]
- Артериальная кровь берется из артерии, а не из вены.
Ссылки [ править ]
- ^ a b Хиггинс, Дэн (28 сентября 2004 г.). «Венепункция» . Время ухода . 100 (39): 30–1. PMID 15500234 .
- ^ Дг, Дайял. «ПОРЯДОК ЗАБОРА КРОВИ ДЛЯ ГЕМОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ» . BioScience Пакистан . BioScience Пакистан. ISSN 2521-5760 .
- ^ Лавери, я; Инграм, П. (август 2005 г.). «Венепунктура: лучшие практики». Стенд Нурс . 19 (49): 55–65. DOI : 10.7748 / ns2005.08.19.49.55.c3936 . PMID 16134421 .
- ^ Ялонго, Криштиану; Бернардини, Серджио (15.02.2016). «Флеботомия, мост между лабораторией и пациентом» . Biochemia Medica . 26 (1): 17–33. DOI : 10,11613 / BM.2016.002 . ISSN 1330-0962 . PMC 4783087 . PMID 26981016 .
- ^ « « Небольшое укус »может стать изнурительной травмой» . Проверено 25 марта 2020 года .
- ^ Макколл, Рут (2020). Основы флеботомии (7-е изд.). Wolters Kluwer. п. 193. ISBN. 9781496387073.
- ^ Перри, Салли (2007). «Спросите лабораторию: гемолизируйте образцы крови» . Nursing.advanceweb.com . Проверено 29 декабря 2013 .
- ^ a b Кастеллини М.А., Кастеллини Дж. М., Кирби В. Л. (1992). «Влияние стандартных антикоагулянтов и процедур хранения на уровень глюкозы в плазме тюленей» . J Am Vet Med Assoc . 201 (1): 145–8. PMID 1644639 .
- ^ «Сборник» . www.osfhealthcare.org . Проверено 8 декабря 2019 .
- ^ Кристофер Паркер (2019-01-31). «Услуги по флеботомии» . Школа медицины Университета Северной Каролины .
- ^ Пагана, KD; Pagana, TJ; Пагана, Теннесси (19 сентября 2014 г.). Справочник Мосби по диагностике и лабораторным испытаниям - электронная книга . Elsevier Health Sciences. п. xiii. ISBN 978-0-323-22592-2.
- ^ «Глава 3.4.1: Посев крови; общее обнаружение и интерпретация». Справочник по процедурам клинической микробиологии . Вайли. 6 августа 2020 г. ISBN 978-1-55581-881-4.
- ^ «Требования к образцам / контейнеры» . Патология и лабораторная медицина, Медицинский факультет UCI . Проверено 10 сентября 2020 .
- ^ Амитава Дасгупта; Хорхе Л. Сепульведа (20 июля 2019 г.). Точные результаты в клинической лаборатории: руководство по обнаружению и исправлению ошибок . Elsevier Science. п. 131. ISBN. 978-0-12-813777-2.
- ^ a b Роуз, Джон Б.; Галинкин, Джеффри Л .; Jantzen, Ellen C .; Кьяваччи, Розетта М. (2002). «Исследование ионофореза лидокаина для детской венепункции». Анестезия и анальгезия . 94 (4): 867–71, содержание. DOI : 10.1097 / 00000539-200204000-00017 . PMID 11916787 .
- ^ Лакруа, Элен (октябрь 2008 г.). «Безыгольная система доставки порошка лигнокаина уменьшила боль при венепункции у детей». Доказательная медицина . 11 (4): 106. DOI : 10.1136 / ebn.11.4.106 . PMID 18815318 .
- Перейти ↑ Robertson, J (январь 2006 г.). «Липосомальный лидокаин улучшил показатели успешности внутривенной канюляции у детей». Evid Based Nurs . 9 (1): 10. DOI : 10.1136 / ebn.9.1.10 . PMID 16437788 .
- Перейти ↑ Robertson, J (июль 2007 г.). «Обзор: отвлечение внимания, гипноз и комбинированные когнитивно-поведенческие вмешательства уменьшают боль и стресс, связанные с иглой, у детей и подростков». Evid Based Nurs . 10 (3): 75. DOI : 10.1136 / ebn.10.3.75 . PMID 17596380 .
- ^ "Сбор крови с помощью S-Monovette" (PDF) . Дата обращения 27 мая 2020 .
- ^ Меньший, Finnian D; Лэнхэм, Дэвид А; Дэвис, Дэниел (6 мая 2020 г.). «Кровь, взятая из существующих периферических внутривенных канюль, дает результаты, эквивалентные венепункции: систематический обзор» . JRSM Open . 11 (5). DOI : 10.1177 / 2054270419894817 .
- ^ Гарсия, РА; Spitzer, ED; Бодри, Дж; Бек, С; Diblasi, R; Gilleeny-Blabac, M; Haugaard, C; Heuschneider, S; Кранц, BP; Маклин, К; Моралес, KL; Оуэнс, S; Paciella, ME; Торрегроса, Э (ноябрь 2015 г.). «Обзор многопрофильной группы передовых методов сбора и обработки посевов крови для определения эффективных вмешательств для увеличения урожайности истинно-положительных бактериемий, снижения загрязнения и устранения ложноположительных инфекций, связанных с центральной линией кровотока». Am J Infect Control . 43 (11): 1222–37. DOI : 10.1016 / j.ajic.2015.06.030 . PMID 26298636 .
- Перейти ↑ Hoff, J. (2000). «Методы взятия крови у мышей» (PDF) . Лабораторное животное . 29 (10): 47–53.
- ^ а б Парасураман, S; Равендран, Р. Кесаван, Р. (2010). «Забор крови у мелких лабораторных животных» . Журнал фармакологии и фармакотерапии . 1 (2): 87–93. DOI : 10.4103 / 0976-500X.72350 . PMC 3043327 . PMID 21350616 .
- ^ Парашураман, Субрамани; Жен, Хор Мин; Равендран, Рамасами (22 мая 2015 г.). «Забор ретроорбитальной крови у крыс - видео-статья». Фармакология, токсикология и биомедицинские отчеты . 1 (2): 37–40. DOI : 10,5530 / PTB.1.2.1 .
Внешние ссылки [ править ]
- Детали флеботомии
_using_the_BD_Vacutainer_product..webm/440px--Video_of_venipuncture_(blood_draw_or_collection)_using_the_BD_Vacutainer_product..webm.jpg)