| Имена | |||
|---|---|---|---|
| Название ИЮПАК Хлор перхлорат [1] | |||
| Систематическое название ИЮПАК Хлор перхлорат [1] | |||
| Другие имена Оксид хлора (I, VII) Тетроксид дихлора | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ChemSpider | |||
PubChem CID | |||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| Cl 2 O 4 | |||
| Молярная масса | 134,90 г · моль -1 | ||
| Внешность | Бледно-зеленая жидкость | ||
| Плотность | 1,81 г см −3 | ||
| Температура плавления | -117 ° С (-179 ° F, 156 К) | ||
| Точка кипения | 20 ° С (68 ° F, 293 К) (разлагается) | ||
| Реагирует | |||
| Опасности | |||
| Основные опасности | окислитель | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
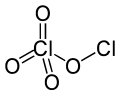
Перхлорат хлора - это химическое соединение с формулой Cl 2 O 4 . Этот оксид хлора представляет собой асимметричный оксид с одним атомом хлора в степени окисления +1, а другой +7, с соответствующей формулой ClOClO 3 . Он производится с помощью фотолиза из диоксида хлора (ClO 2 ) при комнатной температуре при 436 нм ультрафиолетового света : [2] [3] [4]
- 2 ClO 2 → ClOClO 3
Перхлорат хлора также можно получить с помощью следующей реакции при -45 ° C.
- CsClO 4 + ClOSO 2 F → Cs (SO 3 ) F + ClOClO 3
Свойства [ править ]
Перхлорат хлора - бледно-зеленоватая жидкость. Он менее стабилен, чем ClO 2 (диоксид хлора) [ необходима ссылка ], и разлагается при комнатной температуре с образованием O 2 ( кислород ), Cl 2 ( хлор ) и Cl 2 O 6 ( гексоксид дихлора ):
- 2 ClOClO 3 → O 2 + Cl 2 + Cl 2 O 6
Перхлорат хлора реагирует с хлоридами металлов с образованием хлора и соответствующего безводного перхлората:
- CrO 2 Cl 2 + 2 ClOClO 3 → 2 Cl 2 + CrO 2 (ClO 4 ) 2
- TiCl 4 + 4 ClOClO 3 → 4 Cl 2 + Ti (ClO 4 ) 4
- 2 AgCl + 2 ClOClO 3 → 2 AgClO 4 + Cl 2
Реакции [ править ]
| Реагент | Условия | Товары |
|---|---|---|
| - | Высокая температура | гексоксид дихлора (80%), диоксид хлора, хлор, кислород |
| - | Ультрафиолетовый свет | гептоксид дихлора , хлор, кислород [4] |
| йодид цезия | -45 ° С | Cs [I (OClO 3 ) 4 ] [примечание 1] |
| ClOSO 2 F или ClF | - | MClO 4 (M = Cs или NO 2 ) [примечание 2] |
| бром | -45 ° С | перхлорат брома (BrOClO 3 ) [примечание 2] |
| йод (0,33 моль ) | -50 ° С | I (OClO 3 ) 3 [примечание 3] [5] |
Примечания:
- 1. Cs [I (OClO 3 ) 4 ] представляет собой бледно-желтую соль, стабильную при комнатной температуре. Он имеет квадратный блок ввода-вывода 4 .
- 2. MClO 4 (M = Cs или NO 2 ) реагирует с BrOSO 2 F при -20 ° C с образованием перхлората брома (BrOClO 3 ). Затем перхлорат брома реагирует с бромистым водородом (HBr) при -70 ° C с образованием элементарного брома (Br 2 ) и хлорной кислоты (HClO 4 ).
- 3. Пока все попытки образовать перхлорат йода (IOClO 3 ) потерпели неудачу, потому что атом йода немедленно окисляется до степени окисления +3. [ необходима цитата ]
Ссылки [ править ]
- ^ a b «Хлор перхлорат - публичная химическая база данных PubChem» . Проект PubChem . США: Национальный центр биотехнологической информации.
- ^ AJ Schell-Сорокин; DS Bethune; JR Lankard; MMT Loy; Сорокин П.П. (1982). «Перхлорат хлора - основной продукт фотолиза диоксида хлора». J. Phys. Chem . 86 (24): 4653–4655. DOI : 10.1021 / j100221a001 .
- ^ М. И. Лопес; JE Sicre (1988). «Ультрафиолетовый спектр перхлората хлора». J. Phys. Chem . 92 (2): 563–564. DOI : 10.1021 / j100313a062 .
- ^ а б Рао, Баладжи; Андерсон, Тодд А .; Реддер, Аарон; Джексон, У. Эндрю (2010-04-15). «Образование перхлората озонным окислением водных хлорных / оксихлорных разновидностей: роль радикалов ClxOy». Наука об окружающей среде и технологии . 44 (8): 2961–2967. DOI : 10.1021 / es903065f . ISSN 0013-936X . PMID 20345093 .
- ^ Гомберг, М. (1923-02-01). «Реакция между перхлоратом серебра и йодом. Тетраоксид хлора». Журнал Американского химического общества . 45 (2): 398–421. DOI : 10.1021 / ja01655a017 . ISSN 0002-7863 .
| HClO 4 | Он | ||||||||||||||||
| LiClO 4 | Be (ClO 4 ) 2 | B (ClO4)- 4 B (ClO 4 ) 3 | ROClO 3 | N (ClO 4 ) 3 NH 4 ClO 4 NOClO 4 | О | FClO 4 | Ne | ||||||||||
| NaClO 4 | Mg (ClO 4 ) 2 | Al (ClO 4 ) 3 | Si | п | S | ClO- 4 ClOClO 3 Cl 2 O 7 | Ar | ||||||||||
| KClO 4 | Ca (ClO 4 ) 2 | Sc (ClO 4 ) 3 | Ti (ClO 4 ) 4 | VO (ClO 4 ) 3 VO 2 (ClO 4 ) | Cr (ClO 4 ) 3 | Mn (ClO 4 ) 2 | Fe (ClO 4 ) 3 | Co (ClO 4 ) 2 , Co (ClO 4 ) 3 | Ni (ClO 4 ) 2 | Cu (ClO 4 ) 2 | Zn (ClO 4 ) 2 | Ga (ClO 4 ) 3 | Ge | В качестве | Se | Br | Kr |
| RbClO 4 | Sr (ClO 4 ) 2 | Y (ClO 4 ) 3 | Zr (ClO 4 ) 4 | Nb (ClO 4 ) 5 | Пн | Tc | RU | Rh (ClO 4 ) 3 | Pd (ClO 4 ) 2 | AgClO 4 | Cd (ClO 4 ) 2 | В (ClO 4 ) 3 | Sn (ClO 4 ) 4 | Sb | TeO (ClO 4 ) 2 | я | Xe |
| CsClO 4 | Ba (ClO 4 ) 2 | Hf (ClO 4 ) 4 | Та (ClO 4 ) 5 | W | Re | Операционные системы | Ir | Pt | Au | Hg 2 (ClO 4 ) 2 , Hg (ClO 4 ) 2 | Tl (ClO 4 ) , Tl (ClO 4 ) 3 | Pb (ClO 4 ) 2 | Bi (ClO 4 ) 3 | По | В | Rn | |
| FrClO 4 | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла | Ce (ClO 4 ) x | Pr | Nd | Вечера | Sm (ClO 4 ) 3 | Eu (ClO 4 ) 3 | Gd (ClO 4 ) 3 | Tb (ClO 4 ) 3 | Dy (ClO 4 ) 3 | Ho (ClO 4 ) 3 | Er (ClO 4 ) 3 | Tm (ClO 4 ) 3 | Yb (ClO 4 ) 3 | Lu (ClO 4 ) 3 | |||
| Ac | Th (ClO 4 ) 4 | Па | UO 2 (ClO 4 ) 2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||