 | |
| Идентификаторы | |
|---|---|
3D модель ( JSmol ) | |
| ChemSpider | |
| MeSH | гем + C |
PubChem CID | |
| |
| |
| Характеристики | |
| C 34 H 36 O 4 N 4 S 2 Fe | |
| Молярная масса | 684,64904 г / моль |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
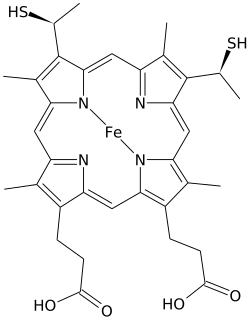
Гем C (или гем C ) - важный вид гема .
История [ править ]
Правильная структура гема C была опубликована в середине 20 века шведским биохимиком К.-Г. Павел. [1] Эта работа подтвердила структуру, впервые предложенную великим шведским биохимиком Хьюго Теоретлом . Структура гема C, основанная на ЯМР- и ИК-экспериментах восстановленной формы гема Fe (II), была подтверждена в 1975 году. [2] Структура гема C, включая абсолютную стереохимическую конфигурацию тиоэфирных связей, была первой. представлен для белка позвоночных, цитохрома c [3], а теперь распространяется на многие другие белки, содержащие гем C.
Свойства [ править ]
Гем C отличается от гема B тем, что две боковые винильные цепи гема B заменены ковалентными тиоэфирными связями с апопротеином . Две тиоэфирные связи обычно образуются остатками цистеина в белке. Эти связи не позволяют гему С легко диссоциировать от голопротеина , цитохрома с , по сравнению с более легко диссоциированным гемом В, который может диссоциировать от холопротеина, комплекса гем-белок, даже в мягких условиях. Это позволяет использовать очень широкий спектр структуры и функций цитохрома c с мириадами цитохромов типа c.выступая в первую очередь как переносчики электронов. Окислительно-восстановительный потенциал цитохрома c также можно «настроить» небольшими изменениями в структуре белка и взаимодействием с растворителем. [4]
Количество единиц гема С, связанных с голопротеином , сильно варьируется. Для клеток позвоночных один гем С на белок является правилом, но для бактерий это количество часто составляет 2, 4, 5, 6 или даже 16 гемовых групп С на голопротеин. Принято считать, что количество и расположение групп гема С связаны и даже необходимы для правильной функции голопротеина. Например, белки, содержащие несколько групп гема C, участвуют во множественных реакциях переноса электронов, особенно важным является восстановление на 6 электронов, необходимое для восстановления атмосферного азота до двух органических молекул аммиака. Для бактериальных гемепротеинов характерно высокое отношение гема С к аминокислоте., поэтому внутренняя часть некоторых белков цитохрома с кажется заполненной многими группами гема С по сравнению с другими гемепротеинами. Некоторые гемопротеины, часто из одноклеточных организмов , могут содержать пять гемов C. [5] Ьс 1 комплекс является еще одним важным ферментом , который содержит тип C гем.
Тиоэфирные связи, по-видимому, предоставляют голопротеинам большую свободу действий. В общем, цитохромы c-типа можно «точно настроить» в более широком диапазоне окислительно-восстановительного потенциала, чем цитохромы b. Это может быть важной причиной того, что цитохром с почти повсеместен на протяжении всей жизни. Гем C также играет важную роль в апоптозе, когда всего несколько молекул цитоплазматического цитохрома c, которые все еще должны содержать гем C, приводят к запрограммированной гибели клеток. [6] Цитохром c можно измерить в сыворотке крови человека и использовать в качестве маркера воспаления. [7]
В дополнение к этим экваториальным ковалентным связям гемовое железо также обычно аксиально скоординировано с боковыми цепями двух аминокислот , что делает гексакоординированное железо. Например, цитохром c млекопитающих и тунца содержит один гем C, который аксиально скоординирован с боковыми цепями как гистидина, так и метионина . [8] Возможно, из-за двух ковалентных связей, удерживающих гем с белком, железо гема C иногда аксиально лигируется с аминогруппой лизина или даже с водой.
Ссылки [ править ]
- ^ Пол, KG; Хёгфельдт, Эрик; Силлен, Ларс Гуннар; Кинелл, Пер-Олоф (1950). «Расщепление солями серебра цистеин-порфириновых связей в цитохроме с» . Acta Chemica Scandinavica . 4 : 239–244. DOI : 10.3891 / acta.chem.scand.04-0239 .
- ^ Caughey, WS; Смайт, Джорджия; О'Киф, DH; Маскаски, JE; Смит, ML (1975). «Гем А цитохром с оксидазы» . Журнал биологической химии . 250 (19): 7602–7622. DOI : 10.1016 / S0021-9258 (19) 40860-0 . PMID 170266 .
- ^ Takano T .; Trus BL; Mandel N .; Mandel G .; Каллай О.Б .; Swanson R .; Дикерсон RE (1977). «Цитохром с тунца с разрешением 2,0 A. II. Анализ структуры ферроцитохрома» . Журнал биологической химии . 252 (2): 776–785. DOI : 10.1016 / S0021-9258 (17) 32784-9 . PMID 188826 .
- ^ Berghuis, AM; Брайер, GD (1992). «Конформационные изменения цитохрома с, зависящие от окислительного состояния». J. Mol. Биол . 223 (4): 959–976. DOI : 10.1016 / 0022-2836 (92) 90255-I . PMID 1311391 .
- ^ Gwyer Джеймс Д. Ричардсон Дэвид Дж, Butt Julea Н. (2005). «Характеристики диода или туннельного диода? Разрешение каталитических последствий протонно-связанного переноса электронов в многоцентровой оксидоредуктазе». Журнал Американского химического общества . 127 (43): 14964–14965. DOI : 10.1021 / ja054160s . PMID 16248601 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Bowman, SEJ, Брен, KL (2008). «Химия и биохимия гема C: функциональные основания для ковалентного связывания» . Nat. Prod. Rep . 25 (6): 1118–1130. DOI : 10.1039 / b717196j . PMC 2654777 . PMID 19030605 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Eleftheriadis, T .; Писсас, G .; Liakopoulos, V .; Стафанидис, И. (2016). «Цитохром c как потенциально клинически полезный маркер митохондриального и клеточного повреждения» . Передний. Иммунол . 7 : 279. DOI : 10.3389 / fimmu.2016.00279 . PMC 4951490 . PMID 27489552 .
- Перейти ↑ Yeh, SR, Han, S., and Rousseau, DL (1998). «Сворачивание и раскладывание цитохрома с». Счета химических исследований . 31 (11): 727–735. DOI : 10.1021 / ar970084p .CS1 maint: несколько имен: список авторов ( ссылка )
См. Также [ править ]
- Гем
- Протопорфирин IX
- Гем А
- Heme B
- Гемепротеин