Человек микробиомом представляет собой совокупность всех микробиоты , которые находятся на или в пределах человеческих тканей и Biofluids вместе с соответствующими анатомических участков , в которых они проживают, [1] в том числе кожи, молочных желез, плаценты, семенной жидкости, матки, яичников фолликулы, легких , слюна, слизистая оболочка полости рта , конъюнктива , желчевыводящие пути и желудочно-кишечный тракт . Типы микробиоты человека включают бактерии , археи , грибы , протисты и вирусы . Хотя микроживотныетакже могут жить на теле человека, они обычно исключаются из этого определения. В контексте геномики термин « микробиом человека» иногда используется для обозначения коллективных геномов резидентных микроорганизмов; [2] однако термин метагеном человека имеет то же значение. [1]
Люди заселяют множество микроорганизмов, причем нечеловеческие клетки примерно того же порядка, что и человеческие клетки. [3] Некоторые микроорганизмы, колонизирующие людей, являются комменсальными , то есть они сосуществуют, не причиняя вреда людям; у других есть взаимные отношения со своими человеческими хозяевами. [2] : 700 [4] И наоборот, некоторые непатогенные микроорганизмы могут нанести вред человеческому хозяину через производимые ими метаболиты , такие как триметиламин , который человеческое тело превращает в N-оксид триметиламина посредством окисления, опосредованного FMO3 . [5] [6]Определенные микроорганизмы выполняют задачи, которые, как известно, могут быть полезны для человека-хозяина, но роль большинства из них до конца не изучена. Те, которые должны присутствовать и которые при нормальных обстоятельствах не вызывают заболевания, иногда считаются нормальной флорой или нормальной микробиотой . [2]
Проект « Микробиом человека» взял на себя проект по секвенированию генома микробиоты человека, уделяя особое внимание микробиоте, которая обычно населяет кожу, рот, нос, пищеварительный тракт и влагалище. [2] Важной вехой стала публикация первых результатов в 2012 году. [7]
Терминология [ править ]
Хотя это название широко известно как « флора» или « микрофлора» , с технической точки зрения это слово является неправильным , поскольку слово «корневая флора» относится к растениям, а « биота» относится к общему собранию организмов в конкретной экосистеме. В последнее время применяется более подходящий термин « микробиота» , хотя его использование не затмило укоренившееся использование и признание флоры в отношении бактерий и других микроорганизмов. Оба термина используются в различной литературе. [4]
Относительные числа [ править ]
Этот раздел требует дополнительных медицинских справок для проверки или слишком сильно полагается на первоисточники . ( февраль 2020 г. ) |
По состоянию на 2014 год в популярных средствах массовой информации и в научной литературе часто сообщалось, что в человеческом теле примерно в 10 раз больше микробных клеток, чем человеческих клеток; эта цифра была основана на оценках того, что микробиом человека включает около 100 триллионов бактериальных клеток и что взрослый человек обычно имеет около 10 триллионов человеческих клеток. [8] В 2014 году Американская академия микробиологии опубликовала FAQ, в котором подчеркивалось, что количество микробных клеток и количество клеток человека являются оценочными, и отмечалось, что недавние исследования привели к новой оценке количества человеческих клеток - приблизительно 37,2 триллиона, что означает, что соотношение микробных клеток к человеческим, если первоначальная оценка в 100 триллионов бактериальных клеток верна, ближе к 3: 1.[8] [9] В 2016 году другая группа опубликовала новую оценку соотношения примерно 1: 1 (1,3: 1, с «неопределенностью 25% и вариацией 53% по популяции стандартных самцов весом 70 кг. "). [10] [3]
Согласно обзорной статье под названием « Текущее понимание микробиома человека » в журнале Nature Medicine от апреля 2018 года:
Хотя часто сообщается, что количество наших микробов превышает количество наших собственных клеток в 10: 1, это число взято из статьи 1972 года, в которой для определения этого соотношения используется «обратный расчет». Более прозаическая цифра была предоставлена Рознером: от 5 до 724 × 10 12 человеческих клеток и от 30 до 400 × 10 12 клеток.бактериальные клетки. Совсем недавно уточненная оценка, основанная на экспериментальном наблюдении и экстраполяции, фактически пришла к соотношению 1,3 бактериальных клеток на каждую клетку человека. Однако эти оценки не принимают во внимание вирусы и фаги, присутствующие в различных средах организма, которые могут равняться оценкам бактерий или, что более вероятно, превосходить их по численности, по крайней мере, на порядок. Хотя эти оценки уменьшают степень, в которой количество микробных клеток превышает количество клеток человека, они не уменьшают оценки, связанные с разнообразием микробной жизни, связанной с человеческим телом. Бактерии и другие микробы, включая археи, грибы и, возможно, вирусы, чрезвычайно разнообразны. Аналогичная приблизительная оценка 1000 видов бактерий в кишечнике с 2000 генами на вид дает оценку в 2000000 генов,В 100 раз больше, чем примерно 20 000 генов человека. Это хорошо согласуется с фактическим размером каталогов микробных генов, полученными MetaHIT и Human Microbiome Project.[11]
Исследование [ править ]
Проблема выяснения микробиома человека заключается, по сути, в идентификации членов микробного сообщества, которое включает бактерии, эукариоты и вирусы. [12] Это делается в основном с использованием исследований на основе ДНК, хотя также проводятся исследования на основе РНК, белков и метаболитов. [12] [13] Исследования микробиома на основе ДНК обычно можно разделить на целевые исследования ампликонов или более поздние метагеномные исследования с применением дробовика . Первый фокусируется на конкретных известных маркерных генах и в первую очередь информативен с таксономической точки зрения, тогда как последний представляет собой полный метагеномный подход, который также можно использовать для изучения функционального потенциала сообщества. [12]Одна из проблем, которая присутствует в исследованиях микробиома человека, но не в других метагеномных исследованиях, заключается в том, чтобы избежать включения ДНК хозяина в исследование. [14]
Помимо простого выяснения состава микробиома человека, один из основных вопросов, связанных с микробиомом человека, заключается в том, существует ли «ядро», то есть существует ли подмножество сообщества, разделяемое большинством людей. [15] [16] Если есть ядро, то можно было бы связать определенные составы сообщества с болезненными состояниями, что является одной из целей проекта « Микробиом человека» . Известно, что микробиом человека (например, микробиота кишечника) сильно варьируется как у одного субъекта, так и у разных людей, что также наблюдается у мышей. [4]
13 июня 2012 года директор Национального института здравоохранения Фрэнсис Коллинз объявил о важной вехе в реализации Проекта микробиома человека (HMP) . [7] Объявление сопровождалось серией скоординированных статей, опубликованных в Nature [17] [18] и нескольких журналах в Public Library of Science.(PLoS) в тот же день. Картируя нормальный микробный состав здоровых людей с помощью методов секвенирования генома, исследователи HMP создали справочную базу данных и границы нормальных микробных вариаций у людей. У 242 здоровых добровольцев из США было собрано более 5000 образцов тканей с 15 (мужчин) до 18 (женщин) участков тела, таких как рот, нос, кожа, нижняя часть кишечника (стул) и влагалище. Вся ДНК, человеческая и микробная, была проанализирована с помощью машин для секвенирования ДНК. Данные микробного генома были извлечены путем идентификации специфической для бактерий рибосомной РНК, 16S рРНК . Исследователи подсчитали, что более 10 000 видов микробов населяют экосистему человека, и идентифицировали от 81 до 99% родов .
Секвенирование дробовика [ править ]
Часто бывает трудно культивировать в лабораторных сообществах бактерий , архей и вирусов , поэтому технологии секвенирования можно использовать и в метагеномике . Действительно, полное знание функций и характеристик конкретных микробных штаммов открывает большие возможности для терапевтических открытий и здоровья человека. [19]
Сбор образцов и извлечение ДНК [ править ]
Главное - собрать количество микробной биомассы, достаточное для выполнения секвенирования и сведения к минимуму загрязнения образца; по этой причине можно использовать методы обогащения. В частности, метод выделения ДНК должен подходить для каждого бактериального штамма , а не иметь геномы тех, которые легко лизировать . Механический лизис обычно предпочтительнее химического лизиса, а измельчение гранул может привести к потере ДНК при приготовлении библиотеки. [19]
Подготовка библиотеки и секвенирование [ править ]
Наиболее часто используемые платформы - это Illumina , Ion Torrent , Oxford Nanopore MinION и Pacific Bioscience Sequel, хотя платформа Illumina считается наиболее привлекательным вариантом из-за ее широкой доступности, высокой производительности и точности. Нет никаких указаний относительно правильного количества пробы для использования. [19]
Сборка метагенома [ править ]
Используется подход de novo ; однако это представляет некоторые трудности, которые необходимо преодолеть. Покрытия зависит от каждого генома обилию в его конкретном обществе; геномы с низким содержанием могут подвергаться фрагментации, если глубина секвенирования недостаточна для предотвращения образования пробелов. К счастью, существуют ассемблеры, специфичные для метагенома, поскольку, если присутствуют сотни штаммов, глубину секвенирования необходимо увеличить до максимума. [19]
Contig binning [ править ]
Ни какой геном происходит от каждого контига , ни количество геномов, присутствующих в образце, априори неизвестно ; цель этого шага - разделить контиги на виды. Методы для выполнения такого анализа могут быть контролируемыми (база данных с известными последовательностями) или неконтролируемыми (прямой поиск групп контигов в собранных данных). Однако для обоих методов требуется своего рода метрика для определения оценки сходства между конкретным контигом и группой, в которую он должен быть помещен, а также алгоритмы для преобразования сходства в распределения в группах. [19]
Анализ после обработки [ править ]
Статистический анализ важен для подтверждения полученных результатов ( ANOVA может использоваться для определения различий между группами); если он сочетается с графическими инструментами, результат легко визуализировать и понять. [19]
После сборки метагенома можно сделать вывод о функциональном потенциале микробиома. Вычислительные проблемы для этого типа анализа больше, чем для одиночных геномов, потому что обычно сборщики метагеномов имеют более низкое качество, и многие восстановленные гены являются неполными или фрагментированными. После этапа идентификации гена данные можно использовать для выполнения функциональной аннотации посредством множественного сопоставления целевых генов с базами данных ортологов . [20]
Анализ маркерного гена [ править ]
Это метод, который использует праймеры для нацеливания на конкретную генетическую область и позволяет определять филогении микробов . Генетическая область характеризуется очень вариабельной областью, которая может дать подробную идентификацию; он ограничен консервативными областями, которые функционируют как сайты связывания для праймеров, используемых в ПЦР . Основным геном, используемым для характеристики бактерий и архей, является ген 16S рРНК , тогда как идентификация грибов основана на внутреннем транскрибируемом спейсере.(ЭТО). Методика быстрая и недорогая и позволяет получить классификацию микробного образца с низким разрешением; он оптимален для образцов, которые могут быть загрязнены ДНК хозяина. Сродство праймера варьируется среди всех последовательностей ДНК, что может приводить к ошибкам во время реакции амплификации; действительно, образцы с низким содержанием чувствительны к ошибкам чрезмерной амплификации, так как другие контаминирующие микроорганизмы будут перепредставлены в случае увеличения циклов ПЦР. Таким образом, оптимизация выбора праймера может помочь уменьшить такие ошибки, хотя для этого требуется полное знание микроорганизмов, присутствующих в образце, и их относительное количество. [21]
На анализ маркерного гена можно повлиять выбором праймера; в этом виде анализа желательно использовать хорошо проверенный протокол (например, тот, который используется в проекте « Микробиом Земли» ). Первое, что нужно сделать при анализе ампликона маркерного гена, - это устранить ошибки секвенирования; Многие платформы для секвенирования очень надежны, но большая часть очевидного разнообразия последовательностей по-прежнему связана с ошибками в процессе секвенирования. Чтобы уменьшить это явление, первый подход состоит в том, чтобы объединить последовательности в операционную таксономическую единицу (OTU): этот процесс объединяет похожие последовательности (обычно принимается порог сходства 97%) в единую функцию, которая может использоваться на дальнейших этапах анализа; однако этот метод отбрасывает SNPпотому что они будут сгруппированы в одну OTU. Другой подход - олиготипирование , которое включает позиционно-специфическую информацию из секвенирования 16s рРНК для обнаружения небольших вариаций нуклеотидов и различения между тесно связанными отдельными таксонами. Эти методы дают в качестве выходных данных таблицу последовательностей ДНК и количество различных последовательностей на образец, а не OTU. [21]
Еще один важный шаг в анализе - присвоить таксономическое название микробным последовательностям в данных. Это можно сделать с помощью подходов машинного обучения, которые могут достигать точности на уровне рода около 80%. Другие популярные пакеты анализа обеспечивают поддержку таксономической классификации с использованием точных совпадений со справочными базами данных и должны обеспечивать большую специфичность, но низкую чувствительность. Неклассифицированный микроорганизм следует дополнительно проверить на предмет последовательностей органелл. [21]
Филогенетический анализ [ править ]
Многие методы, использующие филогенетический вывод, используют ген 16SRNA для архей и бактерий и ген 18SRNA для эукариот. Филогенетические сравнительные методы (PCS) основаны на сравнении множества признаков среди микроорганизмов; Принцип таков: чем теснее они связаны, тем больше у них общих черт. Обычно PCS сочетаются с филогенетическим обобщенным методом наименьших квадратов (PGLS) или другим статистическим анализом для получения более значимых результатов. Реконструкция состояния предков используется в исследованиях микробиома для вменения значений признаков для таксонов, признаки которых неизвестны. Обычно это выполняется с помощью PICRUSt , который использует доступные базы данных. Филогенетическийпеременные выбираются исследователями в соответствии с типом исследования: путем выбора некоторых переменных со значительной биологической информацией можно уменьшить размер данных для анализа. [22]
Филогенетическая осведомленность о дистанции обычно выполняется с помощью UniFrac или аналогичных инструментов, таких как индекс Соресена или D Рао, для количественной оценки различий между различными сообществами. На все эти методы негативно влияет горизонтальная передача генов (HGT), так как она может генерировать ошибки и приводить к корреляции отдаленных видов. Есть разные способы уменьшить негативное влияние HGT: использование нескольких генов или вычислительных инструментов для оценки вероятности предполагаемых событий HGT. [22]
Типы [ править ]
Бактерии [ править ]
Популяции микробов (таких как бактерии и дрожжи ) населяют кожу и поверхности слизистых оболочек в различных частях тела. Их роль составляет часть нормальной, здоровой физиологии человека, однако, если количество микробов вырастает за пределы их типичных диапазонов (часто из-за ослабленной иммунной системы) или если микробы заселяются (например, из-за плохой гигиены или травмы), участки тела обычно не колонизируются или стерильное (например, кровь, или нижние дыхательные пути, или брюшная полость), может привести к заболеванию (вызывающему, соответственно, бактериемию / сепсис, пневмонию и перитонит). [ требуется медицинская цитата ]
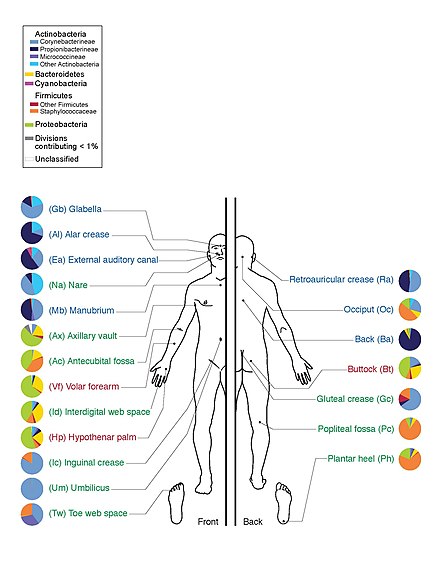
Проект «Микробиом человека» обнаружил, что люди являются хозяевами тысяч видов бактерий, причем разные участки тела имеют свои собственные отличительные сообщества. Кожа и влагалище показали меньшее разнообразие, чем рот и кишечник, они показали наибольшее богатство. Бактериальный состав на определенном участке тела варьируется от человека к человеку не только по типу, но и по количеству. Бактерии одного и того же вида, встречающиеся во рту, относятся к нескольким подтипам, предпочитая обитать во рту в совершенно разных местах. Даже энтеротипы в кишечнике человека, которые ранее считались хорошо изученными, происходят из широкого спектра сообществ с размытыми границами таксонов. [23] [24]
По оценкам, в кишечнике человека обитает от 500 до 1000 видов бактерий, но они принадлежат лишь к нескольким типам: доминируют Firmicutes и Bacteroidetes, но есть также Proteobacteria , Verrumicrobia , Actinobacteria , Fusobacteria и Cyanobacteria . [25]
Ряд типов бактерий, таких как Actinomyces viscosus и A. naeslundii , обитает во рту, где они являются частью липкого вещества, называемого зубным налетом . Если его не удалить щеткой, он затвердеет, образуя зубной камень (также называемый зубным камнем). Эти же бактерии также выделяют кислоты, растворяющие зубную эмаль , вызывая кариес .
В микрофлоры влагалища в основном состоят из различных лактобактерий видов. Долгое время считалось, что наиболее распространенным из этих видов является Lactobacillus acidophilus , но позже было показано, что на самом деле наиболее распространен L. iners , за ним следует L. crispatus . Другие лактобациллы, обнаруживаемые во влагалище, - это L. jensenii , L. delbruekii и L. gasseri . Нарушение микрофлоры влагалища может привести к таким инфекциям, как бактериальный вагиноз или кандидоз («дрожжевая инфекция»).
Археи [ править ]
Археи присутствуют в кишечнике человека, но, в отличие от огромного разнообразия бактерий в этом органе, количество видов архей гораздо более ограничено. [26] Доминирующей группой являются метаногены , в частности Methanobrevibacter smithii и Methanosphaera stadtmanae . [27] Однако колонизация метаногенами варьируется, и только около 50% людей имеют легко обнаруживаемые популяции этих организмов. [28]
По состоянию на 2007 г. не было известно никаких явных примеров патогенов архей [29] [30], хотя была предложена связь между наличием некоторых метаногенов и пародонтозом человека . [31]
Грибы [ править ]
Грибы, в частности дрожжи , присутствуют в кишечнике человека. [32] [33] [34] [35] Наиболее изученными из них являются виды Candida из-за их способности становиться патогенными у больных с ослабленным иммунитетом и даже у здоровых хозяев. [33] [34] [35] Дрожжи также присутствуют на коже [32], например, виды Malassezia , где они потребляют масла, выделяемые сальными железами . [36] [37]
Вирусы [ править ]
Вирусы, особенно бактериальные вирусы ( бактериофаги ), колонизируют различные участки тела. Эти колонизированные участки включают кожу [38] кишечник, [39] легкие [40] и ротовую полость. [41] Сообщества вирусов связаны с некоторыми заболеваниями, а не просто отражают бактериальные сообщества. [42] [43] [44]
Анатомические области [ править ]
Кожа [ править ]
Исследование 20 участков кожи на каждом из десяти здоровых людей обнаружило 205 идентифицированных родов в 19 бактериальных типах, причем большинство последовательностей было отнесено к четырем типам: Actinobacteria (51,8%), Firmicutes (24,4%), Proteobacteria (16,5%) и Bacteroidetes ( 6,3%). [45] Большое количество грибковых родов присутствует на здоровой коже человека, с некоторыми вариациями по регионам тела; однако при патологических состояниях определенные роды имеют тенденцию доминировать в пораженной области. [32] Например, Malassezia преобладает при атопическом дерматите, а Acremonium - на коже головы, пораженной перхотью. [32]
Кожа действует как барьер, сдерживающий вторжение патогенных микробов. Кожа человека содержит микробы, которые обитают в коже или на ней и могут быть жилыми или временными. Типы резидентных микроорганизмов различаются в зависимости от типа кожи на теле человека. Большинство микробов обитают на поверхностных клетках кожи или предпочитают связываться с железами. Эти железы, такие как сальные или потовые железы, снабжают микробы водой, аминокислотами и жирными кислотами. Кроме того, резидентные бактерии, связанные с сальными железами, часто являются грамположительными и могут быть патогенными. [2]
Конъюнктива [ править ]
В конъюнктиве обычно присутствует небольшое количество бактерий и грибков . [32] [46] Классы бактерий включают грамположительные кокки (например, стафилококки и стрептококки ) и присутствуют грамотрицательные палочки и кокки (например, Haemophilus и Neisseria ). [46] Грибковые роды включают Candida , Aspergillus и Penicillium . [32] слезные железы непрерывно секретирует, сохраняя конъюнктивы влажного, в то время мигания смазывает конъюнктив и смывает посторонние материалы. Слезы содержат бактерициды, такие каклизоцим , так что микроорганизмы испытывают трудности с выживанием лизоцима и оседанием на эпителиальных поверхностях.
Желудочно-кишечный тракт [ править ]
Метаболизм триптофана кишечной микробиотой человека () |
У человека состав микробиома желудочно-кишечного тракта устанавливается во время рождения. [51] Роды путем кесарева сечения или естественных родов также влияют на микробный состав кишечника. Младенцы, рожденные через вагинальный канал, имеют непатогенную, полезную кишечную микробиоту, аналогичную той, что обнаруживается у матери. [52] Однако микробиота кишечника детей, рожденных с помощью кесарева сечения, содержит больше патогенных бактерий, таких как кишечная палочка и стафилококк, и требуется больше времени для развития непатогенной полезной микробиоты кишечника. [53]
Отношения между некоторой кишечной флорой и людьми не просто комменсальные (безвредное сосуществование), а скорее мутуалистические отношения. [2] Некоторые кишечные микроорганизмы человека приносят пользу хозяину, ферментируя пищевые волокна до короткоцепочечных жирных кислот (SCFA), таких как уксусная кислота и масляная кислота , которые затем абсорбируются хозяином. [4] [54] Кишечные бактерии также играют роль в синтезе витаминов B и K, а также в метаболизме желчных кислот и стеролов., и ксенобиотики . [2] [54] Системное значение SCFAs и других соединений, которые они производят, подобны гормонам, а сама кишечная флора, по-видимому, функционирует как эндокринный орган , [54] а нарушение регуляции кишечной флоры коррелирует с множеством воспалительных процессов. и аутоиммунные состояния. [4] [55]
Состав флоры кишечника человека меняется со временем, когда меняется диета и общее состояние здоровья. [4] [55] систематический обзор 15 человека рандомизированных контролируемых исследований с июля 2016 года установлено , что некоторые коммерчески доступные штаммы пробиотических бактерий из Bifidobacterium и Lactobacillus родов ( Б. лонгум , Б. Breve , Б. infantis , Л. Helveticus , L. rhamnosus , L. plantarum и L. casei ) при пероральном приеме в суточных дозах 109 -10 10 колониеобразующих единиц (КОЕ) в течение 1-2 месяцев, обладают эффективностью лечения (то есть, улучшает поведенческие исходы) в некоторых расстройств центральной нервной системы - в том числе тревоги , депрессии , аутизма расстройства спектра , и обсессивно-компульсивное расстройство - и улучшает определенные аспекты памяти . [56] Однако было обнаружено, что изменения в составе кишечной микробиоты также связаны с вредным воздействием на здоровье. В статье, опубликованной Musso et al., Было обнаружено, что микробиота кишечника людей с ожирением имеет больше Firmicutes и меньше Bacteroidetes.чем здоровые люди. [57] Считается, что это изменение в соотношении микробов может способствовать увеличению числа бактерий, более эффективных в извлечении энергии из пищи. Исследователи использовали секвенирование с дробовиком, чтобы сравнить микробиоту мышей с ожирением с мышами тощими. Они обнаружили, что геномы мышей с ожирением состоят из множества генов, кодирующих ферменты, способные расщеплять полисахариды, которые не перевариваются одним человеческим телом. [58]
Кроме того, исследование, проведенное Гордоном и соавторами, подтвердило, что именно состав микробиоты вызывает ожирение, а не наоборот. Это было сделано путем трансплантации микробиоты кишечника от мышей с ожирением, вызванным диетой (DIO), или мышей из контрольной группы худым мышам без микробов, у которых нет микробиома. Они обнаружили, что у мышей, которым была трансплантирована кишечная микробиота мышей DIO, было значительно больше общего жира в организме, чем у мышей, которым была трансплантирована постная микробиота мышей, при кормлении той же диетой. [59]
Отдельное исследование, выполненное Ridaura et al. в 2013 г. осуществила первую трансплантацию фекалий человека стерильным мышам. Собранные человеческие фекалии были получены от взрослых женщин-близнецов с заметно различающимся процентным содержанием жира. Исследователи смогли по существу передать фенотип ожирения и фенотип постного мяса мышам, находясь на обезжиренном корме для мышей. У мышей с фекалиями, полученными от тучного близнеца, увеличилась общая масса тела и жировая масса, в то время как у мышей с фекалиями, полученными от более поджарого близнеца, не развились черты или симптомы, подобные ожирению. [60]
Уретра и мочевой пузырь [ править ]
Мочеполовая система , как представляется , имеет микробиот, [61] [62] , которая является неожиданной находкой в свете давнего использования стандартных клинических микробиологических культур методов обнаружения бактерий в моче , когда люди показывают признаки инфекции мочевых путей ; Эти тесты обычно не показывают присутствия бактерий. [63] Похоже, что обычные методы культивирования не позволяют обнаружить многие виды бактерий и других микроорганизмов , которые обычно присутствуют. [63] По состоянию на 2017 г., секвенированиеметоды были использованы для идентификации этих микроорганизмов, чтобы определить, есть ли различия в микробиоте между людьми с проблемами мочевыводящих путей и теми, кто здоров. [61] [62] Чтобы правильно оценить микробиом мочевого пузыря, в отличие от мочеполовой системы, образец мочи следует собирать непосредственно из мочевого пузыря, что часто делается с помощью катетера . [64]
Вагина [ править ]
Микробиота влагалища относится к тем видам и родам, которые колонизируют влагалище. Эти организмы играют важную роль в защите от инфекций и поддержании здоровья влагалища. [65] Наиболее многочисленные вагинальные микроорганизмы, обнаруживаемые у женщин в пременопаузе, принадлежат к роду Lactobacillus , которые подавляют патогены, производя перекись водорода и молочную кислоту. [34] [65] [66] Видовой состав и соотношение бактерий варьируются в зависимости от стадии менструального цикла . [67] [68] [ требуется обновление ]Этническая принадлежность также влияет на флору влагалища. Возникновение лактобацилл, продуцирующих перекись водорода, ниже у афро-американских женщин, а рН влагалища выше. [69] Другие влиятельные факторы, такие как половой акт и прием антибиотиков, были связаны с потерей лактобацилл. [66] Более того, исследования показали, что половой акт с презервативом действительно меняет уровень лактобацилл и увеличивает уровень кишечной палочки во влагалищной флоре. [66] Изменения в нормальной, здоровой влагалищной микробиоте являются признаком инфекций [70], таких как кандидоз или бактериальный вагиноз . [66] Candida albicansподавляет рост видов Lactobacillus , тогда как виды Lactobacillus, вырабатывающие перекись водорода, подавляют рост и вирулентность Candida albicans как во влагалище, так и в кишечнике. [32] [34] [35]
Роды грибов, обнаруженные во влагалище, включают , среди прочего, Candida , Pichia , Eurotium , Alternaria , Rhodotorula и Cladosporium . [32]
Плацента [ править ]
До недавнего времени плацента считалась стерильным органом, но были идентифицированы комменсальные, непатогенные виды и роды бактерий, которые обитают в ткани плаценты. [71] [72] [73]
Матка [ править ]
До недавнего времени верхние половые пути женщин считались стерильной средой. У здоровых бессимптомных женщин репродуктивного возраста в матке обитают самые разные микроорганизмы. Микробиом матки значительно отличается от микробиома влагалища и желудочно-кишечного тракта. [74]
Полость рта [ править ]
Окружающая среда, присутствующая во рту человека, способствует росту характерных микроорганизмов, обнаруженных там. Он обеспечивает источник воды и питательных веществ, а также умеренную температуру. [2] Резидентные микробы ротовой полости прикрепляются к зубам и деснам, чтобы противостоять механической промывке изо рта в желудок, где чувствительные к кислоте микробы уничтожаются соляной кислотой. [2] [34]
К анаэробным бактериям в ротовой полости относятся: Actinomyces , Arachnia , Bacteroides , Bifidobacterium , Eubacterium , Fusobacterium , Lactobacillus , Leptotrichia , Peptococcus , Peptostreptococcus , Propionibacterium , Selenomonas , Treponella и Vera . [75] [ требуется обновление ] Роды грибов, которые часто встречаются во рту, включают Candida , Cladosporium ,Aspergillus , Fusarium , Glomus , Alternaria , Penicillium и Cryptococcus и другие. [32]
Бактерии накапливаются как на твердых, так и на мягких тканях полости рта в виде биопленки, позволяя им прилипать и стремиться к окружающей среде полости рта, будучи защищенными от факторов окружающей среды и противомикробных агентов. [76] Слюна играет ключевую гомеостатическую роль биопленки, позволяя повторно заселять бактерии для образования и контроля роста за счет отделения накопившихся биопленок. [77] Он также обеспечивает средства регулирования питательных веществ и температуры. Расположение биопленки определяет тип получаемых ею питательных веществ. [78]
Оральные бактерии развили механизмы, позволяющие чувствовать окружающую среду и уклоняться от хозяина или изменять его. Однако высокоэффективная врожденная система защиты хозяина постоянно контролирует бактериальную колонизацию и предотвращает бактериальную инвазию в местные ткани. Между бактериями зубного налета и врожденной системой защиты хозяина существует динамическое равновесие . [79]
Эта динамика между ротовой полостью хозяина и микробами ротовой полости играет ключевую роль в здоровье и болезнях, поскольку обеспечивает проникновение в организм. [80] Здоровое равновесие представляет собой симбиотические отношения, при которых микробы полости рта ограничивают рост и прилипание патогенов, в то время как хозяин обеспечивает среду для их процветания. [80] [76] Экологические изменения, такие как изменение иммунного статуса, смещение резидентных микробов и изменение доступности питательных веществ от взаимных к паразитарным отношениям, в результате чего хозяин предрасположен к оральным и системным заболеваниям. [76] Системные заболевания, такие как диабет и сердечно-сосудистые заболевания, связаны с плохим здоровьем полости рта. [80]Особый интерес представляет роль микроорганизмов полости рта в двух основных стоматологических заболеваниях: кариесе и заболеваниях пародонта . [79] Колонизация патогенами в пародонте вызывает чрезмерный иммунный ответ, в результате чего образуется пародонтальный карман - углубленное пространство между зубом и десной. [76] Это действует как защищенный богатый кровью резервуар с питательными веществами для анаэробных патогенов. [76] Системное заболевание на различных участках тела может быть результатом попадания микробов полости рта в кровь, минуя пародонтальные карманы и оболочки полости рта. [80]
Постоянная надлежащая гигиена полости рта является основным методом профилактики заболеваний полости рта и системных заболеваний. [80] Это снижает плотность биопленки и разрастание потенциальных патогенных бактерий, вызывающих заболевание. [78] Однако надлежащей гигиены полости рта может быть недостаточно, поскольку микробиом полости рта, генетика и изменения иммунного ответа играют важную роль в развитии хронических инфекций. [78] Использование антибиотиков может лечить уже распространяющуюся инфекцию, но неэффективно против бактерий в биопленках. [78]
Легкое [ править ]
Как и полость рта, верхние и нижние дыхательные пути обладают механическими средствами защиты от микробов. Бокаловидные клетки производят слизь, которая улавливает микробы и выводит их из дыхательной системы посредством непрерывно перемещающихся мерцательных эпителиальных клеток. [2] Кроме того, бактерицидное действие оказывает слизь из носа, содержащая фермент лизоцим. [2] Верхние и нижние дыхательные пути, по-видимому, имеют свой собственный набор микробиоты. [81] Легочная бактериальная микробиота относится к 9 основным родам бактерий: Prevotella , Sphingomonas , Pseudomonas , Acinetobacter , Fusobacterium , Megasphaera., Veillonella , Staphylococcus и Streptococcus . Некоторые бактерии респираторного тракта, которые считаются «нормальной биотой», могут вызывать серьезные заболевания, особенно у людей с ослабленным иммунитетом; к ним относятся Streptococcus pyogenes , Haemophilus influenzae , Streptococcus pneumoniae , Neisseria meningitidis и Staphylococcus aureus . [ необходима цитата ] Роды грибов, которые составляют микобиом легких, включают Candida , Malassezia , Neosartorya , Saccharomyces иAspergillus и другие. [32]
Необычное распределение родов бактерий и грибов в дыхательных путях наблюдается у людей с муковисцидозом . [32] [82] Их бактериальная флора часто содержит устойчивые к антибиотикам и медленнорастущие бактерии, и частота этих патогенов изменяется в зависимости от возраста. [82]
Желчные пути [ править ]
Традиционно желчные пути считались стерильными, а присутствие микроорганизмов в желчи является маркером патологического процесса. Это предположение было подтверждено неудачей в выделении штаммов бактерий из нормального желчного протока. В 2013 году начали появляться статьи, показывающие, что нормальная микробиота желчных путей представляет собой отдельный функциональный слой, который защищает желчные пути от колонизации экзогенными микроорганизмами. [83]
Болезнь и смерть [ править ]
Человеческий организм полагается на бесчисленные бактериальные гены как на источник необходимых питательных веществ. [84] Как метагеномные, так и эпидемиологические исследования указывают на жизненно важную роль микробиома человека в предотвращении широкого спектра заболеваний, от диабета 2 типа и ожирения до воспалительных заболеваний кишечника, болезни Паркинсона и даже состояний психического здоровья, таких как депрессия. [85] Симбиотические отношения между микробиотой кишечника и различными бактериями могут влиять на иммунный ответ человека. [86] Хотя лечение на основе микробиома находится в зачаточном состоянии, оно также является многообещающим, особенно для лечения лекарственно-устойчивой инфекции C. difficile [87] и лечения диабета. [88]
Инфекция Clostridioides difficile [ править ]
Подавляющее присутствие бактерий C. difficile приводит к инфекции желудочно-кишечного тракта, обычно связанной с дисбактериозом с микробиотой, предположительно вызванной приемом антибиотиков. Использование антибиотиков уничтожает полезную кишечную флору в желудочно-кишечном тракте, что обычно препятствует установлению доминирования патогенных бактерий. [89] Традиционное лечение инфекций, вызванных C. difficile, включает дополнительный режим приема антибиотиков, однако его эффективность составляет в среднем 20–30%. [90] Признавая важность здоровых кишечных бактерий, исследователи обратились к процедуре, известной как трансплантация фекальной микробиоты, при которой пациенты страдают желудочно-кишечными заболеваниями, такими какC. difficile , получают фекалии от здорового человека в надежде восстановить нормальную работу кишечной микробиоты. [91] Систематический обзор 317 пациентов, получавших лечение в 27 сериях случаев и отчетах, показал, что перенос фекальной микробиоты привел к эффективности 92%. [90]
Рак [ править ]
Хотя рак обычно является заболеванием, обусловленным генетикой хозяина и факторами окружающей среды, микроорганизмы причастны к примерно 20% раковых заболеваний человека. [92] В частности, что касается потенциальных факторов рака толстой кишки , плотность бактерий в миллион раз выше, чем в тонком кишечнике , и примерно в 12 раз больше случаев рака встречается в толстой кишке по сравнению с тонкой кишкой, что, возможно, указывает на патогенную роль микробиоты в толстой кишке. и рак прямой кишки. [93] Плотность микробов может использоваться в качестве прогностического инструмента при оценке колоректального рака. [93]
Микробиота может влиять на канцерогенез тремя широкими способами: (i) изменяя баланс пролиферации и гибели опухолевых клеток, (ii) регулируя функцию иммунной системы и (iii) влияя на метаболизм факторов, продуцируемых хозяином, пищевых продуктов и фармацевтических препаратов. [92] Опухоли, возникающие на пограничных поверхностях, таких как кожа, ротоглотка и дыхательные пути, пищеварительный и урогенитальный тракты, содержат микробиоту. Существенное присутствие микробов на участке опухоли не устанавливает ассоциации или причинных связей. Вместо этого микробы могут найти в опухоли давление кислорода или профиль питательных веществ. Снижение популяции определенных микробов или индуцированный окислительный стресс также могут увеличить риски. [92] [93]Из примерно 10 30 микробов на Земле десять классифицированы Международным агентством по изучению рака как канцерогены для человека. [92] Микробы могут секретировать белки или другие факторы, непосредственно управляющие пролиферацией клеток в организме хозяина, или могут повышать или понижать регуляцию иммунной системы хозяина, включая развитие острого или хронического воспаления, способствуя канцерогенезу. [92]
Что касается взаимосвязи иммунной функции и развития воспаления, поверхностные барьеры слизистой оболочки подвержены экологическим рискам и должны быстро восстанавливаться для поддержания гомеостаза . Нарушение устойчивости хозяина или микробиоты также снижает устойчивость к злокачественным новообразованиям, что может вызвать воспаление и рак. Как только барьеры нарушены, микробы могут вызывать провоспалительные или иммуносупрессивные программы различными путями. [92] Например, связанные с раком микробы, по-видимому, активируют передачу сигналов NF-κΒ в микроокружении опухоли. Другие рецепторы распознавания образов, такие как члены семейства рецепторов типа нуклеотид-связывающего домена олигомеризации (NLR) NOD-2 , NLRP3 ,NLRP6 и NLRP12 могут играть роль в опосредовании колоректального рака. [92] Точно так же Helicobacter pylori, по- видимому, увеличивает риск рака желудка из-за того, что вызывает хроническую воспалительную реакцию в желудке. [92] [93]
Воспалительное заболевание кишечника [ править ]
Воспалительное заболевание кишечника состоит из двух разных заболеваний: язвенного колита и болезни Крона, и оба эти заболевания проявляются нарушениями микробиоты кишечника (также известными как дисбактериоз ). Этот дисбиоз проявляется в виде снижения микробного разнообразия в кишечнике [94] [95] и коррелирует с дефектами в генах хозяина, которые изменяют врожденный иммунный ответ у людей. [94]
Вирус иммунодефицита человека [ править ]
ВИЧ прогрессирования заболевания влияет на состав и функцию микрофлоры кишечника, при этом значительных различиях между ВИЧ-отрицательным, ВИЧ-позитивным и пост- АРТОМ ВИЧ-инфицированным населением. [ необходима цитата ] ВИЧ снижает целостность барьерной функции кишечного эпителия, воздействуя на плотные соединения . Этот распад способствует перемещению через эпителий кишечника, что, как считается, способствует увеличению воспаления, наблюдаемого у людей с ВИЧ. [96]
Влагалищная микробиота играет роль в инфекционности ВИЧ, с повышенным риском инфицирования и передачи, когда женщина страдает бактериальным вагинозом , состоянием, характеризующимся ненормальным балансом вагинальных бактерий. [97] Повышенная инфекционность наблюдается при увеличении провоспалительных цитокинов и клеток CCR5 + CD4 + во влагалище. Однако снижение инфекционности наблюдается при повышении уровня вагинальных лактобацилл, что способствует возникновению противовоспалительного состояния. [96]
Смерть [ править ]
Со смертью микробиом живого тела разрушается, и другой состав микроорганизмов, называемый некробиомом , становится важным активным компонентом сложного процесса физического разложения. Считается, что его предсказуемые изменения с течением времени помогают определить время смерти. [98] [99]
Гигиена окружающей среды [ править ]
Исследования, проведенные в 2009 году, поставили под сомнение, может ли сокращение биоты (включая микрофауну ) в результате вмешательства человека препятствовать здоровью человека, процедурам безопасности в больницах, дизайну пищевых продуктов и лечению болезней. [100]
Миграция [ править ]
Предварительные исследования показывают, что немедленные изменения в микробиоте могут произойти, когда человек мигрирует из одной страны в другую, например, когда тайские иммигранты поселились в Соединенных Штатах [101] или когда латиноамериканцы иммигрировали в Соединенные Штаты. [102] Потеря разнообразия микробиоты была больше у людей с ожирением и детей иммигрантов. [101] [102]
См. Также [ править ]
- Молекулы, выделяющие окись углерода
- Устойчивость к лекарству
- Проект человеческого микробиома
- Микробиом грудного молока
- Виром человека
- Первоначальное приобретение микробиоты
- Список микробиоты бактериального вагиноза
- Микробиом
- Проект иммунитета к микробиомам
- Микроорганизм
- uBiome
Библиография [ править ]
- Эд Йонг. Я вмещаю множество: микробы внутри нас и более широкий взгляд на жизнь. 368 страниц, опубликовано 9 августа 2016 г. компанией Ecco, ISBN 0062368591 .
Ссылки [ править ]
- ^ a b Marchesi JR, Ravel J (2015). «Словарь исследования микробиома: предложение» . Микробиом . 3 : 31. DOI : 10,1186 / s40168-015-0094-5 . PMC 4520061 . PMID 26229597 .
Микробиом
Этот термин относится ко всей среде обитания, включая микроорганизмы (бактерии, археи, низшие и высшие эуркариоты и вирусы), их геномы (т. Е. Гены) и условия окружающей среды. Это определение основано на понятии «биом», биотических и абиотических факторах данной среды. Другие в этой области ограничивают определение микробиома набором генов и геномов членов микробиоты. Утверждается, что это определение метагенома , который в сочетании с окружающей средой составляет микробиом. - ^ Б с д е е г ч я J к Шервуда л, Уилли Дж, Вулвертон С (2013). Микробиология Прескотта (9-е изд.). Нью-Йорк: Макгроу Хилл. С. 713–721. ISBN 9780073402406. OCLC 886600661 .
- ^ a b Отправитель R, Fuchs S, Milo R (январь 2016 г.). «Действительно ли нас намного меньше численности? Возвращаясь к соотношению бактериальных клеток и клеток-хозяев у людей» . Cell . 164 (3): 337–40. DOI : 10.1016 / j.cell.2016.01.013 . PMID 26824647 .
- ^ Б с д е е Quigley EM (сентябрь 2013 г. ). «Кишечные бактерии в здоровье и болезни» . Гастроэнтерология и гепатология . 9 (9): 560–9. PMC 3983973 . PMID 24729765 .
- ^ Falony G, Виейра-Silva S, Раес J (2015). «Микробиология встречает большие данные: случай триметиламина, полученного из кишечной микробиоты». Ежегодный обзор микробиологии . 69 : 305–21. DOI : 10.1146 / annurev-micro-091014-104422 . PMID 26274026 .
мы рассматриваем литературу по триметиламину (ТМА), метаболиту, продуцируемому микробиотой, связанному с развитием атеросклероза.
- ^ Gaci N, Боррел G, Tottey Вт, О'Тул PW, Brugère ДФ (ноябрь 2014). «Археи и человеческий кишечник: новое начало старой истории» . Всемирный журнал гастроэнтерологии . 20 (43): 16062–78. DOI : 10,3748 / wjg.v20.i43.16062 . PMC 4239492 . PMID 25473158 .
Триметиламин - это исключительно продукт микробиоты, состоящий из питательных веществ (лецитин, холин, ТМАО, L-карнитин) из нормального рациона, от которого, по-видимому, происходят два заболевания: триметиламинурия (или синдром рыбьего запаха) и сердечно-сосудистые заболевания из-за проатерогенных свойств его окисленного вещества. печеночная форма.
- ^ a b «Проект NIH Human Microbiome Project определяет нормальный бактериальный состав тела» . Новости NIH. 13 июня 2012 г.
- ^ a b Часто задаваемые вопросы Американской академии микробиологии : микробиом человека. Архивировано 31 декабря 2016 г. на Wayback Machine, январь 2014 г.
- ↑ Джуда Л. Рознер для журнала Microbe Magazine, февраль 2014 г. У человека в десять раз больше микробных клеток, чем клеток тела?
- ^ Элисон Эбботт для Nature News. 8 января 2016 г. Ученые опровергают миф о том, что в нашем организме больше бактерий, чем клеток человека
- ^ Гилберт, Джек; Blaser, Martin J .; Капорасо, Дж. Грегори; Янссон, Джанет; Линч, Сьюзен В .; Рыцарь, Роб (10 апреля 2018 г.). «Современное понимание микробиома человека» . Природная медицина . 24 (4): 392–400. DOI : 10.1038 / nm.4517 . ISSN 1078-8956 . PMC 7043356 . PMID 29634682 .
- ^ a b c Петерсон Дж., Гарджес С., Джованни М., Макиннес П., Ван Л., Шлосс Дж. А. и др. (Декабрь 2009 г.). "Проект микробиома человека NIH" . Геномные исследования . 19 (12): 2317–23. DOI : 10.1101 / gr.096651.109 . PMC 2792171 . PMID 19819907 .
- ^ Кучинский J, Lauber CL, Walters WA, Parfrey LW, Клементе JC, Gevers D, Knight R (декабрь 2011). «Экспериментально-аналитический инструментарий для изучения микробиома человека» . Обзоры природы. Генетика . 13 (1): 47–58. DOI : 10.1038 / nrg3129 . PMC 5119550 . PMID 22179717 .
- ^ Vestheim H, Jarman SN (июль 2008). «Блокирующие праймеры для усиления ПЦР-амплификации редких последовательностей в смешанных образцах - тематическое исследование ДНК жертвы в желудках антарктического криля» . Границы зоологии . 5 : 12. DOI : 10,1186 / 1742-9994-5-12 . PMC 2517594 . PMID 18638418 .
- ^ Tap J, Mondot S, Levenez F, Pelletier E, Caron C, Furet JP, et al. (Октябрь 2009 г.). «К филогенетическому ядру кишечной микробиоты человека». Экологическая микробиология . 11 (10): 2574–84. DOI : 10.1111 / j.1462-2920.2009.01982.x . PMID 19601958 .
- ^ Хамади M, Knight R (июль 2009). «Профилирование микробного сообщества для проектов по микробиому человека: инструменты, методы и проблемы» . Геномные исследования . 19 (7): 1141–52. DOI : 10.1101 / gr.085464.108 . PMC 3776646 . PMID 19383763 .
- ^ Methé Б. А., Нельсон К. Е., Поп М, Кризи НН, Джильо М.Г., Huttenhower С. и др. (Консорциум проекта по микробиому человека) (июнь 2012 г.). «Основа для исследования микробиома человека» . Природа . 486 (7402): 215–21. Bibcode : 2012Natur.486..215T . DOI : 10.1038 / nature11209 . PMC 3377744 . PMID 22699610 .
- ^ Консорциум проекта микробиома человека (июнь 2012 г.). «Структура, функции и разнообразие микробиома здорового человека» . Природа . 486 (7402): 207–14. Bibcode : 2012Natur.486..207T . DOI : 10.1038 / nature11234 . PMC 3564958 . PMID 22699609 .
- ^ Б с д е е айвы С, Walker, AW Симпсон JT, Ломан NJ, Segata N (сентябрь 2017 г.). «Метагеномика дробовика: от отбора проб до анализа» (PDF) . Природа Биотехнологии . 35 (9): 833–844. DOI : 10.1038 / nbt.3935 . ЛВП : 2164/10167 . PMID 28898207 . S2CID 19041044 .
- ^ Клаэссон MJ, Клуни AG, О'Тул PW (октябрь 2017). «Руководство клинициста по анализу микробиома». Обзоры природы. Гастроэнтерология и гепатология . 14 (10): 585–595. DOI : 10.1038 / nrgastro.2017.97 . PMID 28790452 . S2CID 24644894 .
- ^ a b c Knight R, Vrbanac A, Taylor BC, Axsenov A, Callewaert C, Debelius J, et al. (Июль 2018 г.). «Лучшие практики для анализа микробиомов» . Обзоры природы. Микробиология . 16 (7): 410–422. DOI : 10.1038 / s41579-018-0029-9 . PMID 29795328 . S2CID 43936002 .
- ^ a b Уошберн А. Д., Мортон Дж. Т., Сандерс Дж., Макдональд Д., Чжу К., Оливеро А. М., Найт Р. (июнь 2018 г.). «Методы филогенетического анализа данных микробиома». Природная микробиология . 3 (6): 652–661. DOI : 10.1038 / s41564-018-0156-0 . PMID 29795540 . S2CID 43962376 .
- ^ PLoS Human микробиом Коллекция Проекта Рукопись Сводка архивация 4 марта 2014 в Вайбаке Machine 13 июня 2012
- ^ «Консорциум ученых составляет карту бактериальной экосистемы человеческого тела» . ucsf.edu .
- ^ Sommer F, Bäckhed F (апрель 2013). «Микробиота кишечника - мастера развития и физиологии организма». Обзоры природы. Микробиология . 11 (4): 227–38. DOI : 10.1038 / nrmicro2974 . PMID 23435359 . S2CID 22798964 .
- ^ Экбург ПБ, Бик Э.М., Бернштейн CN, Пурдом Э, Детлефсен Л., Сарджент М. и др. (Июнь 2005 г.). «Разнообразие микробной флоры кишечника человека» . Наука . 308 (5728): 1635–8. Bibcode : 2005Sci ... 308.1635E . DOI : 10.1126 / science.1110591 . PMC 1395357 . PMID 15831718 .
- ^ Duncan SH, Louis P, Flint HJ (апрель 2007). «Культивирование бактериального разнообразия из толстой кишки человека» . Письма по прикладной микробиологии . 44 (4): 343–50. DOI : 10.1111 / j.1472-765X.2007.02129.x . PMID 17397470 . S2CID 43706882 .
- ^ Флорин TH, Zhu G, Кирк К.М., Мартин NG (октябрь 2000). «Общие и уникальные факторы окружающей среды определяют экологию метаногенов у людей и крыс». Американский журнал гастроэнтерологии . 95 (10): 2872–9. CiteSeerX 10.1.1.606.4187 . PMID 11051362 .
- ^ Eckburg PB, Lepp PW, Relman DA (февраль 2003). «Археи и их потенциальная роль в болезнях человека» . Инфекция и иммунитет . 71 (2): 591–6. DOI : 10.1128 / IAI.71.2.591-596.2003 . PMC 145348 . PMID 12540534 .
- ^ Cavicchioli R, Curmi PM, Сондерс N, Thomas T (ноябрь 2003). «Патогенные археи: существуют ли они?». BioEssays . 25 (11): 1119–28. DOI : 10.1002 / bies.10354 . PMID 14579252 .
- ^ Lepp PW, Brinig MM, Ouverney CC, Palm K, Armitage GC, Relman DA (апрель 2004). «Метаногенные археи и пародонтоз человека» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (16): 6176–81. Bibcode : 2004PNAS..101.6176L . DOI : 10.1073 / pnas.0308766101 . PMC 395942 . PMID 15067114 .
- ^ a b c d e f g h i j k Cui L, Morris A, Ghedin E (июль 2013 г.). «Микобиом человека в здоровье и болезнях» . Геномная медицина . 5 (7): 63. DOI : 10,1186 / gm467 . PMC 3978422 . PMID 23899327 .
Рисунок 2: Распределение родов грибов по разным участкам тела
- ^ a b Мартинс Н., Феррейра И.К., Баррос Л., Сильва С., Энрикес М. (июнь 2014 г.). «Кандидоз: предрасполагающие факторы, профилактика, диагностика и альтернативное лечение» (PDF) . Микопатология . 177 (5–6): 223–40. DOI : 10.1007 / s11046-014-9749-1 . hdl : 10198/10147 . PMID 24789109 . S2CID 795450 .
Виды
Candida
и другие микроорганизмы вовлечены в эту сложную грибковую инфекцию, но
Candida albicans
продолжает оставаться наиболее распространенным. В последние два десятилетия наблюдалось аномальное разрастание в желудочно-кишечном тракте, мочевыводящих и дыхательных путях не только у пациентов с ослабленным иммунитетом, но также связанное с внутрибольничными инфекциями и даже у здоровых людей. Существует множество причинных факторов, которые способствуют развитию дрожжевой инфекции, а это означает, что кандидоз является хорошим примером многофакторного синдрома.
- ^ а б в г д Ван З.К., Ян Ю.С., Стефка А.Т., Сун Джи, Пэн Л.Х. (апрель 2014 г.). «Обзорная статья: грибковая микробиота и болезни органов пищеварения» . Пищевая фармакология и терапия . 39 (8): 751–66. DOI : 10.1111 / apt.12665 . PMID 24612332 . S2CID 22101484 .
Кроме того, грибковая инфекция ЖКТ встречается даже у пациентов с нормальным иммунным статусом. Грибковые инфекции, связанные с пищеварительной системой, могут быть вызваны как комменсальными условно-патогенными грибами, так и экзогенными патогенными грибами. ...
Candida
sp. также является наиболее часто идентифицируемым видом среди пациентов с желудочным ИФИ. ... Когда-то считалось, что желудочная кислота может убивать микробы, попадающие в желудок, и что уникальная экологическая среда желудка не подходит для микробной колонизации или инфекции. Однако несколько исследований с использованием методов, не зависящих от культуры, подтвердили, что в желудке существует большое количество кислотоустойчивых бактерий, принадлежащих к восьми типам и до 120 видам, например Streptococcus sp., Neisseria sp. и Lactobacillus sp. и т. д. 26, 27 Кроме того, Candida albicans могут хорошо расти в сильно кислой среде, 28а некоторые генотипы могут увеличивать тяжесть поражений слизистой оболочки желудка. 29
- ^ a b c Эрдоган А., Рао СС (апрель 2015 г.). «Грибковое разрастание тонкой кишки». Текущие отчеты гастроэнтерологии . 17 (4): 16. DOI : 10.1007 / s11894-015-0436-2 . PMID 25786900 . S2CID 3098136 .
Грибковый разрастание тонкого кишечника (SIFO) характеризуется наличием чрезмерного количества грибковых организмов в тонком кишечнике, связанных с желудочно-кишечными (GI) симптомами. Известно, что кандидоз вызывает симптомы со стороны желудочно-кишечного тракта, особенно у пациентов с ослабленным иммунитетом или у тех, кто получает стероиды или антибиотики. Однако только недавно появилась литература о том, что чрезмерный рост грибка в тонком кишечнике субъектов без иммунодефицита может вызвать необъяснимые симптомы со стороны желудочно-кишечного тракта. Два недавних исследования показали, что 26% (24/94) и 25,3% (38/150) пациентов с необъяснимыми желудочно-кишечными симптомами имели SIFO. Наиболее частыми симптомами, наблюдаемыми у этих пациентов, были отрыжка, вздутие живота, расстройство желудка, тошнота, диарея и газы. ... Грибно-бактериальное взаимодействие может действовать по-разному и может быть синергическим, антагонистическим или симбиотическим [29].Некоторые бактерии, такие какВиды Lactobacillus могут взаимодействовать и подавлять как вирулентность, так и рост видов Candida в кишечнике, производя перекись водорода [30]. Любое повреждение слизистого барьера или нарушение микробиоты желудочно-кишечного тракта при химиотерапии или применении антибиотиков, воспалительные процессы, активация иммунных молекул и нарушение восстановления эпителия могут вызвать чрезмерный рост грибков [27].
- ^ Маркон MJ, Пауэлл Д. (апрель 1992). «Инфекции человека, вызываемые Malassezia spp» . Обзоры клинической микробиологии . 5 (2): 101–19. DOI : 10.1128 / CMR.5.2.101 . PMC 358230 . PMID 1576583 .
- Перейти ↑ Roth RR, James WD (1988). «Микробная экология кожи». Ежегодный обзор микробиологии . 42 (1): 441–64. DOI : 10.1146 / annurev.mi.42.100188.002301 . PMID 3144238 .
- ^ Hannigan GD, Meisel JS, Tyldsley AS, Zheng Q, Hodkinson BP, SanMiguel AJ и др. (Октябрь 2015 г.). «Виром двухцепочечной ДНК кожи человека: топографическое и временное разнообразие, генетическое обогащение и динамические ассоциации с микробиомом хозяина» . mBio . 6 (5): e01578-15. DOI : 10,1128 / mBio.01578-15 . PMC 4620475 . PMID 26489866 .
- ^ Минот С., Синха Р., Чен Дж, Ли Х, Кейлбо С.А., Ву Г.Д. и др. (Октябрь 2011 г.). «Виром кишечника человека: индивидуальные вариации и динамический ответ на диету» . Геномные исследования . 21 (10): 1616–25. DOI : 10.1101 / gr.122705.111 . PMC 3202279 . PMID 21880779 .
- ^ Young JC, Chehoud C, Bittinger K, Bailey A, Diamond JM, Cantu E, et al. (Январь 2015 г.). «Вирусная метагеномика выявляет цветение анелловирусов в дыхательных путях реципиентов легкого» . Американский журнал трансплантологии . 15 (1): 200–9. DOI : 10.1111 / ajt.13031 . PMC 4276431 . PMID 25403800 .
- ^ Абелес СР, Роблес-Sikisaka R, Ly М, Lum А.Г., Зальцман Дж, Бем ТК, Pride ДТ (сентябрь 2014). «Вирусы полости рта человека индивидуальны, устойчивы и зависят от пола» . Журнал ISME . 8 (9): 1753–67. DOI : 10.1038 / ismej.2014.31 . PMC 4139723 . PMID 24646696 .
- ↑ Ly M, Abeles SR, Boehm TK, Robles-Sikisaka R, Naidu M, Santiago-Rodriguez T, Pride DT (май 2014 г.). «Измененная вирусная экология полости рта в связи с пародонтозом» . mBio . 5 (3): e01133-14. DOI : 10,1128 / mBio.01133-14 . PMC 4030452 . PMID 24846382 .
- ^ Monaco CL, Gootenberg DB, Zhao G, Handley SA, Ghebremichael MS, Lim ES, et al. (Март 2016 г.). «Измененный виром и бактериальный микробиом при синдроме приобретенного иммунодефицита человека, ассоциированном с вирусом иммунодефицита человека» . Клеточный хозяин и микроб . 19 (3): 311–22. DOI : 10.1016 / j.chom.2016.02.011 . PMC 4821831 . PMID 26962942 .
- ^ Norman JM, Handley SA, Baldridge MT, Droit L, Liu CY, Keller BC, et al. (Январь 2015 г.). «Заболевания-специфические изменения кишечного вирома при воспалительном заболевании кишечника» . Cell . 160 (3): 447–60. DOI : 10.1016 / j.cell.2015.01.002 . PMC 4312520 . PMID 25619688 .
- ^ Грайс Э.А., Конг Х.Х., Конлан С., Деминг CB, Дэвис Дж., Янг А.С. и др. (Программа сравнительного секвенирования NISC) (май 2009 г.). «Топографическое и временное разнообразие микробиома кожи человека» . Наука . 324 (5931): 1190–2. Bibcode : 2009Sci ... 324.1190G . DOI : 10.1126 / science.1171700 . PMC 2805064 . PMID 19478181 .
- ^ а б «Нормальная бактериальная флора человека» . textbookofbacteriology.net .
- ^ Б с д е е г ч я Zhang LS, Davies SS (апрель 2016). «Микробный метаболизм диетических компонентов до биоактивных метаболитов: возможности новых терапевтических вмешательств» . Genome Med . 8 (1): 46. DOI : 10,1186 / s13073-016-0296-х . PMC 4840492 . PMID 27102537 .
Lactobacillus
spp.
превращают триптофан в индол-3-альдегид (I3A) с помощью неидентифицированных ферментов [125].
Clostridium sporogenes
преобразовать триптофан в IPA [6], вероятно, через триптофандезаминазу. ... IPA также эффективно улавливает гидроксильные радикалы
Таблица 2: Микробные метаболиты: их синтез, механизмы действия и влияние на здоровье и болезнь
Рисунок 1: Молекулярные механизмы действия индола и его метаболитов на физиологию и болезнь хозяина - ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Петерс EC, Siuzdak G (март 2009). «Метаболомический анализ показывает большое влияние микрофлоры кишечника на метаболиты крови млекопитающих» . Proc. Natl. Акад. Sci. США . 106 (10): 3698–3703. DOI : 10.1073 / pnas.0812874106 . PMC 2656143 . PMID 19234110 .
Было показано, что производство IPA полностью зависит от присутствия микрофлоры кишечника и может быть установлено путем колонизации бактерией
Clostridium sporogenes
.
Диаграмма метаболизма IPA - ^ «3-Индолепропионовая кислота» . База данных метаболома человека . Университет Альберты . Проверено 12 июня 2018 .
Индол-3-пропионат (IPA), продукт дезаминирования триптофана, образующийся симбиотическими бактериями в желудочно-кишечном тракте млекопитающих и птиц. Было показано, что 3-индолепропионовая кислота предотвращает окислительный стресс и гибель первичных нейронов и клеток нейробластомы, подвергшихся воздействию бета-амилоидного белка в форме амилоидных фибрилл, одного из наиболее заметных нейропатологических признаков болезни Альцгеймера. 3-Индолепропионовая кислота также демонстрирует высокий уровень нейрозащиты в двух других парадигмах окислительного стресса. (
PMID
10419516
) ... Совсем недавно было обнаружено, что более высокие уровни индол-3-пропионовой кислоты в сыворотке / плазме связаны со снижением вероятности диабета 2 типа и с более высоким уровнем потребления продуктов, богатых клетчаткой ( PMID 28397877 ). Происхождение: • Эндогенный • Микробный
- ^ Chyan YJ, Poeggeler В, Омар Р.А., Цепь Д.Г., Frangione В, Ghiso Дж, Pappolla М.А. (июль 1999 г.). «Мощные нейрозащитные свойства против бета-амилоида Альцгеймера за счет эндогенной структуры индола, связанной с мелатонином, индол-3-пропионовой кислоты». J. Biol. Chem . 274 (31): 21937–21942. DOI : 10.1074 / jbc.274.31.21937 . PMID 10419516 .
[Индол-3-пропионовая кислота (IPA)] ранее была обнаружена в плазме и спинномозговой жидкости человека, но ее функции не известны. ... В экспериментах по кинетической конкуренции с использованием агентов, улавливающих свободные радикалы, способность IPA улавливать гидроксильные радикалы превышала способность мелатонина, индоламина, который считается наиболее мощным естественным поглотителем свободных радикалов. В отличие от других антиоксидантов, IPA не превращался в реакционноспособные промежуточные продукты с прооксидантной активностью.
- ^ Ян I, Корвин EJ, Бреннан PA, Джордан S, Мерфи JR, Данлоп A (2016). «Младенческий микробиом: значение для здоровья младенцев и нейрокогнитивного развития» . Медсестринское исследование . 65 (1): 76–88. DOI : 10.1097 / NNR.0000000000000133 . PMC 4681407 . PMID 26657483 .
- ^ Мюллера НТ, Bakacs Е, Combellick J, Григорян Z, Домингес-Белло МГ (февраль 2015 г.). «Развитие микробиома младенца: мама имеет значение» . Тенденции в молекулярной медицине . 21 (2): 109–17. DOI : 10.1016 / j.molmed.2014.12.002 . PMC 4464665 . PMID 25578246 .
- Перейти ↑ Wall R, Ross RP, Ryan CA, Hussey S, Murphy B, Fitzgerald GF, Stanton C (4 марта 2009 г.). «Роль кишечной микробиоты в раннем развитии ребенка» . Клиническая медицина. Педиатрия . 3 : 45–54. DOI : 10,4137 / cmped.s2008 . PMC 3676293 . PMID 23818794 .
- ^ a b c Кларк Дж., Стиллинг Р. М., Кеннеди П. Дж., Стэнтон С., Крайан Дж. Ф., Динан Т. Г. (август 2014 г.). «Мини-обзор: Кишечная микробиота: запущенный эндокринный орган» . Молекулярная эндокринология . 28 (8): 1221–38. DOI : 10.1210 / me.2014-1108 . PMC 5414803 . PMID 24892638 .
- ^ а б Шен С., Вонг СН (апрель 2016 г.). «Педагогическое воспаление: роль микробиоты кишечника» . Клиническая и трансляционная иммунология . 5 (4): e72. DOI : 10.1038 / cti.2016.12 . PMC 4855262 . PMID 27195115 .
- Перейти ↑ Wang H, Lee IS, Braun C, Enck P (октябрь 2016 г.). «Влияние пробиотиков на функции центральной нервной системы у животных и людей: систематический обзор» . Журнал нейрогастроэнтерологии и моторики . 22 (4): 589–605. DOI : 10,5056 / jnm16018 . PMC 5056568 . PMID 27413138 .
Эти пробиотики показали эффективность в улучшении поведения, связанного с психическими расстройствами, включая тревогу, депрессию, расстройство аутистического спектра (РАС), обсессивно-компульсивное расстройство и способности памяти, включая пространственную и непространственную память. Поскольку многие фундаментальные научные исследования показали некоторую эффективность пробиотиков на функцию центральной нервной системы, эта информация может служить ориентиром и способствовать дальнейшим доклиническим и клиническим исследованиям. ... Согласно качественному анализу текущих исследований, мы можем предварительно сделать вывод, что B. longum, B. breve, B. infantis, L. helveticus, L. rhamnosus, L. plantarum и L. casei оказались наиболее эффективными. в улучшении функции ЦНС, включая функции, связанные с психическими заболеваниями (тревога, депрессия, настроение, реакция на стресс) и способности памяти
- ^ Musso G, Гамбино R, Cassader M (октябрь 2010). «Ожирение, диабет и микробиота кишечника: расширена ли гигиеническая гипотеза?» . Уход за диабетом . 33 (10): 2277–84. DOI : 10.2337 / dc10-0556 . PMC 2945175 . PMID 20876708 .
- ^ Харш И.А., Контурек PC (апрель 2018). «Роль кишечной микробиоты в ожирении и сахарном диабете 2 и 1 типа: новый взгляд на« старые »болезни» . Медицинские науки . 6 (2): 32. DOI : 10,3390 / medsci6020032 . PMC 6024804 . PMID 29673211 .
- ^ Turnbaugh PJ, Bäckhed F, Fulton L, Гордон JI (апрель 2008). «Ожирение, вызванное диетой, связано с заметными, но обратимыми изменениями в микробиоме дистального отдела кишечника мышей» . Клеточный хозяин и микроб . 3 (4): 213–23. DOI : 10.1016 / j.chom.2008.02.015 . PMC 3687783 . PMID 18407065 .
- ^ Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau AL, et al. (Сентябрь 2013). «Микробиота кишечника близнецов, не согласных с ожирением, модулирует метаболизм у мышей» . Наука . 341 (6150): 1241214. DOI : 10.1126 / science.1241214 . PMC 3829625 . PMID 24009397 .
- ^ a b Дрейк MJ, Моррис N, Apostolidis A, Rahnama'i MS, Marchesi JR (апрель 2017 г.). «Микробиом мочи и его вклад в симптомы нижних мочевыводящих путей; ICI-RS 2015» . Невроурология и уродинамика . 36 (4): 850–853. DOI : 10.1002 / nau.23006 . HDL : 1983 / 3b024f95-9f86-406a-9be3-ce35984b8de1 . PMID 28444712 . S2CID 27636043 .
- ^ а б Арагон И.М., Эррера-Имброда Б., Кейпо-Ортуньо М.И., Кастильо Э., Дель Морал Дж. С., Гомес-Миллан Дж. и др. (Январь 2018). «Микробиом мочевыводящих путей в здоровье и болезнях». Европейский фокус урологии . 4 (1): 128–138. DOI : 10.1016 / j.euf.2016.11.001 . PMID 28753805 .
- ^ a b Schmiemann G, Kniehl E, Gebhardt K, Matejczyk MM, Hummers-Pradier E (май 2010 г.). «Диагностика инфекции мочевыводящих путей: систематический обзор» . Deutsches Ärzteblatt International . 107 (21): 361–7. DOI : 10,3238 / arztebl.2010.0361 . PMC 2883276 . PMID 20539810 .
- ^ Wolfe AJ, Brubaker L (февраль 2019). «Обновления уробиома: достижения в исследовании микробиома мочи» . Обзоры природы. Урология . 16 (2): 73–74. DOI : 10.1038 / s41585-018-0127-5 . PMC 6628711 . PMID 30510275 .
- ^ a b Петрова М.И., Ливенс Э, Малик С., Имхольц Н., Лебеер С. (2015). «Виды Lactobacillus как биомаркеры и агенты, которые могут способствовать различным аспектам здоровья влагалища» . Границы физиологии . 6 : 81. DOI : 10,3389 / fphys.2015.00081 . PMC 4373506 . PMID 25859220 .
- ^ a b c d Виткин SS, Linhares IM, Giraldo P (июнь 2007 г.). «Бактериальная флора женских половых путей: функции и иммунная регуляция». Лучшие практики и исследования. Клиническое акушерство и гинекология . 21 (3): 347–54. DOI : 10.1016 / j.bpobgyn.2006.12.004 . PMID 17215167 .
- ^ Тодора K (2012). «Нормальная бактериальная флора человека» . Интернет-учебник по бактериологии Тодара . Мэдисон, Висконсин: Кеннет Тодар . Проверено 6 апреля 2012 года .
- ^ Ондердонк AB, Zamarchi GR, Уолш JA, Меллор RD, Муньос A, Кассы EH (февраль 1986). «Методы количественной и качественной оценки микрофлоры влагалища во время менструации» . Прикладная и экологическая микробиология . 51 (2): 333–9. DOI : 10,1128 / AEM.51.2.333-339.1986 . PMC 238869 . PMID 3954346 .
- Перейти ↑ Antonio MA, Hawes SE, Hillier SL (декабрь 1999 г.). «Идентификация видов вагинальных Lactobacillus и демографические и микробиологические характеристики женщин, колонизированных этими видами» . Журнал инфекционных болезней . 180 (6): 1950–6. DOI : 10.1086 / 315109 . PMID 10558952 .
- ^ Усик М., Зольник CP, Castle PE, Porras C, Herrero R, Gradissimo A и др. (Март 2020 г.). «Цервиковагинальный микробиом и естественная история ВПЧ в продольном исследовании» . PLOS Патогены . 16 (3): e1008376. DOI : 10.1371 / journal.ppat.1008376 . PMC 7098574 . PMID 32214382 .
- ^ Fox C, Eichelberger K (декабрь 2015). «Материнский микробиом и исходы беременности» . Фертильность и бесплодие . 104 (6): 1358–63. DOI : 10.1016 / j.fertnstert.2015.09.037 . PMID 26493119 .
- Перейти ↑ Wassenaar TM, Panigrahi P (декабрь 2014 г.). «Плод развивается в стерильной среде?» . Письма по прикладной микробиологии . 59 (6): 572–9. DOI : 10.1111 / lam.12334 . PMID 25273890 . S2CID 206169539 .
- ^ Schwiertz A (2016). Микробиота человеческого тела: последствия для здоровья и болезней . Швейцария: Шпрингер. п. 1. ISBN 978-3-319-31248-4.
- ^ Franasiak JM, Скотт RT (декабрь 2015). «Микробиом репродуктивного тракта в вспомогательных репродуктивных технологиях» . Фертильность и бесплодие . 104 (6): 1364–71. DOI : 10.1016 / j.fertnstert.2015.10.012 . PMID 26597628 .
- Перейти ↑ Sutter VL (1984). «Анаэробы как нормальная флора полости рта». Обзоры инфекционных болезней . 6 (Дополнение 1): S62-566. DOI : 10,1093 / clinids / 6.Supplement_1.S62 . PMID 6372039 .
- ^ а б в г д Кумар PS (декабрь 2013 г.). «Микробиота полости рта и системные заболевания». Анаэроб . 24 : 90–3. DOI : 10.1016 / j.anaerobe.2013.09.010 . PMID 24128801 .
- ^ Arweiler NB, Netuschil L (май 2016). «Микробиота полости рта». В Schwiertz A (ред.). Микробиота человеческого тела: последствия для здоровья и болезней . Успехи экспериментальной медицины и биологии . 902 . Спрингер, Чам. С. 45–60. DOI : 10.1007 / 978-3-319-31248-4_4 . ISBN 978-3-319-31248-4. PMID 27161350 .
- ^ a b c d Avila M, Ojcius DM, Yilmaz O (август 2009 г.). «Микробиота полости рта: жизнь с постоянным гостем» . ДНК и клеточная биология . 28 (8): 405–11. DOI : 10.1089 / dna.2009.0874 . PMC 2768665 . PMID 19485767 .
- ^ a b Роджерс А.Х., изд. (2008). Молекулярная микробиология полости рта . Caister Academic Press. ISBN 978-1-904455-24-0.
- ^ а б в г д Зарко М.Ф., Весс Т.Дж., Гинзбург Г.С. (март 2012 г.). «Микробиом полости рта в здоровье и болезнях и потенциальное влияние на персонализированную стоматологическую медицину» . Заболевания полости рта . 18 (2): 109–20. DOI : 10.1111 / j.1601-0825.2011.01851.x . PMID 21902769 . S2CID 24411104 .
- ^ Человек WH, де Steenhuijsen Питерс WA, Bogaert D (май 2017). «Микробиота дыхательных путей: привратник для здоровья органов дыхания» . Обзоры природы. Микробиология . 15 (5): 259–270. DOI : 10.1038 / nrmicro.2017.14 . ЛВП : 20.500.11820 / f1137874-9c51-401b-bca4-e2a5da3e219b . PMC 7097736 . PMID 28316330 .
- ^ a b Берингер PM, Appleman MD (ноябрь 2000 г.). «Необычная респираторная бактериальная флора при муковисцидозе: микробиологические и клинические особенности» (PDF) . Современные взгляды на легочную медицину . 6 (6): 545–50. DOI : 10.1097 / 00063198-200011000-00015 . PMID 11100967 . S2CID 845977 . Архивировано из оригинального (PDF) 16 октября 2013 года.
- ^ Вердье Дж, Luedde Т, Sellge G (июнь 2015). «Барьер слизистой оболочки желчных путей и микробиом» . Висзералмедизин . 31 (3): 156–61. DOI : 10.1159 / 000431071 . PMC 4569210 . PMID 26468308 .
- ^ Комментарий: Совмещение гигиены и чистоты: новый взгляд на микробиом человека
- ^ Copeland CS. Мир внутри нас: здоровье и микробиом человека. Журнал здравоохранения Нового Орлеана, сентябрь-октябрь 2017 г.
- ↑ Honda K, Littman DR (июль 2016 г.). «Микробиота в адаптивном иммунном гомеостазе и болезни». Природа . 535 (7610): 75–84. Bibcode : 2016Natur.535 ... 75H . DOI : 10.1038 / nature18848 . PMID 27383982 . S2CID 4461492 .
- ^ Liubakka A, Vaughn BP (июль 2016). «Инфекция Clostridium difficile и трансплантация фекальной микробиоты» . AACN Advanced Critical Care . 27 (3): 324–337. DOI : 10.4037 / aacnacc2016703 . PMC 5666691 . PMID 27959316 .
- ^ Burton JH, Джонсон М., Джонсон J, Ся DS, Гринуэй FL, Хейман ML (июль 2015). «Добавление модулятора желудочно-кишечного микробиома к метформину улучшает переносимость метформина и уровни глюкозы натощак» . Журнал диабетической науки и технологий . 9 (4): 808–14. DOI : 10.1177 / 1932296815577425 . PMC 4525649 . PMID 25802471 .
- ^ Баккен Дж.С., Бороды Т., Брандт Л.Дж., Брилл СП, Демарко, округ Колумбия, Францос М.А. и др. (Декабрь 2011 г.). «Лечение инфекции Clostridium difficile с помощью трансплантации фекальной микробиоты» . Клиническая гастроэнтерология и гепатология . 9 (12): 1044–9. DOI : 10.1016 / j.cgh.2011.08.014 . PMC 3223289 . PMID 21871249 .
- ^ a b Gough E, Shaikh H, Manges AR (ноябрь 2011 г.). «Систематический обзор трансплантации кишечной микробиоты (фекальная бактериотерапия) при рецидивирующей инфекции Clostridium difficile» . Клинические инфекционные болезни . 53 (10): 994–1002. DOI : 10,1093 / CID / cir632 . PMID 22002980 .
- ^ Браун WR (август 2014 г.). «Трансплантация фекальной микробиоты при лечении инфекции Clostridium difficile». Журнал болезней органов пищеварения . 15 (8): 405–8. DOI : 10.1111 / 1751-2980.12160 . PMID 24825534 . S2CID 44651256 .
- ^ Б с д е е г ч Гаррета WS (апрель 2015). «Рак и микробиота» . Наука . 348 (6230): 80–6. Bibcode : 2015Sci ... 348 ... 80G . DOI : 10.1126 / science.aaa4972 . PMC 5535753 . PMID 25838377 .
- ^ a b c d Gagnière J, Raisch J, Veziant J, Barnich N, Bonnet R, Buc E, et al. (Январь 2016 г.). «Нарушение баланса кишечной микробиоты и колоректальный рак» . Всемирный журнал гастроэнтерологии . 22 (2): 501–18. DOI : 10,3748 / wjg.v22.i2.501 . PMC 4716055 . PMID 26811603 .
- ^ a b Sartor RB, Mazmanian SK (июль 2012 г.). «Кишечные микробы при воспалительных заболеваниях кишечника». Американский журнал гастроэнтерологических добавок . 1 (1): 15–21. DOI : 10.1038 / ajgsup.2012.4 .
- ↑ Hold GL, Smith M, Grange C, Watt ER, El-Omar EM, Mukhopadhya I (февраль 2014 г.). «Роль микробиоты кишечника в патогенезе воспалительных заболеваний кишечника: что мы узнали за последние 10 лет?» . Всемирный журнал гастроэнтерологии . 20 (5): 1192–210. DOI : 10,3748 / wjg.v20.i5.1192 . PMC 3921503 . PMID 24574795 .
- ^ a b Зильберман-Шапира G, Zmora N, Itav S, Bashiardes S, Elinav H, Elinav E (июнь 2016 г.). «Микробиом кишечника при вирусной инфекции иммунодефицита человека» . BMC Medicine . 14 (1): 83. DOI : 10,1186 / s12916-016-0625-3 . PMC 4891875 . PMID 27256449 .
- ^ Петрова М.И., ван ден Брук М., Бальзарини Дж, Вандерлейден Дж, Лебеер S (сентябрь 2013 г.). «Микробиота влагалища и ее роль в передаче ВИЧ и инфицировании» . FEMS Microbiology Reviews . 37 (5): 762–92. DOI : 10.1111 / 1574-6976.12029 . PMID 23789590 .
- ^ Intagliata C (22 декабря 2016). " " Некробиом "показывает время смерти трупа" . Scientific American . Проверено 26 марта 2018 .
- ↑ Young E (10 декабря 2015 г.). «Познакомьтесь с некробиомом: волны микробов, которые съедят ваш труп» . Атлантика . Проверено 26 марта 2018 .
- ↑ Harmon K (16 декабря 2009 г.). «Ошибки внутри: что происходит, когда исчезают микробы, поддерживающие наше здоровье?» . Scientific American . Проверено 27 декабря 2008 года .
- ^ а б Ваней П., Джонсон А.Дж., Уорд Т.Л., Аль-Галит Г.А., Шилдс-Катлер Р.Р., Хиллманн Б.М. и др. (Ноябрь 2018 г.). «Иммиграция в США вестернизирует микробиом кишечника человека» (PDF) . Cell . 175 (4): 962–972.e10. DOI : 10.1016 / j.cell.2018.10.029 . PMC 6498444 . PMID 30388453 .
- ^ а б Каплан Р.К., Ван З., Усик М., Сотрес-Альварес Д., Давиглус М.Л., Шнайдерман Н. и др. (Ноябрь 2019 г.). «Состав кишечного микробиома в исследовании здоровья латиноамериканского сообщества / исследовании латиноамериканцев определяется географическим перемещением, факторами окружающей среды и ожирением» . Геномная биология . 20 (1): 219. DOI : 10.1186 / s13059-019-1831-z . PMC 6824043 . PMID 31672155 .
Внешние ссылки [ править ]
- Выставка " Тайный мир внутри вас", 2015–2016 гг., Американский музей естественной истории
- Часто задаваемые вопросы: Микробиом человека, январь 2014 г. Американское общество микробиологов