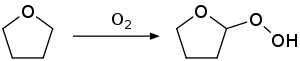Гидропероксиды или пероксоли представляют собой соединения, содержащие функциональную гидропероксидную группу (ROOH). Если R является органическим, соединения называются органическими гидропероксидами . Такие соединения представляют собой подмножество органических пероксидов , которые имеют формулу ROOR. Органические гидропероксиды могут намеренно или непреднамеренно инициировать взрывную полимеризацию в материалах с ненасыщенными химическими связями . [1]
Свойства [ править ]
О-О длине связи в перекисях составляет около 1,45 Å , и Р-О-О углах (R = Н, С) около 110 ° (вода-подобные). Характерно, что двугранные углы C − O − O − H составляют около 120 °. Связь O-O относительно слабая, с энергией диссоциации связи 45-50 ккал / моль (190-210 кДж / моль), что составляет менее половины прочности связей C-C, C-H и C-O. [2] [3]
Использование и реакции [ править ]
Гидропероксиды могут быть восстановлены до спиртов с помощью алюмогидрида лития , как описано в этом идеализированном уравнении:
- 4 ROOH + LiAlH 4 → LiAlO 2 + 2 H 2 O + 4 ROH
Эта реакция лежит в основе методов анализа органических пероксидов. [4] Еще один способ оценки содержания перкислот и пероксидов - это объемное титрование с помощью алкоксидов, таких как этоксид натрия . [5] В сложных эфиров фосфористой кислоты и третичные фосфины также снижение эффекта:
- ROOH + PR 3 → OPR 3 + ROH
Гидроперекиси являются промежуточными продуктами при производстве многих органических соединений в промышленности. Например, катализируемое кобальтом окисление циклогексана до циклогексанона : [6]
- С 6 Н 12 + О 2 → (СН 2 ) 5 СО + Н 2 О
Ацетон и фенол производятся с помощью так называемого кумольного процесса , который протекает через гидропероксид кумола .
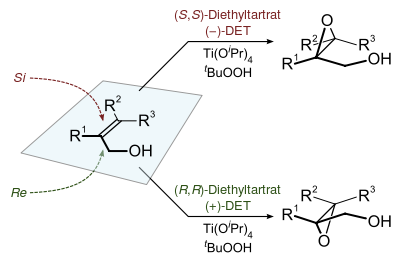
Многие эпоксиды получают с использованием гидропероксидов в качестве реагентов, таких как процесс Halcon для производства оксида пропилена . Эпоксидирования Шарплесс является связанной реакцию проводили на лабораторных масштабах. трет-Бутилгидропероксид (ТБГП) представляет собой органически растворимый окислитель, используемый в этих операциях. [7]
Осушающие масла , входящие в состав многих красок и лаков, действуют посредством образования гидропероксидов.
Формирование [ править ]
Гидропероксиды эфира [ править ]
Авто-окисления реакция наблюдается с общими простые эфиры , такие как диэтиловый эфир , диизопропиловый эфир , тетрагидрофуран и 1,4-диоксан . Иллюстративным продуктом является пероксид диэтилового эфира . Такие соединения могут привести к серьезному взрыву при перегонке. [8] Чтобы свести к минимуму эту проблему, коммерческие образцы ТГФ часто ингибируют бутилированным гидрокситолуолом (ВНТ). Отгонки ТГФ досуха избегают, поскольку взрывоопасные пероксиды концентрируются в остатке.
Хотя гидропероксид эфира часто образуется случайно (например, при автоокислении), они могут быть получены с высоким выходом путем кислотно-катализируемого добавления пероксида водорода к виниловым эфирам: [9]
- C 2 H 5 OCH = CH 2 + H 2 O 2 → C 2 H 5 OCH (OOH) CH 3
Гидропероксиды природного происхождения [ править ]
Многие гидропероксиды получают из жирных кислот, стероидов и терпенов. Биосинтез этих видов в значительной степени осуществляется ферментами.
Скакательные отростки [ править ]
Соединения с аллильными и бензильными связями C − H особенно чувствительны к оксигенации. [11] Такая реакционная способность используется в промышленных масштабах в очень больших масштабах для производства фенола с помощью процесса Кумола или процесса Хока для его кумола и промежуточных продуктов гидропероксида кумола . [12] Такие реакции основаны на радикальных инициаторах, которые реагируют с кислородом с образованием промежуточного соединения, которое отрывает атом водорода от слабой связи CH. Образовавшийся радикал связывает O 2 с образованием гидропероксила (ROO . ), Который затем продолжает цикл отрыва H-атома. [8]
Ссылки [ править ]
- ^ Кленк, Герберт; Götz, Peter H .; Зигмайер, Райнер; Майр, Вильфрид. «Пероксисоединения, органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH.
- ^ Бах, Роберт Д .; Ayala, Philippe Y .; Шлегель, HB (1996). "Переоценка энергии диссоциации связи пероксидов. Исследование ab Initio ". Варенье. Chem. Soc. 118 (50): 12758–12765. DOI : 10.1021 / ja961838i .
- ↑ Отто Экснер (1983). «Стереохимические и конформационные аспекты пероксисоединений». В Сауле Патаи (ред.). ПАТАИ Химия функциональных групп . Вайли. С. 85–96. DOI : 10.1002 / 9780470771730.ch2 . ISBN 9780470771730.
- ^ Хигучи, Т .; Цук, Дональд Антон (1951). «Поведение нескольких соединений как индикаторов при титровании литийалюминийгидридом функциональных групп». Журнал Американского химического общества . 73 (6): 2676. DOI : 10.1021 / ja01150a073 .
- ^ Мартин, AJ (1957). «Потенциометрическое титрование гидропероксида и перкислоты в безводном этилендиамине». Аналитическая химия . 29 : 79–81. DOI : 10.1021 / ac60121a022 .
- ^ Майкл Т. Массер (2005). «Циклогексанол и циклогексанон». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a08_217 .CS1 maint: использует параметр авторов ( ссылка )
- ^ Хилл, JG; Шарплесс, КБ ; Exon, CM; Регенье, Р. (1985). «Энантиоселективное эпоксидирование аллиловых спиртов: (2s, 3s) -3-пропилоксиранметанол». Орг. Synth. 63 : 66. DOI : 10,15227 / orgsyn.063.0066 . CS1 maint: использует параметр авторов ( ссылка )
- ^ a b Heinz GO Becker Organikum , Wiley-VCH, 2001, ISBN 3-527-29985-8 стр. 206–207
- ^ Милас, Николай А .; Peeler, Роберт Л .; Магели, Орвилл Л. (1954). «Органические пероксиды. XIX. Α-Гидропероксиэфиры и родственные пероксиды». Журнал Американского химического общества . 76 (9): 2322–2325. DOI : 10.1021 / ja01638a012 .
- Перейти ↑ Matsui K (2006). «Летучие вещества зеленых листьев: гидропероксидлиазный путь метаболизма оксилипина». Текущее мнение в биологии растений . 9 (3): 274–80. DOI : 10.1016 / j.pbi.2006.03.002 . PMID 16595187 .
- ^ Рыцарь, HB; Сверн, Дэниел (1954). «Гидроперекись тетралина». Орг. Synth . 34 : 90. DOI : 10,15227 / orgsyn.034.0090 ..
- ↑ Brückner, R. Reaktionsmechanismen: organische Reaktionen, Stereochemie, moderne Synthesemethoden , стр. 41–42, Spektrum Akademischer Verlag, Мюнхен, 2004, ISBN 3-8274-1579-9 (на немецком языке)