 | |
 | |
| Имена | |
|---|---|
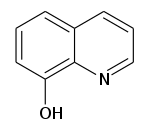
| Предпочтительное название IUPAC Хинолин-8-ол | |
| Другие названия 1-азанафталин-8-ол, феннозан H 30, гидроксибензопиридин, оксибензопиридин, оксихинолин, оксихинолин, фенопиридин, хинофенол, оксин, 8-хинолинол | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.005.193 |
| КЕГГ | |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 9 H 7 НЕТ | |
| Молярная масса | 145,16 г / моль |
| Появление | Белые кристаллические иглы |
| Плотность | 1,034 г / см 3 |
| Температура плавления | 76 ° С (169 ° F, 349 К) |
| Точка кипения | 276 ° С (529 ° F, 549 К) |
| Фармакология | |
| G01AC30 ( ВОЗ ) A01AB07 ( ВОЗ ) D08AH03 ( ВОЗ ) R02AA14 ( ВОЗ ) | |
| Опасности | |
| Основные опасности | легковоспламеняющийся |
| Паспорт безопасности | Внешний паспорт безопасности материала |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
8-гидроксихинолин (также известный как оксин ) представляет собой хелатирующий агент, который используется для количественного определения ионов металлов.
В водном растворе 8-гидроксихинолин имеет значение pK a ок. 9.9 [1] Он реагирует с ионами металлов, теряя протон и образуя 8-hydroxyquinolinato- хелатные комплексы.
Алюминиевый комплекс [2] является обычным компонентом органических светодиодов (OLED). Вариации заместителей на хинолиновых кольцах влияют на его люминесцентные свойства. [3]
В фотохимически индуцированном возбужденном состоянии образуются цвиттерионные изомеры, в которых атом водорода переносится от кислорода к азоту. [4]
Комплексы, а также сам гетероцикл проявляют антисептические , дезинфицирующие и пестицидные свойства [5] [6], действуя как ингибитор транскрипции . [7] Его раствор в спирте используется в жидких повязках . Когда-то он был интересен как противораковое средство. [8]
Также известен аналог тиола, 8-меркаптохинолин . [9]
Корни инвазивного растения Centaurea diffusa выделяют 8-гидроксихинолин , который отрицательно влияет на растения, которые не эволюционировали вместе с ним. [10]
См. Также [ править ]
- Клиохинол , противогрибковый и противопротозойный препарат.
- PBT2
- Ионофор
Ссылки [ править ]
- ^ Альберт, А .; Филлипс, Дж. Н. (1956). «264. Константы ионизации гетероциклических веществ. Часть II. Гидроксипроизводные азотистых шестичленных кольцевых соединений». Журнал химического общества (возобновлено) . 1956 : 1294–1304. DOI : 10.1039 / JR9560001294 .
- ^ Катакура, Р .; Койде, Ю. (2006). «Конфигурационно-специфический синтез лицевых и меридиональных изомеров трис (8-гидроксихинолината) алюминия (Alq 3 )». Неорганическая химия . 45 (15): 5730–5732. DOI : 10.1021 / ic060594s . PMID 16841973 .
- ^ Монтес, Вирджиния; Pohl, R .; Шинар, Дж .; Анценбахер, П. младший (2006). «Эффективное управление электронными эффектами и его влияние на выделение 5-замещенных трис (8-хинолинолат) комплексов алюминия (III)». Химия: Европейский журнал . 12 (17): 4523–4535. DOI : 10.1002 / chem.200501403 . PMID 16619313 .
- ^ Bardez, E .; Devol, I .; Larrey, B .; Валер Б. (1997). «Процессы возбужденного состояния в 8-гидроксихинолине: фотоиндуцированные эффекты таутомеризации и сольватации». Журнал физической химии B . 101 (39): 7786–7793. DOI : 10.1021 / jp971293u .
- Перейти ↑ Phillips, JP (1956). «Реакции 8-хинолинола». Химические обзоры . 56 (2): 271–297. DOI : 10.1021 / cr50008a003 .
- ^ «8-гидроксихинолин» . Медицинский словарь онлайн. Архивировано из оригинала на 2016-10-09 . Проверено 9 марта 2016 .
- ^ «8-гидроксихинолин» . Сигма-Олдрич . Проверено 23 мая 2012 .
- ^ Шен, AY; Wu, SN; Чиу, CT (1999). «Синтез и оценка цитотоксичности некоторых производных 8-гидроксихинолина». Журнал фармации и фармакологии . 51 (5): 543–548. DOI : 10.1211 / 0022357991772826 . PMID 10411213 .
- ^ Флейшер, Хольгер "Структурная химия комплексов (n - 1) d 10 ns m ионов металлов с β-N-донорными замещенными тиолатными лигандами (m = 0, 2)" Coordination Chemistry Reviews 2005, том 249, стр. 799- 827. DOI : 10.1016 / j.ccr.2004.08.024
- ^ Виванко, JM; Байс, HP; Стермитц, Франция; Thelen, GC; Каллавей, RM (2004). «Биогеографические изменения в реакции сообщества на корневую аллелохимию: новое оружие и экзотическое вторжение». Письма об экологии . 7 (4): 285–292. DOI : 10.1111 / j.1461-0248.2004.00576.x .
- ^ Cölle, M .; Dinnebier, RE; Брюттинг, В. (2002). «Структура голубой люминесцентной δ-фазы трис (8-гидроксихинолин) алюминия (III) (Alq 3 )». Химические коммуникации . 2002 (23): 2908–9. DOI : 10.1039 / b209164j . PMID 12478807 .