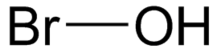 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК гипобромистая кислота, бромная (I) кислота, броманол, гидроксидобромин | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.119.006 |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| HOBr | |
| Молярная масса | 96,911 |
| Плотность | 2,470 г / см 3 |
| Точка кипения | 20-25 ° С (68-77 ° F, 293-298 К) |
| Кислотность (p K a ) | 8,65 |
| Основание конъюгата | Гипобромит |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Бромистоводородная кислота - слабая, нестабильная кислота с химической формулой HOBr. В основном он производится и обрабатывается в водном растворе. Он производится как биологически, так и коммерчески в качестве дезинфицирующего средства. Соли гипобромита редко выделяются в твердом виде.
Синтез и свойства [ править ]
Добавление брома к воде дает бромистоводородную кислоту и бромистоводородную кислоту (HBr) в результате реакции диспропорционирования .
- Br 2 + H 2 O HOBr + HBr
В природе бромистоводородная кислота вырабатывается бромпероксидазами , которые являются ферментами, катализирующими окисление бромида перекисью водорода: [1]
- Br - + H 2 O 2 HOBr + OH -
Гипобромистая кислота имеет ap K a 8,65 и поэтому лишь частично диссоциирует в воде при pH 7. Как и кислота, соли гипобромита нестабильны и подвергаются медленной реакции диспропорционирования с образованием соответствующих солей бромата и бромида.
- 3 BrO - (водн.) → 2 Br - (водн.) + BrO-
3(водн.)
Его химические и физические свойства аналогичны свойствам других гипогалитов .
Использует [ редактировать ]
HOBr используется как отбеливатель , окислитель , дезодорант и дезинфицирующее средство из-за его способности убивать клетки многих патогенов . Соединение вырабатывается в организмах теплокровных позвоночных, особенно эозинофилами , которые продуцируют его под действием пероксидазы эозинофилов , фермента, который преимущественно использует бромид. [2] Бромид также используется в горячих ваннах и спа в качестве бактерицидного агента, используя действие окислителя для образования гипобромита аналогично пероксидазе в эозинофилах. Он особенно эффективен в сочетании с родственным ему хлорноватистой кислотой..
Ссылки [ править ]
- ^ Батлер, Элисон .; Уокер, СП (1993). «Морские галопероксидазы». Химические обзоры . 93 (5): 1937–1944. DOI : 10.1021 / cr00021a014 .
- ^ Майено, АН; Курран, AJ; Робертс, Р.Л .; Фут, CS (1989). «Эозинофилы предпочтительно используют бромид для создания галогенирующих агентов» . Журнал биологической химии . 264 (10): 5660–8. PMID 2538427 . Проверено 12 января 2008 .
