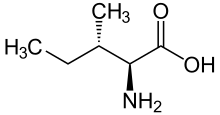
 скелетная формула из L -isoleucine | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Изолейцин | |||
| Другие имена (2 S , 3 S ) -2-амино-3-метилпентановая кислота | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.726 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| C 6 H 13 N O 2 | |||
| Молярная масса | 131,175 г · моль -1 | ||
| -84,9 · 10 -6 см 3 / моль | |||
| Страница дополнительных данных | |||
| Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | |||
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ , ИК , ЯМР , МС | |||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Изолейцин (символ Иле или я ) [1] представляет собой α-аминокислоты , который используется в биосинтезе из белков . Он содержит α-аминогруппу (которая находится в протонированной -NH+
3образуют в биологических условиях), в кислотную группу альфа-карбоновой кислоты (которая в депротонированной -COO - вид в биологических условиях) и углеводородную боковую цепь с ветви (центральный углерода атом , связанный с тремя другими атомами углерода). Он классифицируется как неполярная незаряженная (при физиологическом pH) алифатическая аминокислота с разветвленной цепью . Он необходим для человека, то есть организм не может его синтезировать, и его необходимо принимать с пищей. Изолейцин синтезируется из пирувата с использованием ферментов биосинтеза лейцина в других организмах, таких как бактерии. [2] Это кодируется самымкодоны AUU, AUC и AUA.
Неспособность расщеплять изолейцин, наряду с другими аминокислотами, связана с болезнью мочи кленового сиропа . [3]
Метаболизм [ править ]
Биосинтез [ править ]
Как важное питательное вещество, он не синтезируется в организме, поэтому его необходимо принимать внутрь, обычно как компонент белков. В растениях и микроорганизмах он синтезируется в несколько этапов, начиная с пирувата и альфа-кетобутирата . Ферменты, участвующие в этом биосинтезе, включают: [4]
- Ацетолактатсинтаза (также известная как синтаза ацетогидроксикислоты)
- Изомероредуктаза ацетогидроксикислоты
- Дигидроксикислот дегидратаза
- Валинаминотрансфераза
Катаболизм [ править ]
Изолейцин является одновременно глюкогенной и кетогенной аминокислотой. После трансаминирования альфа-кетоглутаратом углеродный скелет окисляется и расщепляется на пропионил-КоА и ацетил-КоА . Пропионил-КоА превращается в сукцинил-КоА , промежуточный продукт цикла ТСА, который может быть преобразован в оксалоацетат для глюконеогенеза (следовательно, глюкогенный). У млекопитающих ацетил-КоА не может быть преобразован в углевод, но может быть либо введен в цикл TCA путем конденсации с оксалоацетатом с образованием цитрата, либо использован в синтезе кетоновых тел (следовательно, кетогенных) или жирных кислот .[5]
Инсулинорезистентность [ править ]
Изолейцин, как и другие аминокислоты с разветвленной цепью , связан с инсулинорезистентностью: более высокие уровни изолейцина наблюдаются в крови диабетических мышей, крыс и людей. [6] У мышей, получавших диету с депривацией изолейцина в течение одного дня, улучшилась чувствительность к инсулину, а кормление диетой с депривацией изолейцина в течение одной недели значительно снижает уровень глюкозы в крови. [7] У мышей с ожирением и инсулинорезистентностью, вызванных диетой, диета с пониженным уровнем изолейцина и других аминокислот с разветвленной цепью приводит к снижению ожирения и повышению чувствительности к инсулину. [8] У людей диета с ограничением белка снижает уровень изолейцина в крови и снижает уровень глюкозы в крови натощак. [9]
Требования [ править ]
Совет по пищевым продуктам и питанию (FNB) Института медицины США установил рекомендуемые диетические нормы (RDA) для незаменимых аминокислот в 2002 году. Для изолейцина для взрослых от 19 лет и старше - 19 мг / кг массы тела / день. [10]
Источники питания [ править ]
Хотя эта аминокислота не вырабатывается животными, она хранится в больших количествах. Продукты, содержащие большое количество изолейцина, включают яйца, соевый белок, морские водоросли, индейку, курицу, баранину, сыр и рыбу. [11]
Изомеры [ править ]
| Формы изолейцина | |||||||
|---|---|---|---|---|---|---|---|
| Общее название : | изолейцин | d- изолейцин | l- изолейцин | dl -изолейцин | d -аллоизолейцин | l -аллоизолейцин | dl -аллоизолейцин |
| Синонимы : | ( R ) -изолейцин | L (+) - Изолейцин | ( R *, R *) - изолейцин | аллоизолейцин | |||
| PubChem : | CID 791 от PubChem | CID 94206 от PubChem | CID 6306 от PubChem | CID 76551 от PubChem | |||
| Номер EINECS : | |||||||
| Номер CAS : | 443-79-8 | 319-78-8 | 73-32-5 | 1509-35-9 | 1509-34-8 | 3107-04-8 | |
| |
| 1- изолейцин (2 S , 3 S ) и d- изолейцин (2 R , 3 R ) |
| |
| l- аллоизолейцин (2 S , 3 R ) и d -аллоизолейцин (2 R , 3 S ) |
Синтез [ править ]
Изолейцин можно синтезировать многоступенчатым способом, исходя из 2-бромбутана и диэтилмалоната . [12] Синтетический изолейцин был впервые описан в 1905 году французским химиком Луи Буво . [13]
Немецкий химик Феликс Эрлих открыл изолейцин в гемоглобине в 1903 году.
Ссылки [ править ]
- ^ «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 5 марта 2018 .
- ^ Kisumi M, Комацубара S, Chibata I (июль 1977). «Путь образования изолейцина из пирувата с помощью ферментов биосинтеза лейцина в лейцин-накапливающих ревертантах изолейцина Serratia marcescens» . Журнал биохимии . 82 (1): 95–103. DOI : 10.1093 / oxfordjournals.jbchem.a131698 . PMID 142769 .
- ^ "Болезнь мочи кленового сиропа (MSUD)" . learn.genetics.utah.edu . Архивировано из оригинала на 2015-12-10 . Проверено 8 декабря 2015 .
- ^ Нельсон Д.Л., Кокс М. (2000). Ленингер, Принципы биохимии (3-е изд.). Нью-Йорк: стоит публикации. ISBN 1-57259-153-6.
- ↑ Cole JT (14 ноября 2014 г.). «Глава 2: Метаболизм BCAA» (PDF) . В Rajendram R, Preedy VR, Patel VB (ред.). Аминокислоты с разветвленной цепью в клиническом питании . 1 . ISBN 978-1-4939-1923-9.
- ^ Линч CJ, Адамс SH (декабрь 2014 г.). «Аминокислоты с разветвленной цепью в метаболической передаче сигналов и резистентности к инсулину» . Обзоры природы. Эндокринология . 10 (12): 723–36. DOI : 10.1038 / nrendo.2014.171 . PMC 4424797 . PMID 25287287 .
- ^ Сяо Ф, Ю Дж, Го Й, Дэн Дж, Ли К, Ду И, Чен С, Чжу Дж, Шэн Х, Го Ф (июнь 2014 г.). «Влияние депривации отдельных аминокислот с разветвленной цепью на чувствительность к инсулину и метаболизм глюкозы у мышей». Обмен веществ . 63 (6): 841–50. DOI : 10.1016 / j.metabol.2014.03.006 . PMID 24684822 .
- ^ Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, et al. (Декабрь 2017 г.). «Восстановление метаболического здоровья за счет уменьшения потребления аминокислот с разветвленной цепью» . Журнал физиологии . 596 (4): 623–645. DOI : 10,1113 / JP275075 . PMC 5813603 . PMID 29266268 .
- ^ Фонтан л, Каммингз Н.Е., Арриол Apelo С.И., Нейман JC, Kasza я, Шмидт Б. А., и др. (Июль 2016 г.). «Уменьшение потребления аминокислот с разветвленной цепью улучшает метаболическое здоровье» . Отчеты по ячейкам . 16 (2): 520–530. DOI : 10.1016 / j.celrep.2016.05.092 . PMC 4947548 . PMID 27346343 .
- ^ Институт медицины (2002). «Белок и аминокислоты». Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот с пищей . Вашингтон, округ Колумбия: The National Academies Press. С. 589–768.
- ^ «Продукты с самым высоким содержанием изолейцина» . Данные о самостоятельном питании . Condé Nast.
Список отсортирован в порядке убывания количества порций на 200 калорий, а не объема или веса.
- Перейти ↑ Marvel, CS (1941). « dl- Изолейцин (α-амино-β-метилвалериановая кислота)» . Органический синтез . 21 : 60. DOI : 10,15227 / orgsyn.021.0060 .; Сборник , 3 , с. 495
- ^ Bouveault L , Locquin R (1905). "Действие натрия на эфиры однофункциональных одноосновных кислот жирного ряда". Компт. Ренд. (На французском). 140 : 1593–1595.
Внешние ссылки [ править ]
- Биосинтез изолейцина и валина

