| Окисление Джонса | |
|---|---|
| Названный в честь | Юарт Джонс |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | Джонс-окисление |
| Идентификатор онтологии RSC | RXNO: 0000356 |
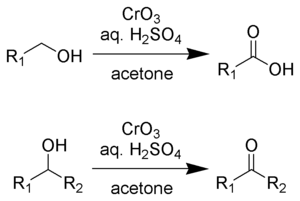
Окисление Джонса представляет собой органическую реакция для окисления первичных и вторичных спиртов до карбоновых кислот и кетонов , соответственно. Он назван в честь его первооткрывателя сэра Юарта Джонса . Реакция была ранним методом окисления спиртов. Его использование сократилось, поскольку были разработаны более мягкие и более селективные реагенты, например, реагент Коллинза . [1]
Реагент Джонса - это раствор, приготовленный растворением триоксида хрома в водной серной кислоте . Чтобы вызвать окисление по Джонсу, эту кислотную смесь затем добавляют к раствору субстрата в ацетоне . В качестве альтернативы можно использовать дихромат калия вместо триоксида хрома. Окисление происходит очень быстро и довольно экзотермично . Урожайность обычно высокая. Реагент удобный и дешевый. Однако соединения Cr (VI) являются канцерогенными, что затрудняет использование этой методологии.
Стехиометрия и механизм [ править ]
Реагент Джонса преобразует первичные и вторичные спирты в альдегиды и кетоны соответственно. В зависимости от условий реакции альдегиды затем могут быть преобразованы в карбоновые кислоты. Для окисления до альдегидов и кетонов два эквивалента хромовой кислоты окисляют три эквивалента спирта:
- 2 HCrO 4 - + 3 RR'C (OH) H + 8 H + + 4 H 2 O → 2 [Cr (H 2 O) 6 ] 3+ + 3 RR'CO
Для окисления первичных спиртов до карбоновых кислот 4 эквивалента хромовой кислоты окисляют 3 эквивалента спирта. Альдегид является промежуточным звеном.
- 4 HCrO 4 - + 3 RCH 2 OH + 16 H + + 11 H 2 O → 4 [Cr (H 2 O) 6 ] 3+ + 3 RCOOH
Неорганические продукты имеют зеленый цвет, характерный для акво-комплексов хрома (III) . [2]
Подобно многим другим окислениям спиртов оксидами металлов, реакция протекает через образование смешанного сложного эфира хромовой кислоты : [3] [4] Эти сложные эфиры имеют формулу CrO 3 (OCH 2 R) -
- CrO 3 (OH) - + RCH 2 OH → CrO 3 (OCH 2 R) - + H 2 O
Как и обычные сложные эфиры, образование этого сложного эфира хромовой кислоты ускоряется кислотой. Эти сложные эфиры могут быть выделены, когда спирт является третичным, поскольку в них отсутствует α- водород, который теряется с образованием карбонила. Например, используя трет- бутиловый спирт , можно выделить трет- бутилхромат ((CH 3 ) 3 CO) 2 CrO 2 ), который сам по себе является хорошим окислителем. [5]
Для структур с альфа-водородом и кислородом сложные эфиры хрома разлагаются, высвобождая карбонильный продукт и плохо определенный продукт Cr (IV):
- CrO 3 (OCH 2 R) - → «CrO 2 OH - » + O = CHR
Дейтерированные спирты HOCD 2 R окисляются примерно в шесть раз медленнее, чем недейтерированные производные. Этот большой кинетический изотопный эффект показывает, что связь C – H (или C – D) разрывается на стадии, определяющей скорость .
Стехиометрия реакции предполагает наличие разновидности Cr (IV) «CrO 2 OH - », которая пропорционально пропорционирует хромовой кислоте с образованием оксида Cr (V), который также действует как окислитель для спирта. [6]
Предполагается, что окисление альдегидов происходит через образование полуацеталеподобных промежуточных продуктов, которые возникают в результате присоединения связи O 3 CrO-H - через связь C = O.
Реагент редко окисляет ненасыщенные связи.
Иллюстративные реакции и приложения [ править ]
Он остается полезным в органическом синтезе . [2] [7] Различные спектроскопические методы, в том числе инфракрасная спектроскопия , могут использоваться для наблюдения за ходом реакции окисления Джонса. Одно время окисление Джонса применялось в алкотестерах .
Связанные процессы [ править ]
Основными реагентами являются реагент Коллинза, PDC и PCC. Эти реагенты представляют собой усовершенствования по сравнению с реагентами на основе неорганического хрома (VI), такими как реагент Джонса .
Исторические ссылки [ править ]
- Bowden, K .; Heilbron, IM; Джонс, ER H (1946). «13. Исследования ацетиленовых соединений. Часть I. Получение ацетиленовых кетонов окислением ацетиленовых карбинолов и гликолей». J. Chem. Soc. : 39. DOI : 10.1039 / jr9460000039 .
- Heilbron, IM; Джонс, ERH; Sondheimer, F (1949). «129. Исследования по ацетиленовым соединениям. Часть XV. Окисление первичных ацетиленовых карбинолов и гликолей». J. Chem. Soc. : 604. DOI : 10.1039 / jr9490000604 .
- Bladon, P; Фабиан, Джойс М .; Хенбест, HB; Кох, HP; Вуд, Джеффри В. (1951). «532. Исследования в стероловой группе. Часть LII. Инфракрасное поглощение ядерных три- и тетразамещенных этиленовых центров». J. Chem. Soc. : 2402. DOI : 10.1039 / jr9510002402 .
- Джонс, ER H (1953). «92. Химия тритерпенов. Часть XIII. Дальнейшая характеристика полипореновой кислоты А». J. Chem. Soc. : 457. DOI : 10.1039 / jr9530000457 .
- Джонс, ER H (1953). «520. Химия тритерпенов и родственных соединений. Часть XVIII. Выяснение структуры полипореновой кислоты C». J. Chem. Soc. : 2548. DOI : 10.1039 / jr9530002548 .
- Джонс, ER H (1953). «599. Химия тритерпенов и родственных соединений. Часть XIX. Дополнительные доказательства, касающиеся структуры полипореновой кислоты А». J. Chem. Soc. : 3019. DOI : 10.1039 / jr9530003019 .
- К. Джерасси , Р. Энгл и А. Бауэрс (1956). «Примечания - Прямое преобразование стероидных Δ5-3β-спиртов в Δ5- и Δ4-3-кетоны». J. Org. Chem. 21 (12): 1547–1549. DOI : 10.1021 / jo01118a627 .
Ссылки [ править ]
- ^ «Реагенты на основе хрома». Окисление спиртов до альдегидов и кетонов . Основные реакции в органическом синтезе. 2006. С. 1–95. DOI : 10.1007 / 0-387-25725-X_1 . ISBN 0-387-23607-4.
- ^ a b Eisenbraun, EJ (1965). «Циклооктанон». Органический синтез . 45 : 28. DOI : 10,15227 / orgsyn.045.0028 .
- ^ Смит, Майкл Б .; Март, Джерри (2007), Расширенная органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Лей, SV; Мадин, А. (1991). Б.М. Трост; И. Флеминг (ред.). Комплексный органический синтез . 7 . Оксфорд: Pergamon Press. С. 253–256.
- ^ Fillmore Freeman, "Ди-трет-бутилхромат" Энциклопедия реагентов для органического синтеза, 2001, John Wiley & Sons, Ltd. doi : 10.1002 / 047084289X.rd059m
- ^ Окисление в органической химии. Под редакцией KB Wiberg, Academic Press, NY, 1965.
- ^ Meinwald, J .; Crandall, J .; Hymans, WE (1965). «Нортрицикланон». Органический синтез . 45 : 77. DOI : 10,15227 / orgsyn.045.0077 .