 | |
| Имена | |
|---|---|
| Имена ИЮПАК 2-морфолин-4-илэтансульфоновая кислота Цвиттерион : 2-морфолин-4-ил-4-илэтансульфонат | |
| Другие названия 2- ( N- морфолино) этансульфоновая кислота | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.022.394 |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
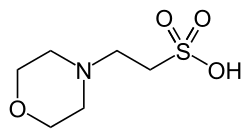
| C 6 H 13 НЕТ 4 S | |
| Молярная масса | 195,2 г / моль |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
MES - это общее название соединения 2- ( N- морфолино) этансульфоновой кислоты . Его химическая структура содержит кольцо морфолина . Его молекулярная масса составляет 195,2, а химическая формула - C 6 H 13 NO 4 S. Синонимы включают: 2-морфолиноэтансульфоновая кислота; 2- (4-морфолино) этансульфоновая кислота; 2- (N-морфолино) этансульфоновая кислота; 2- (4-морфолино) этансульфоновая кислота; MES; MES гидрат; и гидрат морфолин-4-этансульфоновой кислоты. MOPS представляет собой подобное pH-буферное соединение, которое содержит пропансульфоновую составляющую вместо этансульфоновой.
Приложения [ править ]
MES используется в качестве буферного агента в биологии и биохимии . Он имеет р K в значение 6,15 при 20 ° С. PH (и p K a при ионной силе I 0) буферного раствора изменяется в зависимости от концентрации и температуры, и этот эффект можно предсказать с помощью онлайн-калькуляторов. [1] MES хорошо растворяется в воде. Температура плавления составляет прибл. 300 ° С.
MES был разработан как один из буферов Гуда в 1960-х годах. Эти буферы были разработаны с учетом следующих критериев: средний уровень p K a , максимальная растворимость в воде и минимальная растворимость во всех других растворителях , минимальное солевое воздействие, минимальное изменение p K a с температурой, химическая и ферментативная стабильность, минимальное поглощение в видимой или видимой области спектра. УФ- спектральный диапазон и достаточно легко синтезируется. [2] MES также полезен в качестве некоординирующего буфера в химии с участием ионов металлов, поскольку многие обычные буферы (например, фосфатные и ацетатные ) легко образуюткоординационные комплексы . MES только слабо связывает Ca, Mg, Mn и незначительно связывается с Cu (II).[2] [3]
Безопасность [ править ]
Контакт с этим буфером опасен; [4] кожу или глаза следует тщательно промыть водой, а в случае попадания в глаза, проглатывания или вдыхания пыли следует обратиться за медицинской помощью . При сгорании он также выделяет токсичные пары, включая оксид углерода , оксид азота и оксиды серы .
Ссылки [ править ]
- ^ «Биологические буферы» . Устройства REACH.
- ^ a b Хорошо, Норман Э .; Уингет, Дж. Дуглас; Зима, Вильгельмина; Коннолли, Томас Н .; Идзава, Сэйкичи; Сингх, Райзада ММ (1966). «Буферы с ионами водорода для биологических исследований». Биохимия . 5 (2): 467–77. DOI : 10.1021 / bi00866a011 . PMID 5942950 .
- ^ Кандегедара, А .; Рорабахер, ДБ (1999). «Несложные третичные амины как« лучшие »буферы, покрывающие диапазон pH 3-11. Температурная зависимость их констант диссоциации кислоты». Анальный. Chem . 71 : 3140–3144. DOI : 10.1021 / ac9902594 . PMID 21662904 .
- ^ "Архивная копия" . Архивировано из оригинала на 2018-09-20 . Проверено 10 сентября 2012 .CS1 maint: заархивированная копия как заголовок ( ссылка )
См. Также [ править ]
- CAPS (буфер)
- ЧЕС
- MOPS
- HEPES
- HEPPS
- Трис
- Общие буферные соединения, используемые в биологии
Внешние ссылки [ править ]
- MES на OpenWetWare