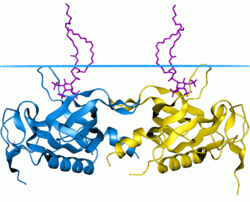
 PH домен тирозин-протеинкиназы BTK | |||||||||
| Идентификаторы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Условное обозначение | PH | ||||||||
| Pfam | PF00169 | ||||||||
| Клан пфам | CL0266 | ||||||||
| ИнтерПро | IPR001849 | ||||||||
| УМНЫЙ | PH | ||||||||
| PROSITE | PDOC50003 | ||||||||
| SCOP2 | 1dyn / SCOPe / SUPFAM | ||||||||
| OPM суперсемейство | 49 | ||||||||
| Белок OPM | 1плс | ||||||||
| CDD | cd00821 | ||||||||
| |||||||||
Домен гомологии плекстрина ( PH домен ) или ( PHIP ) представляет собой белковый домен, состоящий примерно из 120 аминокислот, который встречается в широком спектре белков, участвующих во внутриклеточной передаче сигналов или в качестве компонентов цитоскелета . [1] [2] [3] [4] [5] [6] [7]
Этот домен может связывать фосфатидилинозитолы липидов в пределах биологических мембран (например, фосфатидилинозитолы (3,4,5) -trisphosphate и фосфатидилинозитол (4,5) -bisphosphate ), [8] и белков , такие как Вг-субъединицы из гетеротримерных G белков , [ 9] и протеинкиназа С . [10] Посредством этих взаимодействий PH домены играют роль в привлечении белков к различным мембранам , таким образом направляя их в соответствующие клеточные компартменты или позволяя им взаимодействовать с другими компонентами путей передачи сигнала .
Специфичность связывания липидов [ править ]
Отдельные домены PH обладают специфичностью к фосфоинозитидам, фосфорилированным в разных сайтах внутри инозитольного кольца, например, некоторые связывают фосфатидилинозитол (4,5) -бисфосфат, но не фосфатидилинозитол (3,4,5) -трисфосфат или фосфатидилинозитол (3,4) -бисфосфат , в то время как другие могут обладать необходимой близостью. Это важно, потому что это делает привлечение различных белков, содержащих домен PH, чувствительными к активности ферментов, которые либо фосфорилируют, либо дефосфорилируют эти сайты на инозитоловом кольце, таких как фосфоинозитид-3-киназа или PTEN., соответственно. Таким образом, такие ферменты частично влияют на функцию клеток, модулируя локализацию нижестоящих сигнальных белков, которые обладают доменами PH, способными связывать их фосфолипидные продукты.
Структура [ править ]
Определена трехмерная структура нескольких PH-доменов. [11] Все известные случаи имеют общую структуру, состоящую из двух перпендикулярных антипараллельных бета-листов , за которыми следует С-концевая амфипатическая спираль. Петли, соединяющие бета-нити, сильно различаются по длине, что делает PH-домен относительно трудным для обнаружения, обеспечивая при этом источник специфичности домена. Единственным консервативным остатком среди PH-доменов является единственный триптофан, расположенный внутри альфа-спирали, который служит ядром ядра домена.
Белки, содержащие домен PH [ править ]
Домены PH можно найти во многих различных белках, таких как OSBP или ARF . Вербовка в аппарат Гольджи в этом случае зависит как от PtdIns, так и от ARF. Большое количество PH-доменов имеют низкое сродство к фосфоинозитидам и, как предполагается, функционируют как белковые связывающие домены. Генома смотреть в Saccharomyces CEREVISIAE показал , что большинство доменов PH 33 дрожжей действительно беспорядочные в связывании с фосфоинозитидов, в то время как только один (num1-PH) вели себя весьма специфичны. [12] Белки, содержащие домены PH, принадлежат к следующим семействам:
- Плекстрин , белок, в котором этот домен был впервые обнаружен, является основным субстратом протеинкиназы С в тромбоцитах. Плекстрин содержит два домена PH. Белки ARAP содержат пять доменов PH.
- Серин / треонин-специфичные протеинкиназы, такие как семейство Akt / Rac, протеинкиназа D1 и трипаносомное семейство NrkA.
- Нерецепторные тирозинкиназы, принадлежащие к подсемейству Btk / Itk / Tec.
- Субстрат рецептора инсулина 1 ( IRS-1 ).
- Регуляторы малых G-белков : 64 RhoGEF семейства Dbl-подобных, [13] и несколько белков, активирующих GTPase, таких как белки ABR, BCR или ARAP.
- Цитоскелетные белки, такие как динамин (см. InterPro : IPR001401 ), кинезиноподобный белок unc-104 Caenorhabditis elegans (см. InterPro : IPR001752 ), бета-цепь спектрина, синтрофин (2 домена PH) и белок ядерной миграции NUM1 S. cerevisiae .
- Оксистерин-связывающие белки OSBP, S. cerevisiae OSH1 и YHR073w.
- Церамидкиназа , липидкиназа, фосфорилирующая церамиды до церамид-1-фосфата. [14]
- G-протеиновые рецепторные киназы (GRK) подсемейства GRK2 (бета-адренергические рецепторные киназы): GRK2 и GRK3 . [15]
Подсемейства [ править ]
- Спектрин / плекстринподобный InterPro : IPR001605
Примеры [ править ]
Гены человека, кодирующие белки, содержащие этот домен, включают:
- ABR , ADRBK1 , ADRBK2 , AFAP , AFAP1 , AFAP1L1 , AFAP1L2 , AKAP13 , AKT1 , AKT2 , Akt3 , ANLN , APBB1IP , APPL1 , APPL2 , ARHGAP10 , ARHGAP12 , ARHGAP15 , ARHGAP21 , ARHGAP22 , ARHGAP23 , ARHGAP24 , ARHGAP25 , ARHGAP26 , ARHGAP27 ,ARHGAP9 , ARHGEF16 , ARHGEF18 , ARHGEF19 , ARHGEF2 , ARHGEF3 , ARHGEF4 , ARHGEF5 , ARHGEF6 , ARHGEF7 , ARHGEF9 , ASEF2 ,
- BMX , БТК ,
- C20orf42 , C9orf100 , CADPS , CADPS2 , CDC42BPA , CDC42BPB , CDC42BPG , CENTA1 , CENTA2 , CENTB1 , CENTB2 , CENTB5 , CENTD1 , CENTD2 , CENTD3 , CENTG1 , CENTG2 , CENTG3 , КПН , CNKSR1 , CNKSR2 , COL4A3BP , CTGLF1 , CTGLF2 , CTGLF3 , *CTGLF4 , CTGLF5 , CTGLF6 ,
- DAB2IP , DAPP1 , DDEF1 , DDEF2 , DDEFL1 , DEF6 , DEPDC2 , DGKD , DGKH , DGKK , DNM1 , DNM2 , DNM3 , DOCK10 , DOCK11 , DOCK9 , Dok1 , DOK2 , DOK3 , DOK4 , DOK5 , DOK6 , DTGCU2 ,
- EXOC8 ,
- FAM109A , FAM109B , FARP1 , FARP2 , FGD1 , FGD2 , FGD3 , FGD4 , FGD5 , FGD6 ,
- Gab1 , gab2 , GAB3 , GAB4 , GRB10 , GRB14 , GRB7 ,
- IRS1 , IRS2 , IRS4 , ITK , ITSN1 , ITSN2 ,
- KALRN , KIF1A , KIF1B , KIF1Bbeta ,
- MCF2 , MCF2L , MCF2L2 , MRIP , MYO10 ,
- NET1 , NGEF ,
- OBPH1 , OBSCN , OPHN1 , OSBP , OSBP2 , OSBPL10 , OSBPL11 , OSBPL3 , OSBPL5 , OSBPL6 , OSBPL7 , OSBPL8 , OSBPL9 ,
- PHLDA2 , PHLDA3 , PHLDB1 , PHLDB2 , PHLPP , PIP3-E , PLCD1 , PLCD4 , PLCG1 , PLCG2 , PLCH1 , PLCH2 , PLCL1 , PLCL2 , PLD1 , PLD2 , PLEK , PLEK2 , PLEKHA3 , PLEKHA2 , PLEKHA1 , PLEKHA2 , PLEKHA2 , PLEKHA2 , PLEKHA2 , PLEKHA1 , PLEKHA3 ПЛЕХА7 , г.PLEKHA8 , PLEKHB1 , PLEKHB2 , PLEKHC1 , PLEKHF1 , PLEKHF2 , PLEKHG1 , PLEKHG2 , PLEKHG3 , PLEKHG4 , PLEKHG5 , PLEKHG6 , PLEKHH1 , PLEKHH2 , PLEKHH3 , PLEKHJ1 , PLEKHK1 , PLEKHM1 , PLEKHM2 , PLEKHO1 , PLEKHQ1 , PREX1 , PRKCN , PRKD1 , PRKD2, PRKD3 , PSCD1 , PSCD2 , PSCD3 , PSCD4 , PSD , PSD2 , PSD3 , PSD4 , RALGPS1 , RALGPS2 , RAPH1 ,
- RASA1 , RASA2 , RASA3 , RASA4 , RASAL1 , RASGRF1 , RGNEF , ROCK1 , ROCK2 , RTKN ,
- SBF1 , SBF2 , SCAP2 , SGEF , sh2b , SH2B1 , sh2b2 , sh2b3 , SH3BP2 , SKAP1 , SKAP2 , SNTA1 , SNTB1 , SNTB2 , SOS1 , SOS2 , SPATA13 , SPNB4 , SPTBN1 , SPTBN2 , SPTBN4 , SPTBN5 , STAP1 , SWAP70 , SYNGAP1 ,
- TBC1D2 , TEC , TIAM1 , TRIO , TRIOBP , TYL ,
- УРП1 , УРП2 ,
- VAV1 , VAV2 , VAV3 , VEPH1
См. Также [ править ]
- Pleckstrin
- Не связан домен FYVE связывает фосфатидилинозитолы 3-фосфат и был установлен в более чем 60 белках.
- Домен ГР является структурно родственными домнами белка.
Ссылки [ править ]
- ^ Mayer BJ, Ren R, Кларк KL, Балтимор D (май 1993). «Предполагаемый модульный домен, присутствующий в различных сигнальных белках». Cell . 73 (4): 629–30. DOI : 10.1016 / 0092-8674 (93) 90244-K . PMID 8500161 . S2CID 44282241 .
- ^ Хэслэма RJ, Коиде HB, Hemmings BA (май 1993). «Гомология плэкстриновых доменов». Природа . 363 (6427): 309–10. DOI : 10.1038 / 363309b0 . PMID 8497315 . S2CID 4334376 .
- ^ Музакие А, Gibson Т, Р Райс, Томпсон Дж, Сараст М (сентябрь 1993). «Домен PH: обычная часть структурной мозаики сигнальных белков». Направления биохимических наук . 18 (9): 343–8. DOI : 10.1016 / 0968-0004 (93) 90071-Т . PMID 8236453 .
- ^ Gibson TJ, Hyvönen M, Музаккьо A, Сарасте M, Birney E (сентябрь 1994). «Домен PH: первая годовщина». Направления биохимических наук . 19 (9): 349–53. DOI : 10.1016 / 0968-0004 (94) 90108-2 . PMID 7985225 .
- ^ Pawson T (февраль 1995). «Белковые модули и сигнальные сети». Природа . 373 (6515): 573–80. DOI : 10.1038 / 373573a0 . PMID 7531822 . S2CID 4324726 .
- ^ Ingley E, Hemmings BA (декабрь 1994). «Домены гомологии плэкстрина (PH) в передаче сигнала». Журнал клеточной биохимии . 56 (4): 436–43. DOI : 10.1002 / jcb.240560403 . PMID 7890802 .
- ^ Сарасте M, Hyvönen M (июнь 1995). «Домены гомологии Плекстрина: файл фактов». Текущее мнение в структурной биологии . 5 (3): 403–8. DOI : 10.1016 / 0959-440X (95) 80104-9 . PMID 7583640 .
- Перейти ↑ Wang DS, Shaw G (декабрь 1995 г.). «Ассоциация C-концевой области бета I сигма II спектрина с мембранами мозга опосредуется доменом PH, не требует мембранных белков и совпадает с сайтом связывания инозитол-1,4,5 трифосфата». Сообщения о биохимических и биофизических исследованиях . 217 (2): 608–15. DOI : 10.1006 / bbrc.1995.2818 . PMID 7503742 .
- Перейти ↑ Wang DS, Shaw R, Winkelmann JC, Shaw G (август 1994). «Связывание PH доменов киназы бета-адренергического рецептора и бета-спектрина с участками бета-субъединицы тримерных G-белков, содержащими повтор WD40 / бета-трансдуцин». Сообщения о биохимических и биофизических исследованиях . 203 (1): 29–35. DOI : 10.1006 / bbrc.1994.2144 . PMID 8074669 .
- Перейти ↑ Yao L, Kawakami Y, Kawakami T (сентябрь 1994 г.). «Домен гомологии плекстрина тирозинкиназы Bruton взаимодействует с протеинкиназой C» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (19): 9175–9. DOI : 10.1073 / pnas.91.19.9175 . PMC 44770 . PMID 7522330 .
- ^ Riddihough G (ноябрь 1994). «Еще меандры и бутерброды». Структурная биология природы . 1 (11): 755–7. DOI : 10.1038 / nsb1194-755 . PMID 7634082 . S2CID 5410578 .
- ^ Ю. JW, Mendrola JM, Audhya A, Singh S, Keleti D, Dewald DB, Мюррей D, Emr SD, Леммон MA (март 2004). «Полногеномный анализ мембранного нацеливания доменов гомологии плэкстрина S. cerevisiae». Молекулярная клетка . 13 (5): 677–88. DOI : 10.1016 / S1097-2765 (04) 00083-8 . PMID 15023338 .
- ↑ Fort P, Blangy A (июнь 2017 г.). «Эволюционный ландшафт Dbl-подобных семейств RhoGEF: адаптация эукариотических клеток к сигналам окружающей среды» . Genome Biol Evol . 9 (6): 1471–1486. DOI : 10.1093 / GbE / evx100 . PMC 5499878 . PMID 28541439 .
- ^ Сугиура М, Коно К, Лю Н, Shimizugawa Т, Minekura Н, С Spiegel, Kohama Т (июнь 2002 г.). «Керамидкиназа, новая липидкиназа. Молекулярное клонирование и функциональная характеристика» . Журнал биологической химии . 277 (26): 23294–300. DOI : 10.1074 / jbc.M201535200 . PMID 11956206 .
- ^ Комолов KE, Benovic JL (январь 2018). «G-протеин-связанные рецепторные киназы: прошлое, настоящее и будущее» . Сотовая связь . 41 : 17–24. DOI : 10.1016 / j.cellsig.2017.07.004 . PMC 5722692 . PMID 28711719 .
Внешние ссылки [ править ]
- Nash Lab Protein Interaction Domains - описание домена PH [ постоянная мертвая ссылка ]
- UMich Ориентация белков в мембранах семейства / суперсемейство-51 - Расчетные ориентации PH доменов в мембранах