Короткой шпильки РНК или небольшая шпилька РНК ( shRNA / Шпилька Вектор) представляет собой искусственный РНК - молекулы с жесткой свою очередь шпильки , которые могут быть использованы для экспрессии гена - мишени с помощью молчание интерференции РНК (RNAi). [1] [2] Экспрессия shRNA в клетках обычно осуществляется путем доставки плазмид или через вирусные или бактериальные векторы . shRNA является выгодным медиатором РНКи, поскольку она имеет относительно низкую скорость деградации и оборота. Однако это требует использования вектора экспрессии , который может вызывать побочные эффекты при применении в медицине. [3]
Выбор промотора важен для достижения устойчивой экспрессии кшРНК. Сначала использовались промоторы полимеразы III, такие как U6 и H1; однако эти промоторы лишены пространственного и временного контроля. [3] Таким образом, произошел переход к использованию промоторов полимеразы II для регулирования экспрессии shРНК.
Доставка [ править ]
Экспрессия shRNA в клетках может быть получена путем доставки плазмид или с помощью вирусных или бактериальных векторов .
Доставка плазмид в клетки посредством трансфекции для получения экспрессии shРНК может осуществляться с использованием коммерчески доступных реагентов in vitro . Однако этот метод неприменим in vivo и поэтому имеет ограниченное применение.
Использование бактериального вектора для получения экспрессии shРНК в клетках - относительно недавний подход. Он основан на исследованиях, показывающих, что рекомбинантная Escherichia coli , содержащая плазмиду с shРНК, скармливаемая мышам, может подавлять экспрессию целевого гена в эпителии кишечника. [4] Этот подход использовался в 2012 году в клинических испытаниях, чтобы попытаться лечить пациентов с семейным аденоматозным полипозом. [5]
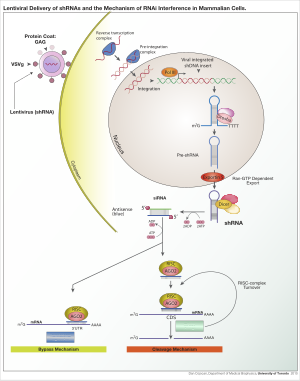
Для получения экспрессии shРНК в клетках можно использовать различные вирусные векторы, включая аденоассоциированные вирусы (AAV), аденовирусы и лентивирусы.. У аденоассоциированных вирусов и аденовирусов геномы остаются эписомальными. Это выгодно, поскольку исключается инсерционный мутагенез. Его недостаток состоит в том, что потомство клетки будет быстро терять вирус в результате деления клетки, если клетка не делится очень медленно. AAV отличаются от аденовирусов тем, что вирусные гены удалены, и они имеют пониженную упаковочную способность. Лентивирусы интегрируются в участки транскрипционно активного хроматина и, таким образом, передаются клеткам потомства. При таком подходе повышается риск инсерционного мутагенеза; однако риск можно снизить, используя лентивирус с дефицитом интегразы. [6]
Механизм действия [ править ]
Как только вектор интегрирован в геном хозяина, кшРНК затем транскрибируется в ядре полимеразой II или полимеразой III в зависимости от выбора промотора. Продукт имитирует pri-microRNA (pri-miRNA) и обрабатывается Drosha . Полученная пре-shРНК экспортируется из ядра с помощью Exportin 5. Этот продукт затем обрабатывается Dicer и загружается в РНК-индуцированный комплекс сайленсинга (RISC). Смысловая (пассажирская) нить деградирована. Антисмысловая (направляющая) цепь направляет RISC к мРНК, которая имеет комплементарную последовательность. В случае полной комплементарности RISC расщепляет мРНК. В случае несовершенной комплементарности RISC подавляет трансляцию мРНК. В обоих случаях shРНК приводит к молчанию гена-мишени.
Применение в генной терапии [ править ]
Из-за способности shRNA обеспечивать специфическое, продолжительное, молчание генов, существует большой интерес к использованию shRNA для применения в генной терапии. Ниже обсуждаются три примера терапии на основе shRNA.
Компания Gradalis, Inc. разработала вакцину FANG, которая используется для лечения запущенных форм рака. FANG полагается на бифункциональную shRNA (bi-shRNA) против иммуносупрессивных трансформирующих факторов роста (TGF) β1 и β2. [8] Аутологичные опухолевые клетки собирали у пациентов, и плазмиду, кодирующую бифункциональную shРНК и гранулоцитарно-макрофагальный колониестимулирующий фактор (GMCSF), вводили ex vivo посредством электропорации. Эти клетки позже были облучены и снова введены пациенту.
Марина Биотех разработала CEQ508, который используется для лечения семейного аденоматозного полипоза. CEQ508 использует бактериальный вектор для доставки shРНК против β-катенина.
Компания Gradalis, Inc. разработала бифункциональную shRNA-STMN1 (pbi-shRNA STMN1), которая используется для лечения запущенных и / или метастатических форм рака. Эта pbi-shRNA STMN1 действует против статмина 1 и доставляется внутрь опухоли с помощью технологии липоплекс (LP) биламеллярных инвагинированных пузырьков ( BIV) .
С некоторыми проблемами обычно сталкиваются терапевтические средства на основе shRNA. Самая большая проблема - это доставка. shRNA обычно доставляется с использованием вектора, и хотя они обычно эффективны, они создают серьезные проблемы с безопасностью. В частности, подходы к вирусной генной терапии оказались опасными в прошлых клинических испытаниях. В первом поколении ретровирусной генной терапии у некоторых пациентов, получавших вирусные векторы для лечения синдрома Вискотта – Олдрича, развился острый Т-клеточный лейкоз. Было установлено, что это было вызвано местоположением инсерции вирусного вектора. [9] Возможное перенасыщение RISC также является проблемой. Если кшРНК экспрессируется на слишком высоких уровнях, клетка может быть не в состоянии правильно обрабатывать эндогенную РНК, что может вызвать серьезные проблемы. Другой проблемой является возможность того, что у пациента может развиться иммунный ответ против терапии. [10] Наконец, могут быть эффекты нецелевые, и shРНК может заглушить другие непредусмотренные гены. При разработке успешных новых терапевтических средств на основе shRNA необходимо принимать во внимание все эти проблемы.
См. Также [ править ]
- Малая интерферирующая РНК
Ссылки [ править ]
- ^ Paddison PJ, Caudy А. Бернштейн Е, Ханнон GJ, Конклин DS (апрель 2002). «Короткие шпильчатые РНК (кшРНК) индуцируют специфичное для последовательности молчание в клетках млекопитающих» . Гены и развитие . 16 (8): 948–58. DOI : 10,1101 / gad.981002 . PMC 152352 . PMID 11959843 .
- ^ Brummelkamp TR, Бернардс R , R Агами (апрель 2002). «Система для стабильной экспрессии коротких интерферирующих РНК в клетках млекопитающих». Наука . 296 (5567): 550–3. DOI : 10.1126 / science.1068999 . hdl : 1874/15573 . PMID 11910072 .
- ^ a b Ван З., Рао Д. Д., Сензер Н., Нямунайтис Дж. (декабрь 2011 г.). «РНК-интерференция и терапия рака». Фармацевтические исследования . 28 (12): 2983–95. DOI : 10.1007 / s11095-011-0604-5 . PMID 22009588 .
- Перейти ↑ Xiang S, Fruehauf J, Li CJ (июнь 2006 г.). «Бактерии, экспрессирующие РНК с короткой шпилькой, вызывают интерференцию РНК у млекопитающих». Природа Биотехнологии . 24 (6): 697–702. DOI : 10.1038 / nbt1211 . PMID 16699500 .
- ^ Burnett JC, Росси JJ, Tiemann K (сентябрь 2011). «Текущий прогресс терапии миРНК / шРНК в клинических испытаниях» . Биотехнологический журнал . 6 (9): 1130–46. DOI : 10.1002 / biot.201100054 . PMC 3388104 . PMID 21744502 .
- ↑ Lombardo A, Genovese P, Beausejour CM, Colleoni S, Lee YL, Kim KA, Ando D, Urnov FD, Galli C, Gregory PD, Holmes MC, Naldini L (ноябрь 2007 г.). «Редактирование генов в стволовых клетках человека с использованием нуклеаз цинковых пальцев и доставки лентивирусных векторов, дефектных по интегразе». Природа Биотехнологии . 25 (11): 1298–306. DOI : 10.1038 / nbt1353 . PMID 17965707 .
- ^ Macrae IJ, Чжоу K, Li F, Repic A, Брукс А.Н., Cande WZ, Adams PD, Doudna JA (январь 2006). «Структурная основа процессинга двухцепочечной РНК с помощью Dicer». Наука . 311 (5758): 195–8. DOI : 10.1126 / science.1121638 . PMID 16410517 .
- ^ Senzer N, Барвы М, Куна - J, Мельника А, Beitsch Р, Лазар М, Лифшиц S, Маги М, О , J, Мельница СВ, Беделлом С, Хиггс С, Кумар Р, Ю У, Норвелл Ж, Phalon С, Taquet N, Рао Д.Д., Ван З., Джей С.М., Паппен Б.О., Валлравен Дж., Бруникарди ФК, Шанахан Д.М., Мейплс П.Б., Неманайтис Дж. (Март 2012 г.) «Фаза I испытания вакцины« bi-shRNAi (фурин) / ДНК GMCSF / аутологичных опухолевых клеток »(FANG) при запущенном раке» . Молекулярная терапия . 20 (3): 679–86. DOI : 10.1038 / mt.2011.269 . PMC 3293620 . PMID 22186789 .
- Перейти ↑ Persons DA, Baum C (февраль 2011 г.). «Решение проблемы γ-ретровирусных векторов, содержащих длинные концевые повторы» . Молекулярная терапия . 19 (2): 229–31. DOI : 10.1038 / mt.2010.305 . PMC 3034864 . PMID 21289636 .
- ^ Уайтхед К.А., Dahlman JE, Langer RS, Anderson DG (2011). «Молчание или стимуляция? SiRNA доставки и иммунной системы». Ежегодный обзор химической и биомолекулярной инженерии . 2 : 77–96. DOI : 10,1146 / annurev-chembioeng-061010-114133 . PMID 22432611 .
