 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК μ-Хлор [ди (циклопента-2,4-диен-1-ил)] диметил (μ-метилен) титаналюминий | |
| Другие названия Реагент Теббе | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.157.162 |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 13 H 18 AlClTi | |
| Молярная масса | 284,60 г / моль |
| Растворимость в других растворителях | толуол, бензол, дихлорметан, ТГФ (только низкие температуры) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
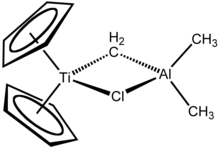
Реагент Теббе представляет собой металлоорганическое соединение с формулой (C 5 H 5 ) 2 TiCH 2 ClAl (CH 3 ) 2 . Он используется в метиленирования из карбонильных соединений, то есть он преобразует органические соединения , содержащие R 2 C = O группу , в соответствующем R 2 С = СН 2 производной. [1] Это красное твердое вещество, пирофорное на воздухе, поэтому с ним обычно обращаются безвоздушными методами . Первоначально он был синтезирован Фредом Теббе вDuPont Central Research .
Реагент Теббе содержит два тетраэдрических металлических центра, связанных парой мостиковых лигандов . Титан имеет два циклопентадиенила ( [C
5ЧАС
5]-
, или Cp) кольца и алюминий имеет две метильные группы. Атомы титана и алюминия связаны вместе как метиленовым мостиком (-CH 2 -), так и атомом хлорида в почти квадратной плоскости (Ti – CH 2 –Al – Cl) геометрии. [2] Реагент Теббе был первым описанным соединением, в котором метиленовый мостик соединяет переходный металл (Ti) и металл основной группы (Al). [3]
Подготовка [ править ]
Реагент Теббе синтезируется из дихлорида титаноцена и триметилалюминия в растворе толуола . [3] [4]
- Cp 2 TiCl 2 + 2 Al (CH 3 ) 3 → CH 4 + Cp 2 TiCH 2 AlCl (CH 3 ) 2 + Al (CH 3 ) 2 Cl
Примерно через 3 дня продукт получается после перекристаллизации для удаления Al (CH 3 ) 2 Cl. [3] Хотя синтезы с использованием выделенного реагента Теббе дают более чистый продукт, сообщалось об успешных процедурах с использованием реагента «на месте». [5] [6] Вместо выделения реагента Теббе раствор просто охлаждают на ледяной бане или бане с сухим льдом перед добавлением исходного материала.
Альтернативный, но менее удобный синтез предполагает использование диметилтитаноцена (реагент Петазиса): [7]
- Cp 2 Ti (CH 3 ) 2 + Al (CH 3 ) 2 Cl → Cp 2 TiCH 2 AlCl (CH 3 ) 2 + CH 4
Одним из недостатков этого метода, помимо необходимости Cp 2 Ti (CH 3 ) 2 , является сложность отделения продукта от непрореагировавшего исходного реагента.
Механизм реакции [ править ]
Сам по себе реагент Теббе не реагирует с карбонильными соединениями, но сначала его необходимо обработать мягким основанием Льюиса , например пиридином , которое образует активный карбен Шрока .
Также аналогично реагенту Виттига, реакционная способность, по-видимому, обусловлена высокой оксофильностью Ti (IV). Карбен Шрока ( 1 ) реагирует с карбонильными соединениями ( 2 ) с образованием постулируемого промежуточного соединения оксатитанациклобутана ( 3 ). Этот циклический интермедиат никогда не выделяли напрямую, предположительно потому, что он немедленно распадается с образованием желаемого алкена ( 5 ).
Сфера [ править ]
Реагент Теббе используется в органическом синтезе для карбонильного метиленирования. [8] [9] [10] Это преобразование также можно осуществить с помощью реакции Виттига , хотя реагент Теббе более эффективен, особенно для стерически ограниченных карбонилов. Кроме того, реагент Теббе менее щелочной, чем реагент Виттига, и не дает продуктов β-отщепления.
Реакции метилирования также происходят для альдегидов, а также для сложных эфиров , лактонов и амидов . Реагент Теббе превращает сложные эфиры и лактоны в простые эфиры енола, а амиды - в енамины. В соединениях, содержащих как кетоновые, так и сложноэфирные группы, кетон избирательно реагирует в присутствии одного эквивалента реагента Теббе.
Реагент Теббе метиленирует карбонилы без рацемизации хирального α-углерода. По этой причине реагент Теббе нашел применение в реакциях сахаров, где поддержание стереохимии может иметь решающее значение. [11]
Реагент Теббе реагирует с хлорангидридами с образованием енолятов титана путем замены Cl - .
Модификации [ править ]
Реагент Теббе можно модифицировать за счет использования различных лигандов. Это может изменить реакционную способность комплекса, что приведет к более широкому диапазону реакций. Например, циклопропанирование может быть достигнуто с использованием хлорированного аналога. [12]
См. Также [ править ]
Связанные титаноорганические реагенты и реакции [ править ]
- Кулинковича реакция
- Реагент петазиса
- Реагент Ломбардо [13]
- Реакция Макмерри
Связанные реакции метиленирования [ править ]
- Реагент найстеда
- Олефинирование Петерсона
- Реакция Виттига
- Олефинирование Кауфмана
Ссылки [ править ]
- ^ FN Tebbe, GW Парсхолл и GS Редди (1978). «Омологация олефинов с соединениями метилена титана». Варенье. Chem. Soc. 100 (11): 3611–3613. DOI : 10.1021 / ja00479a061 .
- ^ Томпсон, Рик; Накамару-Огисо, Эйко; Чен, Чун-Син; Пинк, Марен; Миндиола, Дэниел Дж. (2014). «Структурное объяснение выдающегося реагента Теббе». Металлоорганические соединения . 33 (1): 429–432. DOI : 10.1021 / om401108b .
- ^ a b c Херрманн, WA, "Метиленовый мост" достижения в металлоорганической химии 1982 , 20 , 195–197.
- ^ Straus, DA, «μ-Хлорбис (циклопентадиенил) (диметилалюминий) -μ-метилентитан»: Энциклопедия реагентов для органического синтеза. Джон Вили, Лондон, 2000.
- ^ Сосна, SH; Kim, V .; Ли, В. (1990). «Простые эфиры енола путем метиленирования сложных эфиров: 1-фенокси-1-фенилэтен и 3,4-дигидро-2-метилен-2 H -1-бензопиран». Орг. Synth . 69 : 72. DOI : 10,15227 / orgsyn.069.0072 .
- ^ LF Cannizzo & RH Grubbs (1985). «Получение in situ (μ-хлор) (μ-метилен) бис (циклопентадиенил) (диметилалюминий) титана (реагент Теббе)». J. Org. Chem. 50 (13): 2386–2387. DOI : 10.1021 / jo00213a040 .
- ^ Payack, JF; Хьюз, DL; Cai, D .; Коттрелл, IF; Верховен, Т.Р. (2004). «Диметилтитаноцен» . Органический синтез .CS1 maint: несколько имен: список авторов ( ссылка ); Сборник , 10 , стр. 355
- ^ Хартли, Ричард С .; Ли, Цзяньфэн; Main, Calver A .; Маккирнан, Гордон Дж. (2007). «Реагенты карбеноидов титана для превращения карбонильных групп в алкены». Тетраэдр . 63 (23): 4825–4864. DOI : 10.1016 / j.tet.2007.03.015 .
- ^ Сосна, SH Org. Реагировать. 1993 , 43 , 1. (Обзор)
- ^ Beadham, I .; Micklefield, J. Curr. Орг. Synth. 2005 , 2 , 231–250. (Рассмотрение)
- ^ А. Марра, J. Эно, А. Veyrieres и П. Sinay (1992). «Изопропенилгликозиды и родственные им соединения как новые классы гликозильных доноров: тема и варианты». Варенье. Chem. Soc. 114 (16): 6354–6360. DOI : 10.1021 / ja00042a010 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Необычный амбифильный карбеноидный эквивалент в амидном циклопропанировании Kuo-Wei Lin, Shiuan Yan, I-Lin Hsieh и Tu-Hsin Yan Org. Lett. ; 2006 ; 8 (11), стр. 2265–2267; Абстрактный
- ↑ Лучано Ломбардо (1987). «Метилирование карбонильных соединений: (+) - 3-метилен- цис-п -метан». Органический синтез . 65 : 81. DOI : 10,15227 / orgsyn.065.0081 ..