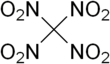| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тетранитрометан | |||
| Другие имена TNM Tetan | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.007.359 | ||
| КЕГГ | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1510 | ||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| CN 4 O 8 | |||
| Молярная масса | 196,04 г / моль | ||
| Внешность | От бесцветного до бледно-желтого жидкого или твердого вещества | ||
| Запах | Острый | ||
| Плотность | 1,623 г / см 3 | ||
| Температура плавления | 13,8 ° С (56,8 ° F, 286,9 К) | ||
| Точка кипения | 126 ° С (259 ° F, 399 К) | ||
| инсол | |||
| Давление газа | 8 мм рт. Ст. (20 ° C) [2] | ||
| -43,02 · 10 −6 см 3 / моль | |||
| Опасности | |||
| Основные опасности | Окислитель, может образовывать взрывоопасные смеси | ||
| Паспорт безопасности | ICSC 1468 | ||
Классификация ЕС (DSD) (устарела) |   | ||
| R-фразы (устаревшие) | R8 R23 / 24/25 R36 / 38 R45 | ||
| S-фразы (устарели) | S17 S45 | ||
| NFPA 704 (огненный алмаз) |  1 3 2 OX | ||
| Смертельная доза или концентрация (LD, LC): | |||
ЛК 50 ( средняя концентрация ) | 18 частей на миллион (крыса, 4 часа) 100 частей на миллион (кошка, 20 мин) 54 частей на миллион (мышь, 4 часа) [3] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 1 ppm (8 мг / м 3 ) [2] | ||
REL (рекомендуется) | TWA 1 ppm (8 мг / м 3 ) [2] | ||
IDLH (Непосредственная опасность) | 4 частей на миллион [2] | ||
| Родственные соединения | |||
Родственные соединения | Гексанитроэтан Октанитропентан Тринитрометан | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
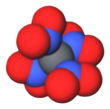
Тетранитрометан или TNM - это органический окислитель с химической формулой C (NO 2 ) 4 . Его химическая структура состоит из четырех нитрогрупп, связанных с одним атомом углерода. В 1857 году он был впервые синтезирован реакцией цианоацетамида натрия с азотной кислотой . [4]
Использует [ редактировать ]
Он был исследован для использования в качестве окислителя в двухкомпонентных ракетах ; однако его высокая температура плавления делает его непригодным. Высокоочищенный тетранитрометан нельзя заставить взорваться, но его чувствительность резко возрастает из-за окисляемых примесей, таких как добавки, предотвращающие замерзание. Это делает его практически непригодным для использования в качестве топлива. [5] В лаборатории он используется как реагент для обнаружения двойных связей в органических соединениях и как нитрующий реагент. Он также нашел применение в качестве добавки к дизельному топливу для увеличения цетанового числа . [6]
Подготовка [ править ]
ТНМ представляет собой бледно - желтую жидкость , которая может быть получена в лаборатории с помощью нитрования из ангидрида уксусной кислоты с безводной азотной кислотой (метод Chattaway в). [7] Этот метод был опробован в промышленном масштабе в 1950-х годах компанией Nitroform Products в Ньюарке, США, но весь завод был разрушен взрывом в 1953 году. [8]
Первое промышленное производство было начато в Германии во время Второй мировой войны с целью повышения цетанового числа дизельного топлива. Этот процесс улучшил первоначальный метод, который начинался с уксусной кислоты и азотной кислоты. [9] Без учета урожайности или стоимости за несколько недель было произведено около 10 тонн TNM. Однако после окончания войны этот производственный процесс больше не использовался в промышленности из-за высоких связанных с этим затрат. [10]
Для коммерческого использования использовался более дешевый метод, начиная с ацетилена . [11] Во-первых, азотная кислота, содержащая нитрат ртути, восстанавливается ацетиленом, что приводит к образованию тринитрометана (нитроформа) и смеси диоксида углерода и оксида азота в качестве отработанного газа. Оксиды азота ценны и обычно восстанавливаются в виде азотной кислоты в абсорбционной башне. Полученная нитроформа превращается в TNM путем добавления азотной и серной кислоты при более высоких температурах. С помощью этого метода может быть достигнут выход 90% (в расчете на азотную кислоту) до очистки. [12]
Структура [13] [ править ]
TNM - яркий пример молекулярной гибкости. Он довел структурные методы до пределов их применимости, о чем свидетельствует тот факт, что структура TNM пыталась определить в течение более 70 лет на различных этапах.
Ранние исследования газовой электронной дифракции не могли полностью описать наблюдаемую дифракционную картину, и только применение четырехмерной модели, касающейся коррелированного движения четырех групп NO 2 вокруг связей CN, могло полностью описать экспериментальные наблюдения. Проблема возникает из-за того, что двойная локальная симметрия звеньев C-NO 2 по сравнению с тройной симметрией звена C (NO 2 ) 3, а также непосредственная близость групп NO 2, препятствующая их свободному вращению, является причиной источник очень сложного взаимно затрудненного движения групп NO 2 .
Кристаллическая структура также пыталась несколько раз. Первое достойное решение проблемы потребовало модели, описывающей сильно разупорядоченную высокотемпературную кристаллическую фазу высокотемпературной фазы (> 174,4 К), как показано на рисунке 1. Уменьшение симметрии и анализ двойникования кристаллов привели, наконец, к к разрешенному беспорядку структуры, показанной на рисунке 2.
Структура упорядоченной низкотемпературной фазы содержит три независимые молекулы в асимметричном звене. Структурные параметры газовой и твердой фаз приведены в следующей таблице для сравнения.
| Параметр | GED | XRD (диапазон) |
| r C – N | 1,509 (5) | 1,502 (4) - 1,554 (5) |
| r N – O (затмение) | 1,201 (3) | 1,198 (4) - 1,215 (5) |
| r N – O (олень) | 1,199 (3) | 1,178 (5) - 1,222 (4) |
| ∡NCN_1 | 105,1 (16) | 108,2 (3) - 110,9 (3) |
| ∡NCN_2 | 111,7 (8) | 107,3 (3) - 111,4 (2) |
| ∡NCN_3 | 106,6 (2) - 107,1 (3) | |
| ∡ONO | 129,2 (17) | 128,0 (4) - 132,3 (4) |
Безопасность [ править ]
На способность TNM детонировать в значительной степени влияет присутствие примесей даже в небольших количествах. TNM образует чрезвычайно мощные взрывчатые смеси, когда топливо добавляется в стехиометрических пропорциях. Многие из этих смесей показывают чувствительность к удару даже выше, чем у нитроглицерина . [14]
Тетранитрометан может использоваться в составе взрывоопасных жидких взрывчатых веществ в качестве окислителя. Образует взрывоопасные смеси со всеми легковоспламеняющимися веществами. Экспериментируя с этим веществом, не используйте бумагу для фильтрации! Даже небольшие примеси делают тетранитрометан взрывчатым веществом, которое взрывается при ударе или трении. Хорошо известен трагический лекционный эксперимент в Мюнстерском университете в 1920 году, когда небольшая стальная трубка, содержащая тетранитрометан, толуол и абсорбирующий хлопок, взорвалась незадолго до того, как сгореть, так что более 30 студентов были ранены, некоторые серьезно; [15] однако на основании записей ректората задокументировано до 10 смертей и более десятка травм. [16]После этого немецкий химико-технический рейхсанштальт определил скорость детонации 9300 метров в секунду. Затем Альфред Штеттбахер сравнительно доказал, что эта смесь была гораздо более взрывоопасной, чем гексоген , пентрит , взрывчатый желатин или панкластит, и, таким образом, представляла собой наиболее разрушительное взрывчатое вещество из всех.
TNM реагирует с влагой при повышенном pH с образованием тринитрометана (нитроформа), который легко реагирует с металлами с образованием очень нестабильных и взрывоопасных солей.
Тетранитрометан очень токсичен. Абсорбция всего 2,5 мг / кг может вызвать метгемоглобинемию , отек легких и повреждение печени, почек и центральной нервной системы. Есть основания полагать, что это канцероген для человека. [17]
Ссылки [ править ]
- Перейти ↑ Merck Index , 11-е издание, 9164 .
- ^ a b c d Карманный справочник NIOSH по химической опасности. «# 0605» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Тетранитрометан» . Немедленно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ↑ Л. Н. Шишков (1857). "Sur la конституция молниеносной уксусной и новой серии корпусов, производных от ацетальной кислоты" . Анналы химии и тела . 49 (11): 310.
- ^ JG Чинкеля (1956). «Тетранитрометан как окислитель ракетного топлива». Промышленная и инженерная химия . 48 (4): 732–735. DOI : 10.1021 / ie50556a022 .
- ↑ К.В. Алтухов, В.В. Перекалин (1976). «Химия тетранитрометана». Российские химические обзоры . 45 (11): 1052–1066. DOI : 10,1070 / RC1976v045n11ABEH002759 .
- ^ Лян, П. (1941). «Тетранитрометан» (PDF) . Органический синтез . 21 : 105. ; Сборник , 3 , с. 803
- ^ Махони против Nitroform Co. , 114 A.2d 863 (NJ Appellate Div 1955).
- ^ FD Chattaway (1910). «Простой способ получения тетранитрометана» . Журнал химического общества . 97 : 2099–2102. DOI : 10.1039 / CT9109702099 .
- ↑ KF Hager (1949). «Тетранитрометан». Промышленная и инженерная химия . 41 (10): 2168–2172. DOI : 10.1021 / ie50478a028 .
- ^ KJP Orton, П. В. Макки (1920). «Действие азотной кислоты на непредельные углеводороды. Действие азотной кислоты на ацетилен» . Журнал химического общества . 117 : 283–297. DOI : 10.1039 / CT9201700283 .
- ^ Урбанский, Тадеуш (1964). Химия и технология взрывчатых веществ . Я . Pergamon Press. С. 589–594. LCCN 83002261 .
- ^ Вишневский, Юрий В .; Тихонов, Денис С .; Schwabedissen, Jan; Штаммлер, Ханс-Георг; Молл, Ричард; Крумм, Буркхард; Klapötke, Thomas M .; Мицель, Норберт В. (2017-08-01). «Тетранитрометан: кошмар молекулярной гибкости в газообразном и твердом состояниях» . Angewandte Chemie International Edition . 56 (32): 9619–9623. DOI : 10.1002 / anie.201704396 .
- ^ Урбанский, Тадеуш (1964). Химия и технология взрывчатых веществ . Я . Pergamon Press. п. 593. LCCN 83002261 .
- ↑ Королевское химическое общество: авария при взрыве в Химическом институте Университета Мюнстера iW и ее причина. В: J. Chem. Soc., Abstr. , 1920, 118, ii457-ii483. DOI: 10.1039 / CA9201805457
- ^ Universitätsarchiv Münster, NU EI 9 spec., Explosionsunglück im Chemischen Institut am 27. Mai 1920, Rüst, A. Ebert, K. Egli: Unfälle beim chemischen Arbeiten. Рашер, 1948, с. 23.
- ^ Национальная программа токсикологии (2011). «Тетранитрометан» (PDF) . Отчет о канцерогенных веществах (12-е изд.). Национальная токсикологическая программа . Архивировано 31 января 2013 года (PDF) . Проверено 14 августа 2012 .
Внешние ссылки [ править ]
- Страница веб-книги для CN4O8
- CDC - Карманный справочник NIOSH по химическим опасностям