Толуолсульфонила (сокращенно тозил , сокращенно Ц. [NB 1] или Тос ) группы, Н 3 CC 6 H 4 SO 2 , представляет собой одновалентную органической группа , которая состоит из толил группы , Н 3 CC 6 Н 4 , присоединенные к сульфонильной группе , SO 2 , с открытой валентностью по сере. Эта группа обычно происходит от соединения тозилхлорид , H 3 CC 6 H 4 SO 2.Cl (сокращенно TsCl), который образует сложные эфиры и амиды толуолсульфоновой кислоты , H 3 CC 6 H 4 SO 2 OH (сокращенно TsOH). Ориентации пункта показано ( п - толуолсульфонил) является наиболее распространенной, и в соответствии с соглашением тозили без префикса относятся к р группе толуолсульфонила.
Толуолсульфонат (или тозилат ) группа относится к H
3CC
6ЧАС
4ТАК
3(ЦО) группа, с дополнительным кислородом, присоединенным к сере и открытой валентностью на кислороде. В химическом названии, термин тозилат может либо обратиться к соли , содержащей анион п - толуолсульфоновой кислота, ЦО - М + (М = щелочной металл, NR 4 , PR 4 , и т.д.), или он может относиться к сложным эфирам из р -толуолсульфоновая кислота, ЦОР (R = органильная группа).
Приложения [ править ]
Для реакций S N 2 алкиловые спирты также могут быть превращены в алкилтозилаты, часто путем добавления тозилхлорида. В этой реакции неподеленная пара спиртового кислорода атакует серу тозилхлорида, вытесняя хлорид и образуя тозилат с сохранением стереохимии реагента. Это полезно, потому что спирты являются плохими уходящими группами в реакциях S N 2, в отличие от тозилатной группы. Именно превращение алкиловых спиртов в алкилтозилаты позволяет реакции S N 2 протекать в присутствии хорошего нуклеофила.
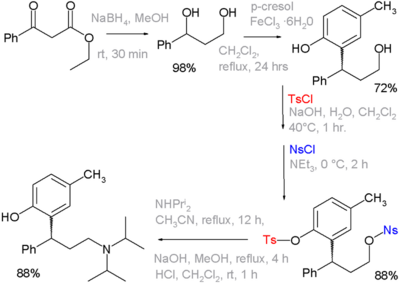
Тозильная группа может действовать как защитная группа в органическом синтезе. Спирты можно превратить в тозилатные группы, чтобы они не вступали в реакцию. Позднее тозилатная группа может быть превращена обратно в спирт. Использование этих функциональных групп проиллюстрировано в органическом синтезе лекарственного средства толтеродин , где на одной из стадий фенольная группа защищается как его тозилат, а первичный спирт - как его нозилат. Последняя представляет собой уходящую группу для замещения диизопропиламином : [1] [nb 2]
Тозильная группа также полезна в качестве защитной группы для аминов . Полученная сульфонамидная структура чрезвычайно устойчива. С него можно снять защиту для выявления амина в восстановительных или сильнокислых условиях. [2]
Аминная защита - тозил (Ц) [ править ]
Тозильная ( Ts ) группа обычно используется в качестве защитной группы для аминов в органическом синтезе .
Наиболее распространенные методы аминовой защиты [ править ]
Наиболее распространенные методы снятия защиты с аминов [ править ]
- HBr и уксусная кислота при 70 ° C [4]
- Кипячение с TMSCl , йодидом натрия и ацетонитрилом [5]
- Восстановление с помощью SmI 2 [6]
- Восстановление с помощью Red-Al [7]
Родственные соединения [ править ]
С тозилатами тесно связаны нозилаты и брозилаты , которые представляют собой сокращенные названия о- или п- нитробензолсульфонатов и п- бромбензолсульфонатов соответственно.
См. Также [ править ]
- Тозиловая кислота
- Сульфонильная группа
Заметки [ править ]
- ^ Не путать с синтетическим элементом теннессин
- ^ Последовательность реакции: органическое снижение по этилбензоилацетату с помощью боргидрида натрия к диолу,последующим Фриделя-Крафтс алкилированием с п-крезолом и хлоридом железа (III) до фенола. Тозильная и нозильная группы вводятся как их соответствующие хлориды с гидроксидом натрия или триэтиламином в качестве основания. Следующим шагом является нуклеофильное замещение нозильной группы диизопропиламином , оставшаяся тозильная группа удаляется еще однимцикломNaOH. Не показано: оптическое разрешение по L-винной кислоте в оптически чистый (R) -изомер
Ссылки [ править ]
- ^ Kathlia А. де Кастро; Джунгнам Ко; Парк Тэджонг; Парк Сондэ и Хакджуне Ри (2007). «Восстановление этилбензоилацетата и селективная защита 2- (3-гидрокси-1-фенилпропил) -4-метилфенола: новый и легкий синтез толтеродина». Для исследования и разработки органических процессов (статья ASAP)
|format=требуется|url=( помощь ) . 11 (5): 918. DOI : 10.1021 / op7001134 . - ^ Грин, TW; Wuts, МПГ (1999). Защитные группы в органическом синтезе . Нью-Йорк: Джон Вили и сыновья. С. 603–607. ISBN 9780471160199.
- ^ Wuts, Питер GM; Грин, Теодора В. (2006). Защитные группы Грина в органическом синтезе, четвертое издание - Wuts - онлайн-библиотека Wiley . DOI : 10.1002 / 0470053488 . ISBN 9780470053485.
- ^ Хаскелл, Бетти Э .; Bowlus, Стивен Б. (1976-01-01). «Новый синтез L-2-амино-3-оксалиламинопропионовой кислоты, нейротоксина Lathyrus sativus». Журнал органической химии . 41 (1): 159–160. DOI : 10.1021 / jo00863a042 . ISSN 0022-3263 . PMID 1244456 .
- ^ Сабита, Гоураварам; Редди, Б.В. Субба; Авраам, Санни; Ядав, JS (1999-02-19). «Снятие защиты сульфонамидов с помощью йодтриметилсилана». Буквы тетраэдра . 40 (8): 1569–1570. DOI : 10.1016 / S0040-4039 (98) 02646-X .
- ^ Ведейс, Эдвин; Линь, Шоучжун (апрель 1994 г.). «Снятие защиты аренсульфонамидов с помощью йодида самария» . Журнал органической химии . 59 (7): 1602–1603. DOI : 10.1021 / jo00086a005 . ISSN 0022-3263 .
- ↑ Gold, Elijah H .; Бабад, Эстер. (1972-06-01). «Восстановительное расщепление сульфонамидов бис (2-метоксиэтокси) алюмогидридом натрия» . Журнал органической химии . 37 (13): 2208–2210. DOI : 10.1021 / jo00978a034 . ISSN 0022-3263 .