 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 1,4,7,10,13,16-гексаоксациклооктадекан | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| 1619616 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.037.687 |
| Номер ЕС |
|
| 4535 | |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| С 12 Н 24 О 6 | |
| Молярная масса | 264,315 г / моль |
| Плотность | 1,237 г / см 3 |
| Температура плавления | От 37 до 40 ° C (от 99 до 104 ° F; от 310 до 313 K) |
| Точка кипения | 116 ° С (241 ° F, 389 К) (0,2 торр) |
| 75 г / л | |
| Опасности | |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H302 , H315 , H319 , H335 | |
| Р261 , Р264 , Р270 , Р271 , Р280 , Р301 + 312 , P302 + 352 , Р304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
| Родственные соединения | |
Родственные соединения | Дибензо-18-краун-6 Триглим Гексааза-18-краун-6 |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
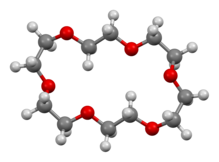
18-Краун-6 представляет собой органическое соединение с формулой [C 2 H 4 O] 6 и названием IUPAC 1,4,7,10,13,16-гексаоксациклооктадекан. Это белое гигроскопичное кристаллическое вещество с низкой температурой плавления. [1] Как и другие краун-эфиры , 18-краун-6 действует как лиганд для некоторых катионов металлов с особым сродством к катионам калия ( константа связывания в метаноле : 10 6 M -1 ). Очковая группа 18-краун-6 - S 6. Дипольный момент 18-краун-6 варьируется в зависимости от растворителя и при разной температуре. При температуре 25 ° C дипольный момент 18-краун-6 составляет 2,76 ± 0,06 Д в циклогексане и 2,73 ± 0,02 в бензоле. [2] Синтез крауна - эфиры привели к присуждению Нобелевской премии по химии в Чарлз Педерсен .
Синтез [ править ]
Это соединение получают модифицированным синтезом эфира Вильямсона в присутствии катиона-шаблона: [3] Его также можно получить олигомеризацией этиленоксида : [1]
- (CH 2 OCH 2 CH 2 Cl) 2 + (CH 2 OCH 2 CH 2 OH) 2 + 2 KOH → (CH 2 CH 2 O) 6 + 2 KCl + 2 H 2 O
Его можно очистить дистилляцией , где становится очевидной его склонность к переохлаждению. 18-Краун-6 также можно очистить перекристаллизацией из горячего ацетонитрила . Первоначально он образует нерастворимый сольват. [3] Твердо сухой материал может быть получен путем растворения соединения в ТГФ с последующим добавлением NaK с получением [K (18-краун-6)] Na, щелочной соли. [4]
Кристаллографический анализ показывает относительно плоскую молекулу, но такую, в которой кислородные центры не ориентированы в обычно показанной идеализированной 6-кратной симметричной геометрии. [5] Молекула претерпевает значительные конформационные изменения при комплексообразовании.
Реакции [ править ]
18-Краун-6 имеет высокое сродство к иону гидроксония H 3 O + , так как он может помещаться внутри краун-эфира. Таким образом, реакция 18-краун-6 с сильными кислотами дает катион . Например, взаимодействие 18-краун-6 с газообразным HCl в толуоле с небольшой влажностью дает слой ионной жидкости с составом , из которого можно выделить твердое вещество при стоянии. Реакция слоя ионной жидкости с двумя молярными эквивалентами воды дает кристаллический продукт . [1] [6] [7]
Приложения [ править ]
- 18-краун-6 комплекс с ионом калия
18-Краун-6 связывается с множеством небольших катионов, используя все шесть атомов кислорода в качестве донорных атомов. Краун-эфиры могут использоваться в лаборатории в качестве катализаторов межфазного переноса . [8] Соли, которые обычно нерастворимы в органических растворителях, становятся растворимыми краун-эфиром. Например, перманганат калия растворяется в бензоле в присутствии 18-краун-6, давая так называемый «пурпурный бензол», который можно использовать для окисления различных органических соединений. [1]
Различные реакции замещения также ускоряются в присутствии 18-краун-6, который подавляет образование ионных пар. [9] Таким образом, анионы становятся голыми нуклеофилами . Например, при использовании 18-краун-6 ацетат калия является более мощным нуклеофилом в органических растворителях: [1]
- [K (18-краун-6) + ] OAc - + C 6 H 5 CH 2 Cl → C 6 H 5 CH 2 OAc + [K (18-краун-6) + ] Cl -
Первая соль- электрид, которая будет исследована с помощью рентгеновской кристаллографии , [Cs (18-краун-6) 2 ] + · e - , была синтезирована в 1983 году. Это твердое вещество с высокой чувствительностью к воздуху и влаге имеет трехслойную молекулярную структуру, где электрон захвачен в полостях почти сферической решетки. Однако кратчайшее расстояние между электронами слишком велико (8,68 Å), чтобы сделать этот материал проводником электричества. [1]
Ссылки [ править ]
- ^ a b c d e f Стид, Джонатан В .; Этвуд, Джерри Л. (2009). Супрамолекулярная химия (2-е изд.). Вайли. ISBN 978-0-470-51233-3.
- ^ Caswell, Lyman R .; Саваннант, Диана С. (январь 1988 г.). «Влияние температуры и растворителя на экспериментальные дипольные моменты трех краун-эфиров». J. Heterocyclic Chem . 25 (1): 73–79. DOI : 10.1002 / jhet.5570250111 .
- ^ a b Гокель, Джордж В .; Крам, Дональд Дж .; Liotta, Charles L .; Харрис, Генри П .; Кук, Фред Л. (1977). «18-Корона-6». Орг. Synth . 57 : 30. DOI : 10,15227 / orgsyn.057.0030 .
- ^ Джилек, Роберт Э .; Фишер, Пол Дж .; Эллис, Джон Э. (2014). Бис (1,2-бис (диметилфосфано) этан) трикарбонилтитан (0) и гексакарбонилтитанат (2-) . Неорганические синтезы. 36 . С. 127–134. DOI : 10.1002 / 9781118744994.ch24 . ISBN 9781118744994.
- ^ Дуниц, JD; Зайлер, П. (1974). «1,4,7,10,13,16-Гексаоксациклооктадекан». Acta Crystallogr . В30 (11): 2739. DOI : 10,1107 / S0567740874007928 .
- ^ Этвуд, Джерри L .; Ботт, Саймон Дж .; Коулман, Энтони У .; Робинсон, Керри Д.; Точильный камень, Стивен Б.; Значит, К. Митчелл (декабрь 1987 г.). «Катион оксония в ароматических растворителях. Синтез, структура и поведение раствора ». Журнал Американского химического общества . 109 (26): 8100–8101. DOI : 10.1021 / ja00260a033 .
- ^ Этвуд, Джерри L .; Ботт, Саймон Дж .; Значит, К. Митчелл; Коулман, Энтони У .; Чжан, Хунмин; Мэй, Майкл Т. (февраль 1990 г.). «Синтез солей аниона дихлористого водорода в ароматических растворителях. 2. Синтезы, кристаллические структуры и родственные им ». Неорганическая химия . 29 (3): 467–470. DOI : 10.1021 / ic00328a025 .
- ^ Лиотта, CL; Беркнерин, Дж. (2004). «18-Корона-6». В пакете, Л. (ред.). Энциклопедия реагентов для органического синтеза, 8 томов . Энциклопедия реагентов для органического синтеза . Нью-Йорк: J. Wiley & Sons. DOI : 10.1002 / 047084289X.rc261 . ISBN 0471936235.
- ^ Кук, Фред L .; Бауэрс, Чонси У .; Лиотта, CL (ноябрь 1974 г.). «Химия голых анионов. III. Реакции комплекса 18-краун-6 цианида калия с органическими субстратами в апротонных органических растворителях». Журнал органической химии . 39 (23): 3416–3418. DOI : 10.1021 / jo00937a026 .
Внешние ссылки [ править ]
- Химический профиль Sigma Aldrich
![{\ displaystyle {\ ce {[H3O.18-crown-6] +}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05959c612544dc9b3cb3553c23497b6cb0b79eae)
![{\ displaystyle {\ ce {[H3O.18-crown-6] + [HCl2] ^ {-}.}} 3.8 {\ ce {C6H5Me}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6c99a07eb7055bb324034bb06c5b326acac2040)
![{\ displaystyle {\ ce {[H3O.18-crown-6] + [HCl2] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a39f9fa425e04e4fb9893a6534ec9ebe14ec13d)
![{\ displaystyle {\ ce {(H5O2) [H3O.18-crown-6] Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea4d202cf03dca6460e22c323e76cdeaa4e4da33)
![{\ Displaystyle {\ ce {[H3O + 0,18-корона-6] [Cl-H-Cl]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/570b60b09f20cda7d97987382a006e776dd9ed9e)
![{\ displaystyle {\ ce {[K.18-crown-6] [Cl-H-Cl]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/033a571d20719af08d7a5198f57da59afc23a226)
![{\ displaystyle {\ ce {[Mg.18-crown-6] [Cl-H-Cl] 2}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/abf6c19ea8d8195eea1d4679f2a696d69feb2f72)
![{\ displaystyle {\ ce {[H3O.18-crown-6] [Cl-H-Cl]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53c829dc937cd5208e3ccb616bdddf618c8b6332)
![{\ displaystyle {\ ce {[H3O.18-crown-6] [Br-H-Br]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1dbd94a5bd7bbec553563db4f4df5d9496b9cf1)