| Белки AP-1 (Fos, ATF, JDP) | |
|---|---|
| Идентификаторы | |
| Символ | АП-1 |
| ИнтерПро | IPR000837 |
| Фактор транскрипции Jun | |
|---|---|
| Идентификаторы | |
| Символ | Leuzip_Jun |
| ИнтерПро | IPR002112 |
Белок-активатор 1 (AP-1) представляет собой фактор транскрипции, который регулирует экспрессию генов в ответ на различные стимулы, включая цитокины , факторы роста , стресс, а также бактериальные и вирусные инфекции. [1] AP-1 контролирует ряд клеточных процессов, включая дифференцировку , пролиферацию и апоптоз . [2] AP-1 представляет собой гетеродимер, состоящий из белков, принадлежащих семействам c-Fos , c-Jun , ATF и JDP .
История [ править ]
AP-1 был впервые обнаружен как TPA-активируемый фактор транскрипции, который связывается с цис-регуляторным элементом промотора человеческого металлотионеина IIa ( hMTIIa ) и SV40 . [3] Сайт связывания AP-1 был идентифицирован как ответный элемент (TRE) 12-O-тетрадеканоилфорбол-13-ацетата ( TPA ) с консенсусной последовательностью 5'-TGA G / C TCA-3 '. [4] AP-1 - субъединица июня был идентифицирован как роман онкобелок из птичьего вируса саркомы, а связанный с Fos белок p39 был идентифицирован как транскрипт клеточного гена Jun. Впервые Fos был выделен как клеточный гомолог двух вирусных онкогенов v-fos, оба из которых вызывают остеосаркому у мышей и крыс. [5] С момента своего открытия было обнаружено, что AP-1 связан с многочисленными регуляторными и физиологическими процессами, и новые связи все еще исследуются.
Структура [ править ]
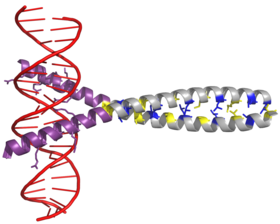
Фактор транскрипции AP-1 собирается посредством димеризации характерного домена bZIP ( основной области лейциновой молнии ) в субъединицах Fos и Jun . Типичный домен bZIP состоит из области « лейциновой молнии » и «основной области». Лейциновая молния отвечает за димеризацию белковых субъединиц Jun и Fos . Этот структурный мотив скручивает два альфа-спиральных белковых домена в « спиральную спираль », характеризующуюся периодичностью 3,5 остатка на виток и повторяющимися лейцинами, появляющимися в каждом седьмом положении полипептидной цепи.. Благодаря аминокислотной последовательности и периодичности спиралей боковые цепи лейцина расположены вдоль одной стороны α-спирали и образуют гидрофобную поверхность, которая модулирует димеризацию. [6] Гидрофобные остатки в дополнение к лейцину также образуют характерные 3-4 повтора α-спиралей, участвующих во взаимодействиях «спираль-спираль», и способствуют гидрофобной упаковке, которая управляет димеризацией. Вместе эта гидрофобная поверхность удерживает две субъединицы вместе. [7] [8]
Основная область домена bZIP находится прямо перед лейциновой застежкой-молнией и содержит положительно заряженные остатки. Эта область взаимодействует с сайтами-мишенями ДНК . [9] Помимо «лейциновой молнии» и «основной области», которые важны для димеризации и связывания ДНК, белок c-jun содержит три короткие области, которые состоят из кластеров отрицательно заряженных аминокислот на его N-конце. половина из них важна для активации транскрипции in vivo. [10]
Димеризация происходит между продуктами протоонкогенов c-jun и c-fos и необходима для связывания ДНК. Белки Jun могут образовывать как гомо-, так и гетеродимеры и, следовательно, сами по себе способны связываться с ДНК. Однако белки Fos не димеризуются друг с другом и поэтому могут связываться с ДНК только при связывании с Jun. [11] [12] Гетеродимер Jun-Fos более стабилен и имеет более высокую ДНК-связывающую активность, чем гомодимеры Jun.
Функция [ править ]
Было показано, что фактор транскрипции AP-1 участвует в широком спектре клеточных процессов, включая рост , дифференцировку и апоптоз клеток . Активность AP-1 часто регулируется с помощью посттрансляционных модификаций , состава димеров связывания ДНК и взаимодействия с различными партнерами связывания. Факторы транскрипции AP-1 также связаны с многочисленными физиологическими функциями, особенно в определении продолжительности жизни организмов и регенерации тканей . Ниже приведены некоторые другие важные функции и биологические роли, в которых, как было показано, участвуют факторы транскрипции AP-1.
Рост, пролиферация и старение клеток [ править ]
Было показано, что фактор транскрипции AP-1 играет многочисленные роли в росте и пролиферации клеток. В частности, c-Fos и c-Jun, по-видимому, являются основными участниками этих процессов. Было показано, что C-jun важен для пролиферации фибробластов [13], а уровни обеих субъединиц AP-1, как было показано, экспрессируются выше базальных уровней во время деления клеток . [14] Было также показано, что C-fos увеличивает экспрессию в ответ на введение факторов роста в клетку, что дополнительно подтверждает его предполагаемое участие в клеточном цикле. Факторы роста TGF альфа , TGF бета и IL2все они стимулируют c-Fos и тем самым стимулируют клеточную пролиферацию через активацию AP-1. [10]
Клеточное старение было идентифицировано как «динамический и обратимый процесс, регулируемый (не) активацией заранее определенного энхансерного ландшафта, контролируемого первым фактором транскрипции AP-1», который «определяет организационные принципы сети факторов транскрипции, которая управляет программой транскрипции. стареющих клеток ». [15] [16]
Клеточная дифференциация [ править ]
Транскрипция AP-1 глубоко вовлечена в модуляцию экспрессии генов . Изменения в экспрессии клеточных генов при инициации синтеза ДНК и образовании дифференцированных производных могут привести к клеточной дифференцировке . [10] Было показано, что AP-1 участвует в дифференцировке клеток в нескольких системах. Например, образуя стабильные гетеродимеры с c-Jun, область bZIP c-Fos увеличивает связывание c-Jun с генами-мишенями, активация которых участвует в дифференцировке фибробластов куриного эмбриона (CEF). [17]
Апоптоз [ править ]
Фактор транскрипции AP-1 связан с широким спектром взаимодействий, связанных с апоптозом . Активность AP-1 индуцируется множеством внеклеточного матрикса и генотоксическими агентами , что предполагает участие в запрограммированной гибели клеток . [2] Многие из этих стимулов активируют N-концевые киназы c-Jun (JNK), что приводит к фосфорилированию белков Jun и усилению транскрипционной активности AP-1-зависимых генов. [2]Сообщалось об увеличении уровней белков Jun и Fos и активности JNK в сценариях, в которых клетки подвергаются апоптозу. Например, инактивированные клетки c-Jun-ER демонстрируют нормальную морфологию, в то время как активированные c-Jun-ER клетки обладают апоптозом. [18]
Регулирование AP-1 [ править ]
Повышенные уровни AP-1 приводят к усилению трансактивации экспрессии целевого гена. Следовательно, регуляция активности AP-1 имеет решающее значение для функции клетки и происходит посредством специфических взаимодействий, контролируемых димерным составом, транскрипционными и посттрансляционными событиями, а также взаимодействием с дополнительными белками. [19]
Функции AP-1 сильно зависят от конкретных субъединиц Fos и Jun, вносящих вклад в димеры AP-1. [10] Результат активации AP-1 зависит от сложных комбинаторных паттернов димеров компонентов AP-1. [2] Комплекс AP-1 связывается с палиндромным мотивом ДНК (5'-TGA G / C TCA-3 '), чтобы регулировать экспрессию гена, но специфичность зависит от димерного состава субъединицы bZIP. [2]
Физиологическое значение [ править ]
Было показано, что фактор транскрипции AP-1 участвует в физиологии кожи, в частности, в регенерации тканей . Процесс метаболизма кожи запускается сигналами, которые заставляют недифференцированные пролиферативные клетки подвергаться клеточной дифференцировке. Следовательно, активность субъединиц AP-1 в ответ на внеклеточные сигналы может быть изменена в условиях, когда баланс пролиферации и дифференцировки кератиноцитов должен быстро и временно изменяться. [20] Фактор транскрипции AP-1 также участвует в росте клеток рака молочной железы посредством множества механизмов, включая регуляцию циклина D1 , E2F.факторы и их гены-мишени. c-Jun, который является одной из субъединиц AP-1, регулирует рост клеток рака груди. Активированный c-Jun преимущественно экспрессируется на инвазивном фронте рака груди и связан с пролиферацией клеток груди. [21] Благодаря регуляторным функциям AP-1 в раковых клетках, модуляция AP-1 изучается как потенциальная стратегия профилактики и лечения рака. [22] [23] [24]
Regulome [ править ]
См. Также [ править ]
- Белок-активатор
- Фактор транскрипции
Ссылки [ править ]
- ^ Гесс Дж, ангел Р, Schorpp-Кистнер М (декабрь 2004 г.). «Подразделения АП-1: ссора и согласие между братьями и сестрами» . Журнал клеточной науки . 117 (Pt 25): 5965–73. DOI : 10,1242 / jcs.01589 . PMID 15564374 .
- ^ a b c d e Ameyar M, Wisniewska M, Weitzman JB (август 2003 г.). «Роль AP-1 в апоптозе: аргументы за и против». Биохимия . 85 (8): 747–52. DOI : 10.1016 / j.biochi.2003.09.006 . PMID 14585541 .
- ^ Ли Вт, Хаслингер А, Карин М, Tjian Р (январь 1987). «Активация транскрипции двумя факторами, которые связывают промоторные и энхансерные последовательности гена металлотионеина человека и SV40». Природа . 325 (6102): 368–72. Bibcode : 1987Natur.325..368L . DOI : 10.1038 / 325368a0 . PMID 3027570 . S2CID 4314423 .
- ↑ Angel P, Imagawa M, Chiu R, Stein B, Imbra RJ, Rahmsdorf HJ, Jonat C, Herrlich P, Karin M (июнь 1987). «Гены, индуцируемые сложным эфиром форбола, содержат общий цис-элемент, распознаваемый TPA-модулируемым транс-действующим фактором». Cell . 49 (6): 729–39. DOI : 10.1016 / 0092-8674 (87) 90611-8 . PMID 3034432 . S2CID 23154076 .
- Перейти ↑ Wagner EF (апрель 2001 г.). «АП-1 - Вступительное слово» . Онкоген . 20 (19): 2334–5. DOI : 10.1038 / sj.onc.1204416 . PMID 11402330 .
- ^ Landschulz WH, Джонсон PF, МакНайт SL (июнь 1988). «Лейциновая молния: гипотетическая структура, общая для нового класса ДНК-связывающих белков». Наука . 240 (4860): 1759–64. Bibcode : 1988Sci ... 240.1759L . DOI : 10.1126 / science.3289117 . PMID 3289117 .
- Перейти ↑ O'Shea EK, Rutkowski R, Kim PS (январь 1989). «Доказательство того, что лейциновая молния свернута в спираль». Наука . 243 (4890): 538–42. Bibcode : 1989Sci ... 243..538O . DOI : 10.1126 / science.2911757 . PMID 2911757 .
- Перейти ↑ O'Shea EK, Rutkowski R, Stafford WF, Kim PS (август 1989). «Предпочтительное образование гетеродимера изолированными лейциновыми застежками-молниями из fos и jun». Наука . 245 (4918): 646–8. Bibcode : 1989Sci ... 245..646O . DOI : 10.1126 / science.2503872 . PMID 2503872 .
- Перейти ↑ Vogt PK, Bos TJ (1990). «Джун: онкоген и фактор транскрипции». Достижения в исследованиях рака . 55 : 1–35. DOI : 10.1016 / s0065-230x (08) 60466-2 . ISBN 9780120066551. PMID 2166997 .
- ^ a b c d Ангел П., Карин М. (декабрь 1991 г.). «Роль Jun, Fos и комплекса AP-1 в пролиферации и трансформации клеток». Biochimica et Biophysica Acta (BBA) - Обзоры рака . 1072 (2–3): 129–57. DOI : 10.1016 / 0304-419X (91) 90011-9 . PMID 1751545 .
- ^ Kouzarides T, Ziff E (декабрь 1988). «Роль лейциновой молнии во взаимодействии фос-джун». Природа . 336 (6200): 646–51. Bibcode : 1988Natur.336..646K . DOI : 10.1038 / 336646a0 . PMID 2974122 . S2CID 4355663 .
- ^ Nakabeppu Y, Ryder K, Натанс D (декабрь 1988). «ДНК-связывающая активность трех мышей Jun белков: стимуляция Fos». Cell . 55 (5): 907–15. DOI : 10.1016 / 0092-8674 (88) 90146-8 . PMID 3142691 . S2CID 11057487 .
- Перейти ↑ Karin M, Liu Z, Zandi E (апрель 1997 г.). «Функционирование и регулирование АП-1». Текущее мнение в клеточной биологии . 9 (2): 240–6. DOI : 10.1016 / S0955-0674 (97) 80068-3 . PMID 9069263 .
- Перейти ↑ Yamashita J, McCauley LK (2006). «Активирующий транскрипционный комплекс протеина-1: важные и многогранные роли в костях». Клинические обзоры костного и минерального метаболизма . 4 (2): 107–122. DOI : 10.1385 / BMM: 4: 2: 107 . S2CID 90318354 .
- ^ Zumerle S, Alimonti А (2020). «Вход и выход из старения» . Nat Cell Biol . 22 (7): 753–754. DOI : 10.1038 / s41556-020-0540-х . PMID 32591745 . S2CID 220071911 .
- ^ Мартинес-Самудио Р., Ру П., де Фрейтас Дж и др. (2020). «AP-1 импринтирует обратимую программу транскрипции стареющих клеток» . Nat Cell Biol . 22 (7): 842–855. DOI : 10.1038 / s41556-020-0529-5 . PMC 7899185 . PMID 32514071 . S2CID 219543898 .
- ^ Shaulian E, Karin M (май 2002). «AP-1 как регулятор жизни и смерти клеток». Природа клеточной биологии . 4 (5): E131–6. DOI : 10.1038 / ncb0502-E131 . PMID 11988758 . S2CID 34337538 .
- ^ Босси-Ветцель E, Bakiri L, Янов M (апрель 1997). «Индукция апоптоза фактором транскрипции c-Jun» . Журнал EMBO . 16 (7): 1695–709. DOI : 10.1093 / emboj / 16.7.1695 . PMC 1169773 . PMID 9130714 .
- ^ Vesely PW, Staber PB, Hoefler G, L Кеннер (июль 2009). «Механизмы регуляции трансляции белков AP-1». Мутационные исследования . 682 (1): 7–12. DOI : 10.1016 / j.mrrev.2009.01.001 . PMID 19167516 .
- ^ Angel P, Szabowski A, Schorpp-Kistner M (апрель 2001). «Функция и регуляция субъединиц AP-1 в физиологии и патологии кожи» . Онкоген . 20 (19): 2413–23. DOI : 10.1038 / sj.onc.1204380 . PMID 11402337 .
- ↑ Шен Кью, Урай И.П., Ли Й, Криско Т.И., Стрекер Т.Э., Ким Х.Т., Браун PH (январь 2008 г.). «Фактор транскрипции AP-1 регулирует рост клеток рака груди с помощью циклинов и факторов E2F» . Онкоген . 27 (3): 366–77. DOI : 10.1038 / sj.onc.1210643 . PMID 17637753 .
- ^ Eferl R, Wagner EF (ноябрь 2003). «АП-1: палка о двух концах в онкогенезе». Обзоры природы. Рак . 3 (11): 859–68. DOI : 10.1038 / nrc1209 . PMID 14668816 . S2CID 35328722 .
- ^ Тевари D, Nabavi SF, Nabavi SM, Sureda A, Фаруки А.А., Атанасов А.Г., Вакка Р.А., Sethi G, Bishayee A (февраль 2018). «Нацеливание на сигнальный путь белка-активатора 1 биоактивными природными агентами: возможная терапевтическая стратегия для профилактики рака и вмешательства». Фармакологические исследования . 128 : 366–375. DOI : 10.1016 / j.phrs.2017.09.014 . PMID 28951297 . S2CID 20160666 .
- ^ Kamide Д, Ямашит Т, Араки К, Tomifuji М, Танака Y, Танака S, S Сиодзава, Шиотань А (Май 2016). «Селективный активаторный ингибитор протеина-1 Т-5224 предотвращает метастазирование в лимфатические узлы на модели рака полости рта» . Наука о раке . 107 (5): 666–73. DOI : 10.1111 / cas.12914 . PMC 4970834 . PMID 26918517 .
- ^ Проффитт Дж, Кребтри G, М - Гроув, Daubersies Р, Bailleul В, Райт Е, Пламб М (январь 1995). «Сайт связывания ATF / CREB необходим для клеточно-специфической и индуцибельной транскрипции гена мышиного цитокина MIP-1 бета». Джин . 152 (2): 173–9. DOI : 10.1016 / 0378-1119 (94) 00701-S . PMID 7835696 .
- ^ Rainio Е.М., Sandholm J, Koskinen PJ (февраль 2002). «Передний край: транскрипционная активность NFATc1 усиливается киназой Pim-1» . Журнал иммунологии . 168 (4): 1524–7. DOI : 10.4049 / jimmunol.168.4.1524 . PMID 11823475 .
- ^ Sanyal S, Сандстром DJ, Hoeffer CA, Ramaswami M (апрель 2002). «AP-1 функционирует выше CREB, чтобы контролировать синаптическую пластичность у Drosophila». Природа . 416 (6883): 870–4. Bibcode : 2002Natur.416..870S . DOI : 10.1038 / 416870a . PMID 11976688 . S2CID 4329320 .
- Перейти ↑ Hirayama J, Cardone L, Doi M, Sassone-Corsi P (июль 2005 г.). «Общие пути в часах циркадного и клеточного цикла: светозависимая активация Fos / AP-1 у рыбок данио контролирует CRY-1a и WEE-1» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (29): 10194–9. Bibcode : 2005PNAS..10210194H . DOI : 10.1073 / pnas.0502610102 . PMC 1177375 . PMID 16000406 .
- ↑ Wai PY, Mi Z, Gao C, Guo H, Marroquin C, Kuo PC (июль 2006 г.). «Ets-1 и runx2 регулируют транскрипцию метастатического гена остеопонтина в клетках колоректального рака мыши» . Журнал биологической химии . 281 (28): 18973–82. DOI : 10.1074 / jbc.M511962200 . PMID 16670084 .
- ^ Коллинз-Hicok Дж, Лин л, Спиро С, Лейборн PJ, Tschumper R, Rapacz В, МакМаррей КТ (май 1994 г.). «Индукция гена продинорфина крысы через Gs-сопряженные рецепторы может включать зависимую от фосфорилирования дерепрессию и активацию» . Молекулярная и клеточная биология . 14 (5): 2837–48. DOI : 10,1128 / MCB.14.5.2837 . PMC 358652 . PMID 8164647 .
- ^ a b Берен А., Саймон С., Шваб Р.М., Лётч Э., Бродбек С., Хубер Э., Штубенраух Ф., Зеннер Х.П., Ифтнер Т. (декабрь 2005 г.). «Белок папилломавируса E2 индуцирует экспрессию матриксной металлопротеиназы-9 через внеклеточный сигнальный путь киназы / активаторного белка-1» . Исследования рака . 65 (24): 11613–21. DOI : 10.1158 / 0008-5472.CAN-05-2672 . PMID 16357172 .
- ^ Хенниган РФ, Stambrook PJ (август 2001). «Доминантно-отрицательный c-jun ингибирует активацию киназных комплексов циклин D1 и циклин E» . Молекулярная биология клетки . 12 (8): 2352–63. DOI : 10.1091 / mbc.12.8.2352 . PMC 58599 . PMID 11514621 .
- ^ Knöchel S, Шулер-Metz А, Knöchel Вт (ноябрь 2000 г.). «c-Jun (AP-1) активирует транскрипцию BMP-4 у эмбрионов Xenopus». Механизмы развития . 98 (1-2): 29-36. DOI : 10.1016 / S0925-4773 (00) 00448-2 . PMID 11044605 . S2CID 18150052 .
- ^ a b Kidd M, Hinoue T, Eick G, Lye KD, Mane SM, Wen Y, Modlin IM (декабрь 2004 г.). «Анализ глобальной экспрессии клеток ECL в слизистой оболочке желудка Mastomys natalensis выявляет изменения в пути AP-1, индуцированные гастрином-опосредованной трансформацией». Физиологическая геномика . 20 (1): 131–42. DOI : 10.1152 / physiolgenomics.00216.2003 . PMID 15602048 .
- ^ Heim JM, Singh S, Fülle HJ, Gerzer R (январь 1992). «Сравнение клонированной ANF-чувствительной гуанилатциклазы (GC-A) с гуанилатциклазой в виде частиц из коры надпочечников». Архив фармакологии Наунин-Шмидеберг . 345 (1): 64–70. DOI : 10.1007 / BF00175471 . PMID 1347156 . S2CID 22605840 .
- ↑ Kuo YR, Wu WS, Wang FS (апрель 2007 г.). «Импульсный лазер на красителе с импульсной лампой подавляет экспрессию TGF-beta1, а пролиферация в культивируемых келоидных фибробластах опосредуется путем MAPK». Лазеры в хирургии и медицине . 39 (4): 358–64. DOI : 10.1002 / lsm.20489 . PMID 17457842 .
- ^ У J, Bresnick EH (март 2007). «Требование синергизма глюкокортикоидов и факторов роста для активации домена хроматина Notch4» . Молекулярная и клеточная биология . 27 (6): 2411–22. DOI : 10.1128 / MCB.02152-06 . PMC 1820485 . PMID 17220278 .
- ^ Martins G, Calame K (2008). «Регуляция и функции Blimp-1 в T- и B-лимфоцитах». Ежегодный обзор иммунологии . 26 : 133–69. DOI : 10.1146 / annurev.immunol.26.021607.090241 . PMID 18370921 .
- ^ Lunec Дж, Холлоуя К, М Кука, Эванс М (2003). «Редокс-регуляция репарации ДНК». БиоФакторы . 17 (1–4): 315–24. DOI : 10.1002 / biof.5520170131 . PMID 12897453 . S2CID 30654477 .
- ^ Manicassamy S, S Gupta, Huang Z, вс Z (июнь 2006). «Сигналы, опосредованные протеинкиназой С-тета, увеличивают выживаемость CD4 + Т-клеток за счет активации Bcl-xL» . Журнал иммунологии . 176 (11): 6709–16. DOI : 10.4049 / jimmunol.176.11.6709 . PMID 16709830 .
- ^ Ван Н, Верна L, S Харди, Forsayeth Дж, Чжу У, Stemerman МБ (сентябрь 1999 г.). «Опосредованная аденовирусом сверхэкспрессия c-Jun и c-Fos индуцирует межклеточную адгезию молекулы-1 и моноцитарного хемоаттрактантного белка-1 в эндотелиальных клетках человека» . Артериосклероз, тромбоз и биология сосудов . 19 (9): 2078–84. DOI : 10.1161 / 01.ATV.19.9.2078 . PMID 10479648 .
- ^ Фуджита S, Ито Т, Т Мицутани, Minoguchi S, Ямамити Н, Sakurai К, Iba Н (май 2008 г.). «Экспрессия гена miR-21, запускаемая AP-1, поддерживается посредством механизма двойной отрицательной обратной связи». Журнал молекулярной биологии . 378 (3): 492–504. DOI : 10.1016 / j.jmb.2008.03.015 . PMID 18384814 .
- ^ фон Кнетен A, Callsen D, Брюне B (февраль 1999 г.). «Активация NF-kappaB и AP-1 оксидом азота снижает апоптотическую гибель клеток в макрофагах RAW 264.7» . Молекулярная биология клетки . 10 (2): 361–72. DOI : 10.1091 / mbc.10.2.361 . PMC 25174 . PMID 9950682 .
- ^ Фелан JP, Миллсон SH, Parker PJ, Piper PW, Cooke FT (октябрь 2006). «Fab1p и AP-1 необходимы для доставки эндогенно убиквитилированных грузов в просвет вакуолей S. cerevisiae» . Журнал клеточной науки . 119 (Pt 20): 4225–34. DOI : 10,1242 / jcs.03188 . PMID 17003107 .
- ^ Ноласко LH, Turner Н.А., Бернардо А, Тао Z, Клири TG, Dong JF, Moake JL (декабрь 2005). «Токсины Шига, связанные с гемолитико-уремическим синдромом, способствуют секреции эндотелиальных клеток и нарушают расщепление ADAMTS13 необычно больших мультимеров фактора фон Виллебранда» . Кровь . 106 (13): 4199–209. DOI : 10.1182 / кровь-2005-05-2111 . PMC 1895236 . PMID 16131569 .
- ^ Hommura Р, Katabami М, компактнее В.Д., Donninger Н, Sumter TF, Resar Л.М., Birrer МДж (май 2004 г.). «HMG-I / Y представляет собой ген-мишень c-Jun / активаторный белок-1 и необходим для независимого от закрепления роста c-Jun в клетках Rat1a» . Молекулярные исследования рака . 2 (5): 305–14. PMID 15192124 .
- ^ Чанг CJ, Чао JC (апрель 2002). «Влияние материнского молока и эпидермального фактора роста на рост клеток Caco-2 кишечника человека». Журнал детской гастроэнтерологии и питания . 34 (4): 394–401. DOI : 10.1097 / 00005176-200204000-00015 . PMID 11930096 . S2CID 25446228 .
- ^ Вебер JR, Скин JH (июль 1998). «Активность очень беспорядочного элемента AP-1 может быть ограничена нейронами с помощью тканеселективного репрессивного элемента» . Журнал неврологии . 18 (14): 5264–74. DOI : 10.1523 / jneurosci.18-14-05264.1998 . PMC 6793474 . PMID 9651209 .
- ^ Ли W, Mitchell P, Tjian R (июнь 1987). «Очищенный фактор транскрипции AP-1 взаимодействует с TPA-индуцибельными энхансерными элементами». Cell . 49 (6): 741–52. DOI : 10.1016 / 0092-8674 (87) 90612-X . PMID 3034433 . S2CID 37036603 .
- ^ Cohen MP, Ziyadeh FN, Lautenslager GT, Cohen JA, Ширман CW (май 1999). «Стимуляция активности PKC-бета гликированным альбумином связана с повышенным содержанием коллагена IV в мезангиальных клетках» . Американский журнал физиологии . 276 (5 Pt 2): F684–90. DOI : 10.1152 / ajprenal.1999.276.5.F684 . PMID 10330050 .
- ^ Stark CJ, Atreya CD (апрель 2005). «Молекулярные достижения в клеточной биологии SARS-CoV и современные стратегии профилактики заболеваний» . Журнал вирусологии . 2 : 35. DOI : 10,1186 / 1743-422X-2-35 . PMC 1087510 . PMID 15833113 .
- ^ a b c Lane SJ, Adcock IM, Richards D, Hawrylowicz C, Barnes PJ, Lee TH (декабрь 1998 г.). «Резистентная к кортикостероидам бронхиальная астма связана с повышенной экспрессией c-fos в моноцитах и Т-лимфоцитах» . Журнал клинических исследований . 102 (12): 2156–64. DOI : 10.1172 / JCI2680 . PMC 509170 . PMID 9854051 .
- Перейти ↑ Steiner C, Peters WH, Gallagher EP, Magee P, Rowland I, Pool-Zobel BL (март 2007). «Генистеин защищает эпителиальные клетки молочной железы человека от генотоксичности бензо (а) пирен-7,8-дигидродиол-9,10-эпоксида и 4-гидрокси-2-ноненаля путем модуляции системы глутатион / глутатион S-трансферазы» . Канцерогенез . 28 (3): 738–48. DOI : 10.1093 / carcin / bgl180 . PMID 17065199 .
- ^ Ahn JD, Моришита R, Канэда Y, Ли KU, Парк JY, Джеон YJ, песни HS, Ли И.К. (июнь 2001). «Фактор транскрипции, приманка для белка-активатора-1 (AP-1) ингибирует индуцированную высоким уровнем глюкозы и ангиотензина II экспрессию гена ингибитора активатора плазминогена 1 типа (PAI-1) в культивируемых клетках гладких мышц сосудов человека» . Диабетология . 44 (6): 713–20. DOI : 10.1007 / s001250051680 . PMID 11440364 .
- Перейти ↑ Kang S, Fisher GJ, Voorhees JJ (ноябрь 2001 г.). «Фотостарение: патогенез, профилактика и лечение». Клиники гериатрической медицины . 17 (4): 643–59, v – vi. DOI : 10.1016 / S0749-0690 (05) 70091-4 . PMID 11535421 .
- ^ Navasa М, Гордон Д.А., Харихаран Н, Н Джамиль, Shigenaga Ю.К., Moser А, Фирс Вт, Поллок А, Грунфельд С, Феинголд КР (июнь 1998 г.). «Регулирование экспрессии мРНК микросомального белка переноса триглицеридов эндотоксином и цитокинами» . Журнал липидных исследований . 39 (6): 1220–30. PMID 9643353 .
- ^ Suetsugu M, Takano A, Nagai A, Takeshita A, Hirose K, Matsumoto K и др. (2007). «Ретиноевая кислота ингибирует стимулированный сывороткой активаторный белок-1 посредством подавления экспрессии генов c-fos и c-jun во время индуцированной витамином дифференциации клеток линии MC3T3-E1 клеток остеобластов мышей» (PDF) . J. Meikai Dent. Med . 36 (1): 42–50.
- ^ Inagi Р, Miyata Т, Nangaku М, Ueyama Н, Takeyama К, Като S, Курокава К (ноябрь 2002 г.). «Транскрипционная регуляция гена с преобладанием мезангиума, мегсина» . Журнал Американского общества нефрологов . 13 (11): 2715–22. DOI : 10.1097 / 01.ASN.0000033507.32175.FA . PMID 12397041 .
- ↑ Kim S, Yu SS, Lee IS, Ohno S, Yim J, Kim S, Kang HS (апрель 1999 г.). «Белок IE1 цитомегаловируса человека активирует AP-1 через клеточную протеинкиназу (ы)» . Журнал общей вирусологии . 80 (Pt 4) (4): 961–9. DOI : 10.1099 / 0022-1317-80-4-961 . PMID 10211966 .
- ^ Масуда А, Yoshikai Y, Кумэ Н, Matsuguchi Т (ноябрь 2004 г.). «Взаимодействие между белками GATA и белком-активатором-1 способствует транскрипции IL-13 в тучных клетках» . Журнал иммунологии . 173 (9): 5564–73. DOI : 10.4049 / jimmunol.173.9.5564 . PMID 15494506 .
- Перейти ↑ Navas TA, Baldwin DT, Stewart TA (ноябрь 1999 г.). «RIP2 представляет собой Raf1-активированную митоген-активированную протеинкиназу-киназу» . Журнал биологической химии . 274 (47): 33684–90. DOI : 10.1074 / jbc.274.47.33684 . PMID 10559258 .
- ^ Simantov R (август 1995). «Нейротранспортеры: регуляция, участие в нейротоксичности и полезность антисмысловых нуклеиновых кислот». Биохимическая фармакология . 50 (4): 435–42. DOI : 10.1016 / 0006-2952 (95) 00068-B . PMID 7646547 .
- ^ Ян HS, Jansen AP, Наир R, Shibahara K, Верма А.К., Cmarik JL, Colburn NH (февраль 2001). «Новый супрессор трансформации, Pdcd4, ингибирует трансактивацию AP-1, но не трансактивацию NF-kappaB или ODC» . Онкоген . 20 (6): 669–76. DOI : 10.1038 / sj.onc.1204137 . PMID 11314000 .
- ↑ Xie J, Pan H, Yoo S, Gao SJ (декабрь 2005 г.). «Индукция вируса герпеса, связанного с саркомой Капоши, AP-1 и интерлейкина 6 во время первичной инфекции, опосредованной множественными путями митоген-активируемых протеинкиназ» . Журнал вирусологии . 79 (24): 15027–37. DOI : 10,1128 / JVI.79.24.15027-15037.2005 . PMC 1316010 . PMID 16306573 .
- ^ Хан М.А., Bouzari S, Ма C, Розенбергер CM, Бергстрома KS, Gibson DL, Steiner TS, Валланс BA (апрель 2008). «Флагеллин-зависимые и независимые воспалительные реакции после инфицирования энтеропатогенными Escherichia coli и Citrobacter rodentium» . Инфекция и иммунитет . 76 (4): 1410–22. DOI : 10.1128 / IAI.01141-07 . PMC 2292885 . PMID 18227166 .
- ^ Кида Y, Иноуэ Н, Shimizu Т, Kuwano К (январь 2007 г.). «Серрализин Serratia marcescens вызывает воспалительные реакции через рецептор 2, активируемый протеазой» . Инфекция и иммунитет . 75 (1): 164–74. DOI : 10.1128 / IAI.01239-06 . PMC 1828393 . PMID 17043106 .
- ^ Gutzman JH, Rugowski DE, Schroeder MD, Уоттерс JJ, Шулер Л. (декабрь 2004). «Множественные каскады киназ опосредуют сигналы пролактина для активации белка-1 в клетках рака груди» . Молекулярная эндокринология . 18 (12): 3064–75. DOI : 10.1210 / me.2004-0187 . PMC 1634796 . PMID 15319452 .
- Перейти ↑ Brinkmann MM, Glenn M, Rainbow L, Kieser A, Henke-Gendo C, Schulz TF (сентябрь 2003 г.). «Активация митоген-активируемой протеинкиназы и путей NF-kappaB мембранным белком K15 герпесвируса, ассоциированным с саркомой Капоши» . Журнал вирусологии . 77 (17): 9346–58. DOI : 10,1128 / JVI.77.17.9346-9358.2003 . PMC 187392 . PMID 12915550 .
- ^ Гринштейн S, Ghias K, Krett NL, Розен ST (июнь 2002). «Механизмы глюкокортикоид-опосредованного апоптоза при гематологических злокачественных новообразованиях» . Клинические исследования рака . 8 (6): 1681–94. PMID 12060604 .
- ^ Yokoo T, Китамура M (май 1996). «Антиоксидант PDTC индуцирует экспрессию стромелизина в мезангиальных клетках через путь тирозинкиназы-AP-1». Американский журнал физиологии . 270 (5, часть 2): F806–11. DOI : 10.1152 / ajprenal.1996.270.5.F806 . PMID 8928842 .
- ^ Chang CF, Cho S, Ван J (апрель 2014). «(-) - Эпикатехин защищает геморрагический мозг через синергетические пути Nrf2» . Анналы клинической и трансляционной неврологии . 1 (4): 258–271. DOI : 10.1002 / acn3.54 . PMC 3984761 . PMID 24741667 .
- ^ Gibbings DJ, Ghetu AF, Dery R, Befus AD (февраль 2008). «Фактор ингибирования миграции макрофагов имеет мотив и функцию, подобную MHC I класса» . Скандинавский журнал иммунологии . 67 (2): 121–32. DOI : 10.1111 / j.1365-3083.2007.02046.x . PMID 18201367 .
- ^ База данных Uniprot
- ^ Hseu YC, Vudhya Gowrisankar Y, Chen XZ, Ян YC, Ян HL (февраль 2020). «Антивозрастная активность эрготионеина в УФА-облученных фибробластах кожи человека посредством ингибирования пути AP-1 и активации Nrf2-опосредованных антиоксидантных генов» . Oxid Med Cell Longev . 2020 (2576823): 1–13. DOI : 10.1155 / 2020/2576823 . PMC 7038158 . PMID 32104530 .
Внешние ссылки [ править ]
- NLM
- Генные карты
- Атлас генетики