Ароматизация - это химическая реакция, в которой ароматическая система образуется из одного неароматического предшественника. Обычно ароматизация достигается дегидрированием существующих циклических соединений, что иллюстрируется превращением циклогексана в бензол . Ароматизация включает образование гетероциклических систем. [1]
 Превращение метилциклогексана в толуол является классической реакцией ароматизации. Этот катализируемый платиной (Pt) процесс широко применяется в производстве бензина из нефти.
Превращение метилциклогексана в толуол является классической реакцией ароматизации. Этот катализируемый платиной (Pt) процесс широко применяется в производстве бензина из нефти.
Производственная практика [ править ]
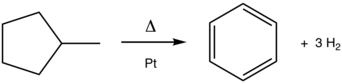
Хотя ароматизация не практикуется под этим названием, она является краеугольным камнем нефтепереработки . Одним из основных реакций реформинга является дегидрированием из нафтенов в ароматические соединения. Примером процесса, катализируемого платиной, является превращение метилциклогексана (нафтен) в толуол (ароматический компонент). [2] Дегидроциклизация превращает парафины (ациклические углеводороды) в ароматические соединения. [3] Соответствующий процесс ароматизации А включает дегидроизомеризацию из метилциклопентана в бензол:
Биохимические процессы [ править ]
Ароматазы - это ферменты, которые частично ароматизируют стероиды. Конкретные превращения тестостерона в эстрадиол и андростендиона в эстрон . [4] Каждая из этих aromatizations включает окисление С-19 метильной группы к муравьиной кислоте , чтобы обеспечить формирование ароматической системы, преобразования , которые являются необходимыми частями эстрогена tumorogenesis в развитии рака молочной железы и рака яичников в постменопаузе женщин и гинекомастия у мужчин. [5] Ингибиторы ароматазы , такие как экземестан (которых образует постоянное и деактивации связь с ферментом ароматазы) [6] и анастрозол и летрозол (который конкурировать за фермент) [7] было показано , что более эффективным , чем анти-эстроген лекарства , такие как тамоксифен , вероятно , потому что они предотвращают образование эстрадиола. [5]
Пути ароматизации [ править ]
Окислительное дегидрирование [ править ]
Для циклогексана, циклогексена и циклогексадиена дегидрирование является концептуально самым простым путем ароматизации. Барьер активации уменьшается со степенью ненасыщенности. Таким образом, циклогексадиены особенно подвержены ароматизации. Формально дегидрирование - это окислительно-восстановительный процесс. Дегидрогенизирующая ароматизация обратна гидрированию арена. По существу, катализаторы гидрирования эффективны для обратной реакции. Катализируемое платиной дегидрирование циклогексанов и родственного сырья является наиболее масштабным применением этой реакции (см. Выше). [1]
2,3-Дихлор-5,6-дициано-1,4-бензохинон (DDQ) часто является предпочтительным реагентом. DDQ и кислотный катализатор были использованы для синтеза стероида с фенантреновым ядром путем окисления, сопровождающегося двойной миграцией метила . [8] В процессе сам DDQ восстанавливается до ароматического гидрохинона .
Сера и селен традиционно используются при ароматизации, а уходящей группой является сероводород . [9]
Растворимые комплексы переходных металлов могут вызывать окислительную ароматизацию, сопровождающуюся комплексообразованием. α-фелландрен (2-метил-5- изопропил - пропил-1,3-циклогексадиен) окисляется до р - изо -propyltoluene с уменьшением рутений трихлорид . [10]
Окислительное дегидрирование дигидропиридина приводит к ароматизации с образованием пиридина . [11]
Обезвоживание [ править ]
Неароматические кольца можно ароматизировать разными способами. Обезвоживание позволяет Земмлер-Wolff преобразование 2-циклогексенон оксима в анилин в кислых условиях. [12]
Таутомеризация [ править ]
Изомеризации из циклогексадиенонов дает ароматическую таутомер фенол . [13] [14] Изомеризация 1,4-нафталиндиола при 200 ° C дает смесь 2: 1 с его кетоформой, 1,4-диоксотетралином. [15]
Абстракция гидридов и протонов [ править ]
Обычно реакции ароматизации включают изменение соотношения C: H в субстрате. При применении к циклопентадиену удаление протонов дает ароматический конъюгированный основание циклопентадиенильного аниона , выделяемого в виде циклопентадиенида натрия : [16]
- 2 Na + 2 C 5 H 6 → 2 NaC 5 H 5 + H 2
Ароматизация может повлечь за собой удаление гидрида. Тропилий, С
7ЧАС+
7 возникает в результате реакции ароматизации циклогептатриена с акцепторами гидрида.
- C
7ЧАС
8+ Br
2→ С
7ЧАС+
7+ Br-
+ HBr
Из ациклических предшественников [ править ]
Ароматизация ациклических предшественников встречается реже в органическом синтезе, хотя она является важным компонентом производства БТК на нефтеперерабатывающих заводах.
Среди ациклических предшественников алкины относительно склонны к ароматизации, поскольку они частично дегидрированы. Бергман циклизацией является преобразует энедииновый к dehydrobenzene промежуточного дирадикала, который абстрагирует водород ароматизировать. [17] Ендииновый фрагмент может быть включен в существующее кольцо, обеспечивая доступ к бициклической системе в мягких условиях, как следствие напряжения кольца в реагенте. Циклодека-3-ен-1,5-диин реагирует с 1,3-циклогексадиеном с образованием бензола и тетралина при 37 ° C, реакция очень благоприятна из-за образования двух новых ароматических колец:
См. Также [ править ]
- Ароматаза
- Ароматический углеводород
Ссылки [ править ]
- ^ а б Смит, Майкл Б .; Март, Джерри (2007), Расширенная органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Гэри, JH; Хандверк, GE (1984). Технология и экономика нефтепереработки (2-е изд.). Марсель Деккер, Inc. ISBN 0-8247-7150-8.
- Перейти ↑ Ono, Y. (1992). «Превращение низших алканов в ароматические углеводороды над цеолитами ZSM-5». Катал. Rev. - Sci. Англ . 34 (3): 179–226. DOI : 10.1080 / 01614949208020306 .
- ^ Lephart, ED (1996). «Обзор мозговой ароматазы цитохрома P450». Brain Res. Ред . 22 (1): 1-26. DOI : 10.1016 / 0165-0173 (96) 00002-1 . PMID 8871783 . S2CID 11987113 .
- ^ a b Avendaño, C .; Менендес, JC (2008). «Ингибиторы ароматазы» . Лечебная химия противоопухолевых препаратов . Эльзевир . С. 65–73. DOI : 10.1016 / B978-0-444-52824-7.00003-2 . ISBN 9780080559629.
- ^ Jasek, W., ed. (2007). Кодекс Австрии (на немецком языке) (62-е изд.). Вена: Österreichischer Apothekerverlag. С. 656–660. ISBN 9783852001814.
- ^ Dinnendahl, V .; Фрике, У., ред. (2007). Arzneistoff-Profile (на немецком языке). 4 (21-е изд.). Эшборн, Германия: Govi Pharmazeutischer Verlag. ISBN 9783774198463.
- ^ Браун, W .; Тернер, А.Б. (1971). "Применение высокопотенциальных хинонов. Часть VII. Синтез стероидных фенантренов путем двойной миграции метила". Журнал химического общества C: Organic . 14 : 2566–2572. DOI : 10.1039 / J39710002566 . PMID 5167256 .
- ^ Бергманн, Ф .; Szmuszkowicz, J .; Фаваз, Г. (1947). «Конденсация 1,1-диарилэтиленов с малеиновым ангидридом». Журнал Американского химического общества . 69 (7): 1773–1777. DOI : 10.1021 / ja01199a055 . PMID 20251415 .
- ^ Беннетт, Массачусетс; Хуанг, Теннесси; Мэтисон, TW; Смит, AK (1982). « Комплексы (η 6 -гексаметилбензол) рутения». Неорганические синтезы . 21 : 74–78. DOI : 10.1002 / 9780470132524.ch16 . ISBN 9780470132524.
- ^ Симидзу, S .; Watanabe, N .; Катаока, Т .; Shoji, T .; Abe, N .; Morishita, S .; Ичимура, Х. (2005). «Пиридин и производные пиридина». Энциклопедия промышленной химии Ульмана . Wiley-VCH . DOI : 10.1002 / 14356007.a22_399 . ISBN 3527306730.
- ^ Хорнинг, ЕС; Стромберг, ВЛ; Ллойд, HA (1952). «Перестановки Бекмана. Расследование особых случаев». Журнал Американского химического общества . 74 (20): 5153–5155. DOI : 10.1021 / ja01140a048 .
- ^ Clayden, J .; Greeves, N .; Уоррен, С .; Уотерс, П. (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета . п. 531 . ISBN 9780198503460. CS1 maint: discouraged parameter (link)
- ^ Capponi, M .; Кишечник, IG; Hellrung, B .; Перси, G .; Вирц, Дж. (1999). «Равновесия кетонизации фенола в водном растворе». Канадский химический журнал . 77 (5–6): 605–613. DOI : 10.1139 / CJC-77-5-6-605 .
- ^ Kündig, EP; Гарсия, AE; Lomberget, T .; Бернардинелли, Г. (2005). «Повторное открытие, выделение и асимметричное восстановление 1,2,3,4-тетрагидронафталин-1,4-диона и исследования его комплекса [Cr (CO) 3 ]». Angewandte Chemie International Edition . 45 (1): 98–101. DOI : 10.1002 / anie.200502588 . PMID 16304647 .
- ^ Хлопок, FA ; Уилкинсон, Г. (1999). Высшая неорганическая химия (6-е изд.). Джон Вили и сыновья . ISBN 9780471199571. CS1 maint: discouraged parameter (link)
- ^ Мохамед, РК; Петерсон, П. В.; Алабугин, И.В. (2013). «Согласованные реакции, которые производят дирадикалы и цвиттерионы: электронный, стерический, конформационный и кинетический контроль процессов циклоароматизации». Химические обзоры . 113 (9): 7089–7129. DOI : 10.1021 / cr4000682 . PMID 23600723 .