 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | / Æ м е ɛ т ə м я п / ( слушать ) |
| Торговые наименования | Evekeo, Adderall [примечание 1] , другие |
| Другие названия | α-метилфенэтиламин |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a616004 |
| Данные лицензии | |
| Ответственность за зависимость | Умеренный [1] |
| Ответственность за зависимость | Умеренный |
| Пути администрирования | Медицина: перорально , внутривенно [2] Рекреационная: перорально , инсуффляционная , ректальная , внутривенная , внутримышечная |
| Класс препарата | ЦНС стимулятор , анорексия |
| Код УВД | |
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Биодоступность | Орально: 75–100% [3] |
| Связывание с белками | 20% [4] |
| Метаболизм | CYP2D6 , [5] DBH , [13] [14] FMO3 [13] [15] [16] |
| Метаболиты | 4-гидроксиамфетамин , 4-гидроксиноэфедрин , 4-гидроксифенилацетон , бензойная кислота , гиппуровая кислота , норэфедрин , фенилацетон [5] [6] |
| Начало действия | ИК- дозирование: 30–60 минут [7] Дозирование XR : 1,5–2 часа [8] [9] |
| Ликвидация Период полураспада | D-амф . : 9–11 часов [5] [10] L-амф . : 11–14 часов [5] [10] pH- зависимый: 7–34 часа [11] |
| Продолжительность действия | Инфракрасное дозирование: 3–6 часов [1] [8] [12] Дозирование XR : 8–12 часов [1] [8] [12] |
| Экскреция | Преимущественно почечный ; pH- зависимый диапазон: 1–75% [5] |
| Идентификаторы | |
Название ИЮПАК
| |
| Количество CAS |
|
| PubChem CID |
|
| IUPHAR / BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| КЕГГ |
|
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| NIAID ChemDB |
|
| Панель управления CompTox ( EPA ) |
|
| ECHA InfoCard | 100,005,543 |
| Химические и физические данные | |
| Формула | C 9 H 13 N |
| Молярная масса | 135,210 г · моль -1 |
| 3D модель ( JSmol ) |
|
| Хиральность | Рацемическая смесь [17] |
| Плотность | 0,936 г / см 3 при 25 ° C [18] |
| Температура плавления | 11,3 ° C (52,3 ° F) (прогноз) [19] |
| Точка кипения | 203 ° C (397 ° F) при 760 мм рт. Ст. [20] |
Улыбки
| |
ИнЧИ
| |
| (проверять) | |
Амфетамин [примечание 2] (сократилась с более lpha - м этил тел ен и др HYL амина ) является центральной нервной системы (ЦНС) , стимулятор , который используется при лечении синдрома дефицита внимания с гиперактивностью (СДВГ), нарколепсии , и ожирения . Амфетамин был открыт в 1887 году и существует в виде двух энантиомеров : [примечание 3] левоамфетамин и декстроамфетамин . Амфетамин правильно относится к определенному химическому веществу, рацемическому свободному основанию., который представляет собой равные части двух энантиомеров, левоамфетамина и декстроамфетамина, в их чистых аминных формах. Термин часто используется неформально для обозначения любой комбинации энантиомеров или любого из них по отдельности. Исторически его использовали для лечения заложенности носа и депрессии. Амфетамин также используется как усилитель спортивных результатов и когнитивных способностей , а также в рекреационных целях как афродизиак и средство для эйфории . Во многих странах это лекарство, отпускаемое по рецепту , и несанкционированное хранение и распространение амфетамина часто строго контролируются из-за значительных рисков для здоровья, связанных с употреблением в рекреационных целях . [источники 1]
Первым амфетаминовым фармацевтическим препаратом был бензедрин , бренд, который использовался для лечения различных заболеваний. В настоящее время фармацевтический амфетамин назначается в виде рацемического амфетамина, аддералла , [примечание 4] декстроамфетамина или неактивного пролекарства лиздексамфетамина . Амфетамин увеличивает моноаминовую и возбуждающую нейротрансмиссию в головном мозге, причем его наиболее выраженные эффекты нацелены на системы нейротрансмиттеров норадреналина и дофамина . [источники 2]
В терапевтических дозах амфетамин вызывает эмоциональные и когнитивные эффекты, такие как эйфория , изменение желания секса , усиление бодрствования и улучшение когнитивного контроля . Он вызывает физические эффекты, такие как улучшенное время реакции, сопротивление усталости и увеличение мышечной силы. Большие дозы амфетамина могут ухудшить когнитивные функции и вызвать быстрое разрушение мышц . Зависимость представляет собой серьезный риск при частом употреблении амфетамина в рекреационных целях, но вряд ли возникнет при длительном медицинском употреблении в терапевтических дозах. Очень высокие дозы могут вызвать психоз (например, бред и паранойю).), что редко встречается в терапевтических дозах даже при длительном применении. Рекреационные дозы обычно намного больше, чем предписанные терапевтические дозы, и несут гораздо больший риск серьезных побочных эффектов. [источники 3]
Амфетамин относится к классу фенэтиламинов . Кроме того , исходное соединение своего собственного структурного класса, замещенных амфетаминов , [примечание 5] , который включает известные вещества , такие как бупропион , катинона , МДМА и метамфетамина . Как член класса фенэтиламинов, амфетамин также химически связан с естественными нейромодуляторами следовых аминов , в частности с фенэтиламином и N- метилфенэтиламином , оба из которых вырабатываются в организме человека. Фенэтиламин является исходным соединением амфетамина, а N-метилфенэтиламин - это позиционный изомер амфетамина, который отличается только расположением метильной группы . [источники 4]
Использует
Медицинское
Амфетамин используется для лечения синдрома дефицита внимания и гиперактивности (СДВГ), нарколепсии (нарушения сна) и ожирения , а иногда его назначают не по прямому назначению по прошлым медицинским показаниям , особенно при депрессии и хронической боли . [1] [33] [47] Известно, что длительное воздействие амфетамина в достаточно высоких дозах у некоторых видов животных вызывает аномальное развитие дофаминовой системы или повреждение нервов, [48] [49] но у людей с СДВГ фармацевтические амфетамины, в терапевтических дозах, по-видимому, улучшает развитие мозга и рост нервов.[50] [51] [52] Обзоры исследований магнитно-резонансной томографии (МРТ) показывают, что длительное лечение амфетамином уменьшает нарушения структуры и функций мозга, обнаруживаемые у субъектов с СДВГ, и улучшает функции в некоторых частях мозга, например как правое хвостатое ядро в базальных ганглиях . [50] [51] [52]
Обзоры клинических исследований стимуляторов установили безопасность и эффективность длительного непрерывного употребления амфетамина для лечения СДВГ. [41] [53] [54] Рандомизированные контролируемые испытания непрерывной терапии стимуляторами для лечения СДВГ в течение 2 лет продемонстрировали эффективность и безопасность лечения. [41] [53] Два обзора показали, что длительная непрерывная стимулирующая терапия при СДВГ эффективна для уменьшения основных симптомов СДВГ (например, гиперактивности, невнимательности и импульсивности), повышения качества жизни и успеваемости, а также улучшения в большом количестве функциональных исходов [примечание 6]по 9 категориям результатов, связанных с учёбой, антиобщественным поведением, вождением, немедикаментозным употреблением наркотиков, ожирением, родом занятий, самооценкой, использованием услуг (например, академические, профессиональные, медицинские, финансовые и юридические услуги) и социальной функцией. [41] [54] В одном обзоре освещено девятимесячное рандомизированное контролируемое исследование амфетаминового лечения СДВГ у детей, в котором было обнаружено среднее повышение IQ на 4,5 балла, постоянное повышение внимания и продолжающееся снижение разрушительного поведения и гиперактивности. [53] Другой обзор показал, что на основании самых длительных последующих исследованийпроведенная на сегодняшний день терапия стимуляторами в течение всей жизни, которая начинается в детстве, постоянно эффективна для контроля симптомов СДВГ и снижает риск развития расстройства, связанного с употреблением психоактивных веществ, во взрослом возрасте. [41]
Современные модели СДВГ предполагают, что он связан с функциональными нарушениями в некоторых системах нейротрансмиттеров мозга ; [55] эти функциональные нарушения включают нарушение нейротрансмиссии дофамина в мезокортиколимбической проекции и нейротрансмиссии норадреналина в норадренергических проекциях от голубого пятна до префронтальной коры . [55] Психостимуляторы, такие как метилфенидат и амфетамин, эффективны при лечении СДВГ, поскольку они увеличивают активность нейротрансмиттеров в этих системах. [24] [55] [56]Примерно 80% тех, кто использует эти стимуляторы, видят улучшение симптомов СДВГ. [57] Дети с СДВГ, принимающие стимулирующие препараты, обычно лучше общаются со сверстниками и членами семьи, лучше учатся в школе, менее отвлекаемы и импульсивны, а также обладают большей продолжительностью концентрации внимания. [58] [59] В Кокрановских обзорах [примечание 7] о лечении СДВГ у детей, подростков и взрослых фармацевтическими амфетаминами говорится, что краткосрочные исследования продемонстрировали, что эти препараты уменьшают тяжесть симптомов, но их отменяют чаще. по сравнению с не стимулирующими лекарствами из-за их побочных эффектов . [61] [62]Кокрановский обзор лечения СДВГ у детей с тиковыми расстройствами, такими как синдром Туретта, показал, что стимуляторы в целом не усугубляют тики , но высокие дозы декстроамфетамина могут обострять тики у некоторых людей. [63]
Повышение производительности
Когнитивной деятельности
В 2015 году систематический обзор и метаанализ высококачественных клинических испытаний показали, что при использовании в низких (терапевтических) дозах амфетамин вызывает умеренные, но однозначные улучшения когнитивных функций, включая рабочую память , долговременную эпизодическую память , тормозящий контроль и т. Д. и некоторые аспекты внимания у нормальных здоровых взрослых; [64] [65] известно, что эти эффекты амфетамина, повышающие когнитивные способности, частично опосредованы непрямой активацией как рецептора допамина D 1, так и адренорецептора α 2 впрефронтальная кора . [24] [64] Систематический обзор, проведенный в 2014 году, показал, что низкие дозы амфетамина также улучшают консолидацию памяти , что, в свою очередь, приводит к лучшему восприятию информации . [66] Терапевтические дозы амфетамина также повышают эффективность корковой сети, эффект, который способствует улучшению рабочей памяти у всех людей. [24] [67] Амфетамин и другие стимуляторы СДВГ также улучшают выделение задачи (мотивацию к выполнению задачи) и увеличивают возбуждение (бодрствование), в свою очередь способствуя целенаправленному поведению. [24] [68] [69]Стимуляторы, такие как амфетамин, могут улучшить выполнение сложных и скучных задач и используются некоторыми студентами в качестве помощи при учебе и при сдаче экзаменов. [24] [69] [70] На основании исследований самоотчетов о незаконном употреблении стимуляторов, от 5 до 35% студентов колледжей употребляют отвлеченные стимуляторы СДВГ, которые в основном используются для повышения успеваемости, а не в качестве рекреационных наркотиков. [71] [72] [73] Однако высокие дозы амфетамина, превышающие терапевтический диапазон, могут влиять на рабочую память и другие аспекты когнитивного контроля. [24] [69]
Физическая работоспособность
Некоторые спортсмены используют амфетамин из-за его психологических и спортивных эффектов , повышающих эффективность , таких как повышение выносливости и бдительности; [25] [37] однако немедицинское употребление амфетаминов запрещено на спортивных мероприятиях, которые регулируются коллегиальными, национальными и международными антидопинговыми агентствами. [74] [75] Было показано, что у здоровых людей при пероральном приеме терапевтических доз амфетамин увеличивает мышечную силу , ускорение, спортивные результаты в анаэробных условиях и выносливость (то есть задерживает наступление усталости ), одновременно улучшая время реакции . [25] [76] [77]Амфетамин улучшает выносливость и время реакции, прежде всего за счет ингибирования обратного захвата и высвобождения дофамина в центральной нервной системе. [76] [77] [78] Амфетамин и другие дофаминергические препараты также увеличивают выходную мощность при фиксированных уровнях воспринимаемой нагрузки , игнорируя «предохранительный выключатель», позволяя увеличить предельную температуру ядра , чтобы получить доступ к резервной мощности, которая обычно отключена. -лимиты. [77] [79] [80] В терапевтических дозах побочные эффекты амфетамина не ухудшают спортивные результаты; [25] [76]однако в гораздо более высоких дозах амфетамин может вызывать эффекты, которые серьезно ухудшают работоспособность, такие как быстрое разрушение мышц и повышение температуры тела . [26] [76]
Противопоказания
Согласно Международной программе химической безопасности (IPCS) и Управлению по контролю за продуктами и лекарствами США (USFDA), [примечание 8] амфетамин противопоказан людям с историей злоупотребления наркотиками , [примечание 9] сердечно-сосудистыми заболеваниями , сильным возбуждением или сильное беспокойство. [33] [26] [82] Он также противопоказан людям с прогрессирующим артериосклерозом (склерозирование артерий), глаукомой (повышенное глазное давление), гипертиреозом (чрезмерное производство гормона щитовидной железы) или умеренным или тяжелым.гипертония . [33] [26] [82] Эти агентства указывают, что люди, у которых возникли аллергические реакции на другие стимуляторы или которые принимают ингибиторы моноаминоксидазы (ИМАО), не должны принимать амфетамин, [33] [26] [82] хотя безопасное одновременное употребление ингибиторов амфетамина и моноаминоксидазы. [83] [84] Эти агентства также заявляют, что любой человек с нервной анорексией , биполярным расстройством , депрессией, гипертонией, проблемами с печенью или почками, манией , психозом , феноменом Рейно ,судороги , проблемы с щитовидной железой , тики или синдром Туретта должны контролировать их симптомы при приеме амфетамина. [26] [82] Данные исследований на людях показывают, что терапевтическое употребление амфетамина не вызывает аномалий развития у плода или новорожденных (т. Е. Это не тератоген человека ), но злоупотребление амфетамином действительно представляет опасность для плода. [82] Амфетамин также проникает в грудное молоко, поэтому IPCS и USFDA рекомендуют матерям избегать грудного вскармливания при его употреблении. [26] [82] Из-за возможности обратимого замедления роста, [примечание 10]USFDA рекомендует контролировать рост и вес детей и подростков, которым прописаны амфетаминовые препараты. [26]
Побочные эффекты
Эти неблагоприятные побочные эффекты амфетамина многочисленны и разнообразны, и количество амфетамина используется является основным фактором, определяющим вероятность и тяжесть побочных эффектов. [26] [37] Амфетаминовые препараты, такие как аддералл , декседрин и их дженерики, в настоящее время одобрены USFDA для долгосрочного терапевтического использования. [34] [26] Рекреационное употребление амфетамина обычно включает гораздо большие дозы, которые имеют больший риск серьезных побочных эффектов, чем дозы, используемые в терапевтических целях. [37]
Физический
Побочные эффекты со стороны сердечно-сосудистой системы могут включать гипертензию или гипотензию из-за вазовагальной реакции , феномен Рейно (снижение притока крови к рукам и ступням) и тахикардию (учащение пульса). [26] [37] [85] Сексуальные побочные эффекты у мужчин могут включать эректильную дисфункцию , частые или длительные эрекции . [26] Побочные эффекты со стороны желудочно-кишечного тракта могут включать боль в животе , запор , диарею и тошноту . [1] [26] [86]Другие потенциальные физические побочные эффекты включают потерю аппетита , затуманенное зрение , сухость во рту , чрезмерное скрежетание зубами , кровотечение из носа, обильное потоотделение, медикаментозный ринит (заложенность носа, вызванную лекарственными препаратами), снижение порога судорог , тики (тип двигательного нарушения) и похудание . [источники 5] Опасные физические побочные эффекты редки при использовании обычных фармацевтических доз. [37]
Амфетамин стимулирует мозговые дыхательные центры , обеспечивая более быстрое и глубокое дыхание. [37] У нормального человека при терапевтических дозах этот эффект обычно не заметен, но когда дыхание уже нарушено, он может быть очевиден. [37] Амфетамин также вызывает сокращение сфинктера мочевого пузыря , мышцы, которая контролирует мочеиспускание, что может привести к затруднению мочеиспускания. [37] Этот эффект может быть полезен при лечении недержания мочи и потери контроля над мочевым пузырем . [37] Воздействие амфетамина на желудочно-кишечный тракт непредсказуемо. [37]Если кишечная активность высока, амфетамин может снизить перистальтику желудочно-кишечного тракта (скорость, с которой содержимое проходит через пищеварительную систему); [37] однако амфетамин может увеличить моторику, когда гладкие мышцы тракта расслаблены. [37] Амфетамин также обладает легким обезболивающим действием и может усиливать обезболивающее действие опиоидов . [1] [37]
Исследования, проведенные по заказу USFDA в 2011 году, показывают, что у детей, молодых людей и взрослых нет связи между серьезными неблагоприятными сердечно-сосудистыми событиями ( внезапная смерть , сердечный приступ и инсульт ) и медицинским применением амфетамина или других стимуляторов СДВГ. [источники 6] Однако фармацевтические препараты на основе амфетамина противопоказаны людям с сердечно-сосудистыми заболеваниями . [источники 7]
Психологические
В обычных терапевтических дозах наиболее распространенные психологические побочные эффекты амфетамина включают повышенную бдительность , опасения, концентрацию , инициативу, уверенность в себе и общительность, перепады настроения ( приподнятое настроение, за которым следует умеренно подавленное настроение ), бессонницу или бодрствование , а также снижение чувства усталости. . [26] [37] Менее распространенные побочные эффекты включают беспокойство , изменение либидо , грандиозность , раздражительность , повторяющееся или навязчивое поведение и беспокойство; [источники 8]эти эффекты зависят от личности пользователя и текущего психического состояния. [37] Амфетаминовый психоз (например, бред и паранойя ) может возникать у активных потребителей. [26] [38] [39] Хотя этот психоз очень редко, он также может возникать в терапевтических дозах во время длительной терапии. [26] [39] [40] Согласно USFDA, «нет систематических доказательств», что стимуляторы вызывают агрессивное поведение или враждебность. [26]
Также было показано, что амфетамин вызывает у людей, принимающих терапевтические дозы, обусловленное предпочтение места , [61] [93], что означает, что люди предпочитают проводить время в местах, где они ранее употребляли амфетамин. [93] [94]
Нарушения подкрепления
Зависимость
| Словарь терминов по наркомании и зависимости [94] [95] [96] [97] | |
|---|---|
| |
| Глоссарий факторов транскрипции | |
|---|---|
| |
Сигнальный каскад в прилежащем ядре, который приводит к зависимости от амфетамина |
Зависимость представляет собой серьезный риск при частом употреблении амфетамина в рекреационных целях, но вряд ли возникнет при длительном медицинском употреблении в терапевтических дозах; [41] [42] [43] Фактически, пожизненная стимулирующая терапия СДВГ, которая начинается в детстве, снижает риск развития расстройств, связанных с употреблением психоактивных веществ, во взрослом возрасте. [41] Патологическая гиперактивация мезолимбического пути , дофаминового пути, который соединяет вентральную тегментальную область с прилежащим ядром , играет центральную роль в амфетаминовой зависимости. [104] [105] Лица, которые часто применяют самостоятельновысокие дозы амфетамина имеют высокий риск развития амфетаминовой зависимости, поскольку постоянное употребление высоких доз постепенно увеличивает уровень аккумбального ΔFosB , «молекулярного переключателя» и «главного управляющего белка» при зависимости. [95] [106] [107] Когда прилежащее ядро ΔFosB в достаточной степени сверхэкспрессируется, оно начинает увеличивать тяжесть аддиктивного поведения (т. Е. Компульсивного поиска наркотиков) с дальнейшим усилением его экспрессии. [106] [108] Хотя в настоящее время нет эффективных лекарств для лечения амфетаминовой зависимости, регулярные занятия аэробными упражнениями, по-видимому, снижают риск развития такой зависимости. [109] [110]Постоянные аэробные упражнения на регулярной основе также являются эффективным средством лечения амфетаминовой зависимости; [источники 9] лечебная физкультура улучшает клинические результаты лечения и может использоваться в качестве дополнительной терапии к поведенческой терапии зависимости. [109] [111]
Биомолекулярные механизмы
Хроническое употребление амфетамина в чрезмерных дозах вызывает изменения в экспрессии генов в мезокортиколимбической проекции , которые возникают через транскрипционные и эпигенетические механизмы. [107] [112] [113] Наиболее важными факторами транскрипции [примечание 11] , вызывающими эти изменения, являются гомолог B вирусного онкогена остеосаркомы мыши Delta FBJ ( ΔFosB ), белок, связывающий элемент ответа цАМФ ( CREB ), и ядерный фактор-каппа B ( NF-κB ). [107]ΔFosB является наиболее значимым биомолекулярная механизмом в наркомании , потому что ΔFosB избыточная экспрессия (то есть, аномально высокий уровень экспрессии гена , который производит выраженный , связанный с геном фенотип ) в D1-типа медиальных шиповатых нейронов в прилежащем ядре является необходимым и достаточным [Примечание 12 ] для многих нейронных адаптаций и регулирует множественные поведенческие эффекты (например, сенсибилизацию к вознаграждению и усиление самостоятельного введения лекарств ), связанных с зависимостью. [95] [106] [107]Когда ΔFosB в достаточной степени сверхэкспрессируется, это вызывает состояние привыкания, которое становится все более серьезным с дальнейшим увеличением экспрессии ΔFosB. [95] [106] Он был замешан в зависимости от алкоголя , каннабиноидов , кокаина , метилфенидата , никотина , опиоидов , фенциклидина , пропофола и замещенных амфетаминов , среди прочего. [источники 10]
ΔJunD , фактор транскрипции, и G9a , фермент гистонметилтрансферазы , противостоят функции ΔFosB и ингибируют увеличение его экспрессии. [95] [107] [117] Достаточная избыточная экспрессия ΔJunD в прилежащем ядре с помощью вирусных векторов может полностью блокировать многие нейронные и поведенческие изменения, наблюдаемые при хроническом злоупотреблении наркотиками (т.е. изменения, опосредованные ΔFosB). [107] Точно так же гиперэкспрессия прилежащего G9a приводит к заметно усиленному диметилированию остатка 9 лизина гистона 3 ( H3K9me2 ) и блокирует индукцию ΔFosB-опосредованного нейронные и поведенческая пластичность при хроническом употреблении наркотиков, [11 источников] , которое происходит с помощью H3K9me2 -опосредованной репрессии от факторов транскрипции для ΔFosB и H3K9me2-опосредованного подавление различных ΔFosB транскрипционных мишеней (например, Cdk5 ). [107] [117] [118] ΔFosB также играет важную роль в регулировании поведенческих реакций на естественные награды , такие как вкусная еда, секс и упражнения. [108] [107] [121] Поскольку и естественные награды, и наркотики вызывают выражениеΔFosB (т.е. они заставляют мозг производить его больше), хроническое получение этих наград может привести к аналогичному патологическому состоянию зависимости. [108] [107] Следовательно, ΔFosB является наиболее значительным фактором, участвующим как в амфетаминовой зависимости, так и в сексуальной зависимости , вызванной амфетамином , которые представляют собой компульсивное сексуальное поведение, возникающее в результате чрезмерной сексуальной активности и употребления амфетамина. [108] [122] [123] Эти сексуальные пристрастия связаны с синдромом дисрегуляции дофамина, который возникает у некоторых пациентов, принимающих дофаминергические препараты . [108] [121]
Воздействие амфетамина на регуляцию генов зависит как от дозы, так и от пути введения. [113] Большинство исследований регуляции генов и зависимости основано на исследованиях на животных с внутривенным введением амфетамина в очень высоких дозах. [113] Несколько исследований, в которых использовались эквивалентные (скорректированные по массе) терапевтические дозы для человека и пероральное введение, показывают, что эти изменения, если они происходят, относительно незначительны. [113] Это говорит о том, что использование амфетамина в медицинских целях не оказывает значительного влияния на регуляцию генов. [113]
Фармакологические методы лечения
По состоянию на декабрь 2019 года [update]эффективной фармакотерапии амфетаминовой зависимости не существует. [124] [125] [126] Обзоры от 2015 и 2016 показали , что TAAR1 -селективные агонисты имеют значительный терапевтический потенциал в качестве средства для лечения психостимулирующих зависимостей; [36] [127] однако, по состоянию на февраль 2016 г., [update]единственными соединениями, которые, как известно, действуют как селективные агонисты TAAR1, являются экспериментальные препараты . [36] [127] Зависимость от амфетаминов в значительной степени опосредована повышенной активацией дофаминовых рецепторов и совместно локализованных рецепторов NMDA [примечание 13]в прилежащем ядре; [105] Ионы магния подавляют рецепторы NMDA, блокируя кальциевый канал рецептора . [105] [128] В одном обзоре было высказано предположение, что на основе испытаний на животных патологическое (вызывающее привыкание) употребление психостимуляторов значительно снижает уровень внутриклеточного магния в головном мозге. [105] Было показано, что дополнительное лечение магнием [примечание 14] снижает самостоятельное введение амфетамина (т.е. дозы, вводимые самому себе) у людей, но это не эффективная монотерапия при зависимости от амфетамина. [105]
Систематический обзор и метаанализ 2019 года оценили эффективность 17 различных фармакотерапевтических препаратов, использованных в РКИ для лечения зависимости от амфетамина и метамфетамина; [125] было обнаружено лишь незначительное доказательство того, что метилфенидат может снижать самостоятельное введение амфетамина или метамфетамина. [125] Были получены доказательства слабой и средней силы эффективности большинства других препаратов, использованных в РКИ, включая антидепрессанты (бупропион, миртазапин , сертралин ), нейролептики ( арипипразол ), противосудорожные препараты ( топирамат , баклофен , габапентин ), налтрексон , варениклин ,цитиколин , ондансетрон , промета , рилузол , атомоксетин , декстроамфетамин и модафинил . [125]
Поведенческие методы лечения
Систематический обзор и сетевой метаанализ 2018 года 50 исследований, включающих 12 различных психосоциальных вмешательств для лечения амфетаминовой, метамфетаминовой или кокаиновой зависимости, показали, что комбинированная терапия с подходом как в случае непредвиденных обстоятельств, так и с подходом к укреплению сообщества имела наивысшую эффективность (т.е. уровень воздержания) и приемлемость ( т.е. самый низкий показатель отсева). [129] Другие методы лечения, изученные в ходе анализа, включали монотерапию с учетом непредвиденных обстоятельств или подход к укреплению сообщества, когнитивно-поведенческую терапию , 12-ступенчатые программы , неконтингентную терапию, основанную на вознаграждении, психодинамическую терапию., и другие комбинированные методы лечения с их участием. [129]
Кроме того, исследования нейробиологических эффектов физических упражнений показывают, что ежедневные аэробные упражнения, особенно упражнения на выносливость (например, марафонский бег ), предотвращают развитие наркозависимости и являются эффективной дополнительной терапией (например, дополнительным лечением) при зависимости от амфетамина. [источники 9] Физические упражнения приводят к лучшим результатам лечения, когда используются в качестве дополнительного лечения, особенно при зависимости от психостимуляторов. [109] [111] [130] В частности, аэробные упражнения снижают самостоятельный прием психостимуляторов, уменьшают возобновление (то есть рецидив) поиска наркотиков и вызывают увеличениеПлотность дофаминового рецептора D 2 (DRD2) в полосатом теле . [108] [130] Это противоположно патологическому использованию стимуляторов, которое вызывает снижение плотности полосатого тела DRD2. [108] В одном из обзоров отметили , что физические упражнения могут также предотвратить развитие наркомании путем изменения ΔFosB или с-Fos иммунореактивности в стриатуме или других частях системы вознаграждения . [110]
| Форма нейропластичности или поведенческой пластичности | Тип подкрепления | Источники | |||||
|---|---|---|---|---|---|---|---|
| Опиаты | Психостимуляторы | Продукты с высоким содержанием жира или сахара | Половой акт | Физические упражнения (аэробика) | Обогащение окружающей среды | ||
| Экспрессия ΔFosB в MSN D1-типа прилежащего ядра | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [108] |
| Поведенческая пластичность | |||||||
| Эскалация приема | да | да | да | [108] | |||
| Перекрестная сенсибилизация психостимуляторами | да | Непригодный | да | да | Ослабленный | Ослабленный | [108] |
| Самостоятельное введение психостимуляторов | ↑ | ↑ | ↓ | ↓ | ↓ | [108] | |
| Психостимулятор с условным предпочтением места | ↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [108] |
| Восстановление поведения, связанного с поиском наркотиков | ↑ | ↑ | ↓ | ↓ | [108] | ||
| Нейрохимическая пластичность | |||||||
| Фосфорилирование CREB в прилежащем ядре | ↓ | ↓ | ↓ | ↓ | ↓ | [108] | |
| Сенсибилизированный дофаминовый ответ в прилежащем ядре | Нет | да | Нет | да | [108] | ||
| Измененная передача сигналов дофамина в полосатом теле | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | [108] | |
| Измененная передача сигналов опиоидов в полосатом теле | Без изменений или ↑ μ-опиоидных рецепторов | ↑ μ-опиоидные рецепторы ↑ κ-опиоидные рецепторы | ↑ μ-опиоидные рецепторы | ↑ μ-опиоидные рецепторы | Без изменений | Без изменений | [108] |
| Изменения опиоидных пептидов полосатого тела | ↑ динорфин Без изменений: энкефалин | ↑ динорфин | ↓ энкефалин | ↑ динорфин | ↑ динорфин | [108] | |
| Мезокортиколимбическая синаптическая пластичность | |||||||
| Количество дендритов в прилежащем ядре | ↓ | ↑ | ↑ | [108] | |||
| Дендритный позвоночник плотность в прилежащем ядре | ↓ | ↑ | ↑ | [108] | |||
Зависимость и уход
При злоупотреблении амфетамином (например, при употреблении амфетамина в рекреационных целях) быстро развивается лекарственная устойчивость , поэтому периоды длительного злоупотребления требуют все более высоких доз препарата для достижения того же эффекта. [131] [132] Согласно Кокрановскому обзору отмены у людей, компульсивно употребляющих амфетамин и метамфетамин, «когда хронические тяжелые потребители резко прекращают употребление амфетамина, многие сообщают о ограниченном по времени синдроме отмены, который возникает в течение 24 часов после их последней дозы. " [133] В этом обзоре отмечается, что симптомы отмены у хронических потребителей высоких доз являются частыми, встречаются примерно в 88% случаев и сохраняются в течение 3–4 недель с заметной фазой «краха» в течение первой недели. [133]Симптомы отмены амфетамина могут включать беспокойство, тягу к наркотикам , депрессивное настроение , усталость , повышенный аппетит , увеличение или уменьшение движения , отсутствие мотивации, бессонницу или сонливость и осознанные сновидения . [133] Обзор показал, что тяжесть абстинентного синдрома положительно коррелирует с возрастом человека и степенью его зависимости. [133] Легких симптомов отмены после прекращения лечения амфетамином в терапевтических дозах можно избежать, уменьшив дозу. [1]
Передозировка
Передозировка амфетамина может вызвать множество различных симптомов, но при надлежащем уходе редко приводит к летальному исходу. [1] [82] [134] Тяжесть симптомов передозировки увеличивается с дозировкой и уменьшается с переносимостью лекарства к амфетамину. [37] [82] Толерантные люди, как известно, принимают до 5 граммов амфетамина в день, что примерно в 100 раз превышает максимальную дневную терапевтическую дозу. [82] Симптомы умеренной и очень большой передозировки перечислены ниже; смертельное отравление амфетамином обычно также сопровождается судорогами и комой . [26] [37] В 2013 году передозировка амфетамина, метамфетамина и других соединений, причастных к "Расстройство, связанное с употреблением амфетамина, "привело к примерно 3788 смертельным случаям во всем мире ( 3425–4145 смертей, достоверность 95% ) [примечание 15] [135].
| Система | Незначительная или умеренная передозировка [26] [37] [82] | Тяжелая передозировка [источники 12] |
|---|---|---|
| Сердечно-сосудистые |
|
|
| Центральная нервная система |
|
|
| Опорно-двигательного аппарата |
|
|
| Респираторный |
|
|
| Мочевой |
|
|
| Другой |
|
|
Токсичность
У грызунов и приматов достаточно высокие дозы амфетамина вызывают дофаминергическую нейротоксичность или повреждение дофаминовых нейронов, которое характеризуется конечной дегенерацией дофамина и снижением функции транспортера и рецептора. [137] [138] Нет никаких доказательств того, что амфетамин непосредственно нейротоксичен для человека. [139] [140] Однако большие дозы амфетамина могут косвенно вызывать дофаминергическую нейротоксичность в результате гиперпирексии , чрезмерного образования активных форм кислорода и повышенного автоокисления дофамина. [источники 13] Животные моделинейротоксичности от воздействия высоких доз амфетамина указывают на то, что возникновение гиперпирексии (т. е. основная температура тела ≥ 40 ° C) необходимо для развития нейротоксичности, вызванной амфетамином. [138] Продолжительное повышение температуры мозга выше 40 ° C, вероятно, способствует развитию нейротоксичности, вызванной амфетамином, у лабораторных животных, способствуя выработке активных форм кислорода, нарушая функцию клеточного белка и временно увеличивая проницаемость гематоэнцефалического барьера . [138]
Психоз
Передозировка амфетамина может привести к стимулирующему психозу, который может включать множество симптомов, таких как бред и паранойя. [38] [39] В Кокрановском обзоре лечения амфетаминовых, декстроамфетаминовых и метамфетаминовых психозов говорится, что около 5–15% потребителей не могут полностью выздороветь. [38] [143] Согласно тому же обзору, есть по крайней мере одно испытание, которое показывает, что антипсихотические препараты эффективно устраняют симптомы острого амфетаминового психоза. [38] Психоз редко возникает в результате терапевтического использования. [26] [39] [40]
Лекарственные взаимодействия
Известно, что многие типы веществ взаимодействуют с амфетамином, что приводит к изменению действия лекарства или метаболизма амфетамина, взаимодействующего вещества или того и другого. [26] Ингибиторы ферментов , метаболизирующих амфетамин (например, CYP2D6 и FMO3 ), продлевают период его полувыведения , а это означает, что его действие будет длиться дольше. [15] [26] Амфетамин также взаимодействует с ИМАО , особенно с ингибиторами моноаминоксидазы А , поскольку и ИМАО, и амфетамин повышают содержание катехоламинов в плазме (т. Е. Норадреналина и дофамина); [26]поэтому одновременное использование обоих опасно. [26] Амфетамин модулирует действие большинства психоактивных веществ. В частности, амфетамин может уменьшать действие седативных и депрессивных средств и усиливать действие стимуляторов и антидепрессантов . [26] Амфетамин может также уменьшать эффекты гипотензивных и антипсихотических средств из-за его влияния на артериальное давление и дофамин соответственно. [26] Добавки цинка могут снизить минимальную эффективную дозу амфетамина, когда он используется для лечения СДВГ. [примечание 16] [148]
В целом, при употреблении амфетамина с пищей не происходит значительного взаимодействия, но pH содержимого желудочно-кишечного тракта и мочи влияет на абсорбцию и выведение амфетамина, соответственно. [26] Кислые вещества уменьшают абсорбцию амфетамина и увеличивают выведение с мочой, а щелочные вещества действуют наоборот. [26] Благодаря влиянию pH на абсорбцию, амфетамин также взаимодействует с веществами, снижающими кислотность желудочного сока, такими как ингибиторы протонной помпы и антигистаминные препараты H 2 , которые увеличивают pH желудочно-кишечного тракта (т.е. делают его менее кислым). [26]
Фармакология
Фармакодинамика
Фармакодинамика амфетамина в дофаминовом нейроне |
Амфетамин проявляет свои поведенческие эффекты, изменяя использование моноаминов в качестве нейронных сигналов в головном мозге, в первую очередь в катехоламиновых нейронах в путях вознаграждения и управляющих функций мозга. [35] [56] Концентрации основных нейротрансмиттеров, участвующих в схеме вознаграждения и исполнительной функции, дофамина и норадреналина, резко возрастают в зависимости от дозы амфетамином из-за его воздействия на переносчики моноаминов . [35] [56] [149] усиливающая и мотивационная заметность -promoting эффектов амфетамина обусловлена главным образом к повышенной активности дофаминергической вмезолимбический путь . [24] эйфории и опорно - двигательного аппарата , стимулирующие эффекты амфетамина зависят от величины и скорости , с помощью которого он увеличивает синаптической дофамина и норэпинефрина концентрации в стриатуме . [2]
Амфетамин был идентифицирован как мощный полный агонист в следовых аминного-ассоциированного рецептора 1 (TAAR1), A G сек -coupled и G д -coupled G-белком рецепторов (GPCR) , обнаруженный в 2001 году, что имеет важное значение для регуляции моноаминов мозга . [35] [155] Активация TAAR1 увеличивает продукцию цАМФ за счет активации аденилатциклазы и подавляет функцию транспортера моноаминов . [35] [156] Моноаминовые ауторецепторы (например, D 2 коротких, пресинаптический α 2 и пресинаптический 5-HT 1A ) имеют эффект, противоположный TAAR1, и вместе эти рецепторы обеспечивают систему регуляции моноаминов. [35] [36] Примечательно, что амфетамин и следовые амины обладают высокой аффинностью связывания с TAAR1, но не с моноаминовыми ауторецепторами. [35] [36] Визуализирующие исследования показывают, что ингибирование обратного захвата моноаминов амфетамином и следовыми аминами является сайт-специфичным и зависит от наличия совместной локализации TAAR1 в связанных моноаминовых нейронах. [35]
В дополнении к нейрональным моноаминам транспортерам , амфетамин также ингибирует как везикулярный транспортер моноаминов , VMAT1 и VMAT2 , а также SLC1A1 , SLC22A3 и SLC22A5 . [источники 14] SLC1A1 является транспортером возбуждающих аминокислот 3 (EAAT3), транспортером глутамата, локализованным в нейронах, SLC22A3 представляет собой экстранейрональный транспортер моноаминов, который присутствует в астроцитах , и SLC22A5 является транспортером карнитина с высоким сродством . [источники 14] Амфетамин, как известно, сильно индуцирует транскрипт, регулируемый кокаином и амфетамином.(ВОЗ) экспрессия генов , [4] [162] нейропептид участвует в пищевом поведении, стресс, и вознаграждение, которое индуцирует наблюдаемое увеличение нейронального развития и выживание в пробирке . [4] [163] [164] Рецептор CART еще предстоит идентифицировать, но есть существенные доказательства того, что CART связывается с уникальным G i / G o- связанным GPCR . [164] [165] Амфетамин также ингибирует моноаминоксидазу в очень высоких дозах, что приводит к снижению метаболизма моноаминов и следов аминов и, следовательно, к более высоким концентрациям синаптических моноаминов.[21] [166] У людей единственным постсинаптическим рецептором, с которым, как известно, связывается амфетамин, является рецептор 5-HT1A , где он действует как агонист с низким микромолярным сродством. [167] [168]
Полный профиль краткосрочных эффектов препарата амфетамина в в организме человека, в основном , получены за счет увеличения сотовой связи или нейротрансмиссии из допамина , [35] серотонина , [35] норэпинефрина , [35] адреналина , [149] гистамин , [149] CART пептиды , [4] [162] эндогенные опиоиды , [169] [170] [171] адренокортикотропный гормон , [172] [173] кортикостероиды , [172] [173] и глутамат ,[153] [158], на которые он воздействует посредством взаимодействия с CART , 5-HT1A , EAAT3 , TAAR1 , VMAT1 , VMAT2 и, возможно, другими биологическими мишенями . [источники 15] Амфетамин также активирует семь человеческихферментов карбоангидразы , некоторые из которых экспрессируются в человеческом мозге. [174]
Декстроамфетамин является более сильным агонистом TAAR1, чем левоамфетамин. [175] Следовательно, декстроамфетамин вызывает большую стимуляцию ЦНС, чем левоамфетамин, примерно в три-четыре раза больше, но левоамфетамин имеет немного более сильные сердечно-сосудистые и периферические эффекты. [37] [175]
Допамин
В определенных областях мозга амфетамин увеличивает концентрацию дофамина в синаптической щели . [35] Амфетамин может проникать в пресинаптический нейрон либо через DAT, либо напрямую диффундировать через мембрану нейрона. [35] Как следствие поглощения DAT, амфетамин вызывает конкурентное ингибирование обратного захвата на транспортере. [35] Попадая в пресинаптический нейрон, амфетамин активирует TAAR1, который посредством передачи сигналов протеинкиназы A (PKA) и протеинкиназы C (PKC) вызывает фосфорилирование DAT . [35]Фосфорилирование любой протеинкиназой может привести к интернализации DAT ( неконкурентное ингибирование обратного захвата), но одно фосфорилирование, опосредованное PKC, вызывает обратный транспорт дофамина через DAT (т.е. отток дофамина ). [примечание 16] [35] [176] Также известно, что амфетамин увеличивает внутриклеточный кальций, эффект, который связан с фосфорилированием DAT через неидентифицированный Ca2 + / кальмодулин-зависимый протеинкиназа (CAMK) -зависимый путь, в свою очередь вызывающий отток дофамина. [155] [153] [154] Путем прямого включенияСвязанные с G-белком внутренне выпрямляющие калиевые каналы , TAAR1 снижает частоту возбуждения дофаминовых нейронов, предотвращая гипер-дофаминергическое состояние. [151] [152] [177]
Амфетамин также является субстратом для пресинаптического везикулярного транспортера моноаминов , VMAT2 . [149] [150] После поглощения амфетамина в VMAT2, амфетамин вызывает коллапс везикулярного градиента pH, что приводит к высвобождению молекул дофамина из синаптических везикул в цитозоль посредством оттока дофамина через VMAT2. [149] [150] Впоследствии цитозольные молекулы дофамина высвобождаются из пресинаптического нейрона в синаптическую щель посредством обратного транспорта в DAT . [35] [149] [150]
Норэпинефрин
Подобно допамину, амфетамин в зависимости от дозы увеличивает уровень синаптического норадреналина, прямого предшественника адреналина . [44] [56] На основании экспрессии мРНК TAAR1 в нейронах считается , что амфетамин влияет на норэпинефрин аналогично дофамину. [35] [149] [176] Другими словами, амфетамин вызывает TAAR1-опосредованный отток и неконкурентное ингибирование обратного захвата фосфорилированной NET , конкурентное ингибирование обратного захвата NET и высвобождение норэпинефрина из VMAT2 . [35] [149]
Серотонин
Амфетамин оказывает на серотонин аналогичные, но менее выраженные эффекты, как на дофамин и норадреналин. [35] [56] Амфетамин влияет на серотонин через VMAT2 и, как и норадреналин, как полагают, фосфорилирует SERT через TAAR1 . [35] [149] Как и дофамин, амфетамин имеет низкое микромолярное сродство к человеческому рецептору 5-HT1A . [167] [168]
Другие нейротрансмиттеры, пептиды, гормоны и ферменты
| Фермент | K A ( нМ ) | Источники |
|---|---|---|
| hCA4 | 94 | [174] |
| hCA5A | 810 | [174] [178] |
| hCA5B | 2560 | [174] |
| hCA7 | 910 | [174] [178] |
| hCA12 | 640 | [174] |
| hCA13 | 24100 | [174] |
| hCA14 | 9150 | [174] |
Острое введение амфетамина людям увеличивает выброс эндогенных опиоидов в нескольких структурах мозга в системе вознаграждения . [169] [170] [171] Было показано, что внеклеточные уровни глутамата , основного возбуждающего нейромедиатора в головном мозге, увеличиваются в полосатом теле после воздействия амфетамина. [153] Это увеличение внеклеточного глутамата предположительно происходит за счет индуцированной амфетамином интернализации EAAT3 , переносчика обратного захвата глутамата, в дофаминовых нейронах. [153] [158] Амфетамин также вызывает селективное высвобождение гистамина изтучные клетки и отток гистаминергических нейронов через VMAT2 . [149] Острое введение амфетамина может также повысить уровень адренокортикотропного гормона и кортикостероидов в плазме крови , стимулируя гипоталамо-гипофизарно-надпочечниковую систему . [33] [172] [173]
В декабре 2017 года было опубликовано первое исследование по оценке взаимодействия между амфетамином и ферментами карбоангидразы человека ; [174] из одиннадцати исследованных ферментов карбоангидразы он обнаружил, что амфетамин эффективно активирует семь, четыре из которых высоко экспрессируются в человеческом мозге , с низкими наномолярными или низкими микромолярными активирующими эффектами. [174] На основании доклинических исследований, активация церебральной карбоангидразы имеет эффекты, улучшающие познавательные способности; [179], но, основываясь на клиническом применении ингибиторов карбоангидразы, активация карбоангидразы в других тканях может быть связана с побочными эффектами, такими как окулярныеактивация обострения глаукомы . [179]
Фармакокинетика.
Биодоступность амфетамина при пероральном приеме зависит от рН желудочно-кишечного тракта; [26] он хорошо всасывается из кишечника, а его биодоступность обычно превышает 75% для декстроамфетамина. [3] Амфетамин является слабым основанием с р K а 9,9; [5] , следовательно, когда рН является основным, более лекарственным средством в его липидной растворимой свободном основании формы, и больше поглощаются через богатый липидов клеточные мембраны из кишечника эпителия . [5] [26] И наоборот, кислый pH означает, что лекарство преимущественно находится в водорастворимом катионном(солевой) форме и меньше всасывается. [5] Примерно 20% амфетамина, циркулирующего в кровотоке, связывается с белками плазмы . [4] После абсорбции амфетамин легко распределяется в большинстве тканей организма, при этом высокие концентрации обнаруживаются в спинномозговой жидкости и тканях головного мозга . [11]
В периоды полураспада амфетамина энантиомеров различаются и зависят от рН мочи. [5] При нормальном pH мочи период полураспада декстроамфетамина и левоамфетамина составляет 9-11 часов и 11-14 часов соответственно. [5] Сильнокислая моча сокращает период полувыведения энантиомера до 7 часов; [11] очень щелочная моча увеличивает период полураспада до 34 часов. [11] Варианты с немедленным высвобождением и пролонгированным высвобождением солей обоих изомеров достигают пиковых концентраций в плазме через 3 часа и 7 часов после введения дозы соответственно. [5] Амфетамин выводится через почки с30–40% препарата выводится в неизмененном виде при нормальном pH мочи. [5] Когда pH мочи является щелочным, амфетамин находится в форме свободного основания, поэтому выводится меньше. [5] Когда pH мочи ненормальный, извлечение амфетамина с мочой может варьироваться от низкого уровня 1% до высокого уровня 75%, в основном в зависимости от того, является ли моча слишком щелочной или кислой соответственно. [5] После приема внутрь амфетамин появляется в моче в течение 3 часов. [11] Примерно 90% проглоченного амфетамина выводится через 3 дня после последней пероральной дозы. [11]
Пролекарство лиздексамфетамин не так чувствительно к pH, как амфетамин, при всасывании в желудочно-кишечном тракте; [180] после всасывания в кровоток он превращается ферментами, связанными с эритроцитами, в декстроамфетамин посредством гидролиза . [180] Период полувыведения лиздексамфетамина обычно составляет менее 1 часа. [180]
CYP2D6 , дофамин-β-гидроксилаза (DBH), флавин-содержащая монооксигеназа 3 (FMO3), бутират-CoA-лигаза (XM-лигаза) и глицин- N- ацилтрансфераза (GLYAT) - это ферменты, которые, как известно, метаболизируют амфетамин или его метаболиты в организме человека. [источники 16] Амфетамин содержит множество продуктов метаболизма, в том числе 4-гидроксиамфетамин , 4-гидроксиноэфедрин , 4-гидроксифенилацетон , бензойную кислоту , гиппуровую кислоту , норэфедрин и фенилацетон . [5][6] Среди этих метаболитов, активные симпатомиметики являются 4-гидроксиамфетамин , [181] 4-hydroxynorephedrine , [182] и норэфедрин. [183] Основные метаболические пути включают ароматическое пара-гидроксилирование, алифатическое альфа- и бета-гидроксилирование, N- окисление, N- деалкилирование и дезаминирование. [5] [184] Известные метаболические пути, определяемые метаболиты и метаболизирующие ферменты у людей включают следующее:
Метаболические пути амфетамина у людей [источники 16] |
Фармакомикробиомика
Человек метагеном (то есть, генетический состав индивидуального и все микроорганизмы , которые находятся на поверхности или внутри теле индивидуума) значительно варьируются между отдельными лицами. [190] [191] Поскольку общее количество микробных и вирусных клеток в организме человека (более 100 триллионов) значительно превышает количество человеческих клеток (десятки триллионов), [примечание 18] [190] [192] существует значительный потенциал для взаимодействия между лекарствами и микробиомом человека, в том числе: лекарства, изменяющие состав микробиома человека , метаболизм лекарства микробными ферментами, изменяющий фармакокинетику лекарствапрофиль и микробный метаболизм лекарственного средства, влияющие на клиническую эффективность и профиль токсичности лекарственного средства . [190] [191] [193] Область, изучающая эти взаимодействия, известна как фармакомикробиомика . [190]
Как и большинство биомолекул и других ксенобиотиков, вводимых перорально (например, лекарств), предполагается, что амфетамин подвергнется беспорядочному метаболизму желудочно-кишечной микробиотой человека (в первую очередь бактериями) до всасывания в кровоток . [193] Первый микробный фермент, метаболизирующий амфетамин, тираминоксидаза из штамма E. coli, обычно встречающегося в кишечнике человека, был обнаружен в 2019 году. [193] Было обнаружено, что этот фермент метаболизирует амфетамин, тирамин и фенэтиламин примерно с одинаковая аффинность связывания для всех трех соединений. [193]
Родственные эндогенные соединения
Амфетамин имеет очень схожую структуру и функцию с эндогенными следовыми аминами, которые представляют собой естественные молекулы нейромодуляторов , вырабатываемые в теле и мозге человека. [35] [44] [194] Среди этой группы наиболее близкими соединениями являются фенэтиламин , исходное соединение амфетамина, и N- метилфенэтиламин , изомер амфетамина (то есть, он имеет идентичную молекулярную формулу). [35] [44] [195] В организме человека, фенилэтиламин получают непосредственно из L-фенилаланина с помощью ароматических аминокислот декарбоксилазы(AADC) фермент, который также превращает L-ДОФА в дофамин. [44] [195] В свою очередь, N- метилфенэтиламин метаболизируется из фенэтиламина под действием N- метилтрансферазы фенилэтаноламина , того же фермента, который превращает норадреналин в адреналин. [44] [195] Подобно амфетамину, и фенэтиламин, и N- метилфенэтиламин регулируют нейротрансмиссию моноаминов через TAAR1 ; [35] [194] [195] в отличие от амфетамина, оба эти вещества расщепляются моноаминоксидазой Bи поэтому имеют более короткий период полураспада, чем амфетамин. [44] [195]
Химия
Рацемический амфетамин |
Фенил-2-нитропропен (правые чашки)
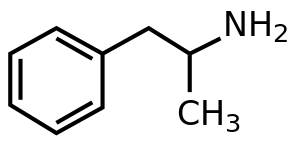
Амфетамин является метиловым гомологом нейромедиатора фенэтиламина млекопитающих с химической формулой C 9 H 13 N.. Атом углерода, примыкающий к первичному амину, является стереогенным центром , а амфетамин состоит из рацемической смеси двух энантиомеров 1: 1 . [4] Эта рацемическая смесь может быть разделена на ее оптические изомеры: [примечание 19] левоамфетамин и декстроамфетамин . [4] При комнатной температуре чистое свободное основание амфетамина представляет собой подвижную, бесцветную и летучую жидкость с характерным сильным запахом амина и едким, жгучим вкусом. [20] Часто получаемые твердые соли амфетамина включают амфетамин адипат, [196] аспартат,[26] гидрохлорид, [197] фосфат, [198] сахарат, [26] сульфат, [26] и таннат. [199] Сульфат декстроамфетамина является наиболее распространенной энантиочистой солью. [45] Амфетамин также является исходным соединением своего собственного структурного класса , который включает ряд психоактивных производных . [13] [4] В органической химии, амфетамин является отличным хиральным лигандом для стереоселективного синтеза из 1,1'-би-2-нафтола . [200]
Замещенные производные
Замещенные производные амфетамина или «замещенные амфетамины» представляют собой широкий спектр химических веществ, которые содержат амфетамин в качестве «основы»; [13] [46] [201], в частности, этот химический класс включает производные соединения, которые образуются путем замены одного или нескольких атомов водорода в структуре ядра амфетамина заместителями . [13] [46] [202] Этот класс включает сам амфетамин, стимуляторы, такие как метамфетамин, серотонинергические эмпатогены, такие как МДМА , и противоотечные средства, такие как эфедрин , среди других подгрупп. [13] [46][201]
Синтез
С тех пор, как в 1887 году было сообщено о первом препарате [203] , были разработаны многочисленные пути синтеза амфетамина. [204] [205] Наиболее распространенный путь легального и незаконного синтеза амфетамина использует неметаллическое восстановление, известное как реакция Лейкарта (метод 1). [45] [206] На первом этапе реакция между фенилацетоном и формамидом с использованием дополнительной муравьиной кислоты или самого формамида в качестве восстанавливающего агента дает N- формиламфетамин.. Этот промежуточный продукт затем гидролизуют с помощью соляной кислоты, а затем подщелачивают, экстрагируют органическим растворителем, концентрируют и перегоняют с получением свободного основания. Затем свободное основание растворяют в органическом растворителе, добавляют серную кислоту, и амфетамин выпадает в осадок в виде сульфатной соли. [206] [207]
Был разработан ряд хиральных разрешений для разделения двух энантиомеров амфетамина. [204] Например, рацемический амфетамин можно обработать d- винной кислотой с образованием диастереоизомерной соли, которая подвергается фракционной кристаллизации с образованием декстроамфетамина. [208] Хиральное разделение остается наиболее экономичным методом получения оптически чистого амфетамина в больших масштабах. [209] Кроме того, было разработано несколько энантиоселективных синтезов амфетамина. В одном примере оптически чистый ( R ) -1-фенилэтанаминконденсируется с фенилацетоном с образованием хирального основания Шиффа . На ключевой стадии это промежуточное соединение восстанавливается каталитическим гидрированием с передачей хиральности альфа-атому углерода аминогруппе. Расщепление бензильной аминовой связи путем гидрирования дает оптически чистый декстроамфетамин. [209]
Большое количество альтернативных путей синтеза амфетамина было разработано на основе классических органических реакций. [204] [205] Одним из примеров является алкилирование бензола по Фриделю-Крафтсу аллилхлоридом с получением бета-хлорпропилбензола, который затем реагирует с аммиаком с образованием рацемического амфетамина (метод 2). [210] В другом примере используется реакция Риттера (метод 3). По этому пути аллилбензол взаимодействует с ацетонитрилом в серной кислоте с образованием органосульфата, который, в свою очередь, обрабатывают гидроксидом натрия с получением амфетамина через промежуточный ацетамид .[211] [212] Третий путь начинается с этил-3-оксобутаноата, который посредством двойного алкилирования метилиодидом с последующим бензилхлоридом может быть преобразован в 2-метил-3-фенилпропановую кислоту. Этот синтетический промежуточный продукт можно превратить в амфетамин с использованием перегруппировки Хофмана или Курциуса (метод 4). [213]
Значительное количество амфетамина синтезов есть снижение на более нитро , имине , оксит , или других азотсодержащих функциональных группы . [205] В одном таком примере Кневенагеля конденсации из бензальдегида с нитроэтан урожайности фенил-2-нитропропена . Двойная связь и нитрогруппа этого промежуточного продукта восстанавливаются либо с помощью каталитического гидрирования, либо путем обработки алюмогидридом лития (метод 5). [206] [214] Другой метод - это реакцияфенилацетон с аммиаком с получением промежуточного имина, который восстанавливается до первичного амина с использованием водорода над палладиевым катализатором или литийалюмогидридом (метод 6). [206]
|
|
Обнаружение в биологических жидкостях
Амфетамин часто измеряется в моче или крови как часть теста на наркотики для занятий спортом, занятости, диагностики отравлений и судебно-медицинской экспертизы. [источники 17] Такие методы, как иммуноанализ , который является наиболее распространенной формой теста на амфетамин, могут перекрестно реагировать с рядом симпатомиметических препаратов. [218] Хроматографические методы, специфичные для амфетамина, используются для предотвращения ложноположительных результатов. [219] метода разделения Хиральной может быть использована , чтобы помочь отличить источник лекарственного средства, или предписание амфетамина, рецепт амфетамин пролекарств (например, селегилин ), более-счетчик лекарственных продуктов , которые содержат levomethamphetamine ,[примечание 20] или незаконно полученные замещенные амфетамины. [219] [222] [223] Некоторые препаратырецепту производить амфетамин как метаболит ,том числе бензфетамина , клобензорекса , фампрофазона , фенпропорекса , lisdexamfetamine , мезокарба , метамфетамина, прениламина , и селегилина , среди других. [2] [224] [225] Эти соединения могут давать положительные результаты на амфетамин при тестировании на наркотики. [224] [225]Амфетамин обычно определяется только стандартным тестом на наркотики в течение примерно 24 часов, хотя высокая доза может быть обнаружена в течение 2–4 дней. [218]
Что касается анализов, исследование отметило, что метод иммуноферментного анализа (EMIT) для амфетамина и метамфетамина может давать больше ложноположительных результатов, чем жидкостная хроматография-тандемная масс-спектрометрия . [222] Газовая хроматография-масс-спектрометрия (ГХ-МС) амфетамина и метамфетамина с дериватизирующим агентом ( S ) - (-) - трифторацетилпролилхлоридом позволяет обнаруживать метамфетамин в моче. [219] ГХ-МС амфетамина и метамфетамина с хиральным дериватизирующим агентом хлорангидрид Мошера позволяет обнаруживать как декстроамфетамин, так и декстрометамфетамин в моче. [219]Следовательно, последний метод может использоваться для образцов, дающих положительный результат, с использованием других методов, чтобы помочь различить различные источники наркотика. [219]
История, общество и культура
| Вещество | Лучшая оценка | Низкая оценка | Высокая оценка |
|---|---|---|---|
| Стимуляторы амфетаминового ряда | 34,16 | 13,42 | 55,24 |
| Каннабис | 192,15 | 165,76 | 234,06 |
| Кокаин | 18.20 | 13,87 | 22,85 |
| Экстази | 20,57 | 8,99 | 32,34 |
| Опиаты | 19,38 | 13,80 | 26,15 |
| Опиоиды | 34,26 | 27.01 | 44,54 |
Амфетамин был впервые синтезирован в 1887 году в Германии румынским химиком Лазэром Эделяну, который назвал его фенилизопропиламином ; [203] [227] [228] его стимулирующие эффекты оставались неизвестными до 1927 года, когда он был независимо повторно синтезирован Гордоном Аллесом и, как сообщалось, обладал симпатомиметическими свойствами. [228] Амфетамин не использовался в медицине до конца 1933 года, когда Смит, Клайн и Френч начали продавать его в виде ингалятора под торговой маркой Бензедрин в качестве противоотечного средства. [27] Бензедрина сульфат был введен 3 года спустя и использовался для лечения широкого спектра заболеваний.медицинские состояния , в том числе нарколепсия , ожирение , низкое кровяное давление , низкое либидо и хроническая боль . [47] [27] Во время Второй мировой войны амфетамин и метамфетамин широко использовались как силами союзников, так и силами Оси из-за их стимулирующих эффектов и повышения производительности. [203] [229] [230] Когда стало известно о вызывающих привыкание свойствах препарата, правительства начали вводить строгий контроль за продажей амфетамина. [203] Например, в начале 1970-х в Соединенных Штатах амфетамин стал контролируемым веществом Списка II в соответствии сЗакон о контролируемых веществах . [231] [232] Несмотря на строгий государственный контроль, амфетамин использовался легально или незаконно людьми самого разного происхождения, включая авторов, [233] музыкантов, [234] математиков, [235] и спортсменов. [25]
Амфетамин до сих пор незаконно синтезируется в подпольных лабораториях и продается на черном рынке , прежде всего в европейских странах. [236] Среди государств-членов Европейского союза (ЕС) в 2018 году [update]11,9 миллиона взрослых в возрасте от 15 до 64 лет хотя бы раз в жизни употребляли амфетамин или метамфетамин, а 1,7 миллиона употребляли их в прошлом году. [237] В 2012 году в государствах-членах ЕС было изъято около 5,9 метрических тонн незаконного амфетамина; [238] «розничная цена» незаконного амфетамина в ЕС колебалась от 6 до 38 евро за грамм в тот же период. [238]За пределами Европы незаконный рынок амфетамина намного меньше, чем рынок метамфетамина и МДМА. [236]
Правовой статус
В результате Конвенции Организации Объединенных Наций о психотропных веществах 1971 года амфетамин стал контролируемым веществом Списка II, как это определено в договоре, во всех 183 государствах-участниках. [28] Следовательно, он жестко регулируется в большинстве стран. [239] [240] Некоторые страны, такие как Южная Корея и Япония, запретили замещенные амфетамины даже для медицинского использования. [241] [242] В других странах, таких как Канада ( препарат из Списка I ), [243] Нидерланды ( препарат из Списка I ), [244] США ( препарат из Списка II ), [26] Австралия (таблица 8 ), [245] Таиланд ( наркотик категории 1 ), [246] и Соединенное Королевство ( наркотик класса B ) [247], амфетамин включен в ограничительный национальный список наркотиков, который позволяет использовать его в качестве лечебного средства. [236] [29]
Фармацевтические продукты
Несколько выпускаемых в настоящее время составов амфетамина содержат оба энантиомера, включая те, которые продаются под торговыми марками Adderall, Adderall XR, Mydayis, [примечание 1] Adzenys ER, Adzenys XR-ODT , Dyanavel XR, Evekeo и Evekeo ODT. Из них Evekeo (включая Evekeo ODT) - единственный продукт, содержащий только рацемический амфетамин (в виде сульфата амфетамина), и, следовательно, единственный продукт, активный фрагмент которого можно точно назвать просто «амфетамин». [1] [33] [86] Декстроамфетамин, продаваемый под торговыми марками Dexedrine и Zenzedi, является единственным энантиочистым амфетаминовым продуктом, доступным в настоящее время. Пролекарство форма декстроамфетамина,Лисдексамфетамин также доступен и продается под торговой маркой Vyvanse. Поскольку это пролекарство, лиздексамфетамин структурно отличается от декстроамфетамина и неактивен до тех пор, пока не метаболизируется в декстроамфетамин. [34] [180] Свободное основание рацемического амфетамина ранее было доступно как бензедрин, психедрин и симпатедрин. [2] Левоамфетамин ранее был доступен как Cydril. [2] Многие современные фармацевтические препараты амфетамина представляют собой соли из-за сравнительно высокой летучести свободного основания. [2] [34] [45] Однако пероральная суспензия и лекарственные формы перорально распадающихся таблеток (ODT)в составе бесплатной базы были введены в 2015 и 2016 годах соответственно. [86] [248] [249] Некоторые из текущих брендов и их генерические эквиваленты перечислены ниже.
| Фирменное наименование | Название, принятое в США | (D: L) соотношение | Форма выпуска | Дата начала маркетинга | Данные по потребительским ценам в США | Источники |
|---|---|---|---|---|---|---|
| Adderall | - | 3: 1 (соли) | планшет | 1996 г. | GoodRx | [2] [34] |
| Adderall XR | - | 3: 1 (соли) | капсула | 2001 г. | GoodRx | [2] [34] |
| Mydayis | - | 3: 1 (соли) | капсула | 2017 г. | GoodRx | [250] [251] |
| Адзенис ER | амфетамин | 3: 1 (основание) | приостановка | 2017 г. | GoodRx | [252] |
| Адзенис XR-ODT | амфетамин | 3: 1 (основание) | ODT | 2016 г. | GoodRx | [249] [253] |
| Дянавел XR | амфетамин | 3,2: 1 (основание) | приостановка | 2015 г. | GoodRx | [86] [248] |
| Evekeo | сульфат амфетамина | 1: 1 (соли) | планшет | 2012 г. | GoodRx | [33] [254] |
| Evekeo ODT | сульфат амфетамина | 1: 1 (соли) | ODT | 2019 г. | GoodRx | [255] |
| Декседрин | сульфат декстроамфетамина | 1: 0 (соли) | капсула | 1976 г. | GoodRx | [2] [34] |
| Зензеди | сульфат декстроамфетамина | 1: 0 (соли) | планшет | 2013 | GoodRx | [34] [256] |
| Vyvanse | лиздексамфетамина димезилат | 1: 0 (пролекарство) | капсула | 2007 г. | GoodRx | [2] [180] [257] |
| планшет |
| лекарство | формула | молекулярная масса [примечание 21] | амфетаминовое основание [примечание 22] | амфетаминовое основание в равных дозах | дозы с равным содержанием основания [примечание 23] | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| (г / моль) | (процентов) | (Доза 30 мг) | ||||||||
| общее | база | общее | право- | лево- | право- | лево- | ||||
| сульфат декстроамфетамина [259] [260] | (C 9 H 13 N) 2 • H 2 SO 4 | 368,49 | 270,41 | 73,38% | 73,38% | - | 22,0 мг | - | 30,0 мг | |
| сульфат амфетамина [261] | (C 9 H 13 N) 2 • H 2 SO 4 | 368,49 | 270,41 | 73,38% | 36,69% | 36,69% | 11,0 мг | 11,0 мг | 30,0 мг | |
| Adderall | 62,57% | 47,49% | 15,08% | 14,2 мг | 4,5 мг | 35,2 мг | ||||
| 25% | сульфат декстроамфетамина [259] [260] | (C 9 H 13 N) 2 • H 2 SO 4 | 368,49 | 270,41 | 73,38% | 73,38% | - | |||
| 25% | сульфат амфетамина [261] | (C 9 H 13 N) 2 • H 2 SO 4 | 368,49 | 270,41 | 73,38% | 36,69% | 36,69% | |||
| 25% | сахарат декстроамфетамина [262] | (C 9 H 13 N) 2 • C 6 H 10 O 8 | 480,55 | 270,41 | 56,27% | 56,27% | - | |||
| 25% | моногидрат амфетамина аспартата [263] | (C 9 H 13 N) • C 4 H 7 NO 4 • H 2 O | 286,32 | 135,21 | 47,22% | 23,61% | 23,61% | |||
| димезилат лиздексамфетамина [180] | C 15 H 25 N 3 O • (CH 4 O 3 S) 2 | 455,49 | 135,21 | 29,68% | 29,68% | - | 8,9 мг | - | 74,2 мг | |
| суспензия на основе амфетамина [86] | C 9 H 13 N | 135,21 | 135,21 | 100% | 76,19% | 23,81% | 22,9 мг | 7,1 мг | 22,0 мг | |
Заметки
- ^ a b Adderall и другие смешанные продукты солей амфетамина, такие как Mydayis, не являются рацемическим амфетамином - они представляют собой смесь, состоящую из равных частей рацемата и декстроамфетамина .
См. « Смешанные соли амфетамина» для получения дополнительной информации о смеси и этот раздел для получения информации о различных смесях энантиомеров амфетамина, продаваемых в настоящее время. - ^ Синонимы и альтернативные варианты написания включают: 1-фенилпропан-2-амин (название IUPAC ), α-метилфенэтиламин , амфетамин ( международное непатентованное название [INN] ), β-фенилизопропиламин и скорость . [21] [4] [22]
- ^ Энантиомеры - это молекулы, которые являются зеркальным отображением друг друга; структурно они идентичны, но имеют противоположную ориентацию. [23]
Левоамфетамин и декстроамфетамин также известны как L-амф или левамфетамин ( МНН ) и D-амф или дексамфетамин (МНН) соответственно. [21] - ^ Торговое название Adderall используется в основном в этой статье для обозначения содержащейся в нем смеси солей амфетамина, поскольку четырехсолевой состав препарата дает его непатентованное название (декстроамфетамин сульфат 25%, декстроамфетамин сахарат 25%, сульфат амфетамина 25% и амфетамина аспартат 25%) слишком долго. [34]
- ^ Термин «амфетамины» также относится к химическому классу, но, в отличие от класса замещенных амфетаминов, [13] класс «амфетаминов» не имеет стандартного определения в академической литературе. [17] Одно из наиболее ограничительных определений этого класса включает только рацемат и энантиомеры амфетамина и метамфетамина. [17] Наиболее общее определение класса охватывает широкий спектр фармакологически и структурно родственных соединений. [17]
Из-за путаницы, которая может возникнуть из-за использования формы множественного числа, в этой статье будут использоваться только термины «амфетамин» и «амфетамины» для обозначения рацемического амфетамина, левоамфетамина и декстроамфетамина и зарезервирован термин «замещенные амфетамины» для его структурного класса. - ^ Области исходов, связанных с СДВГ, с наибольшей долей значительно улучшенных результатов от долгосрочной непрерывной терапии стимуляторами, включают академиков (улучшение ≈55% академических результатов), вождение автомобиля (улучшение результатов вождения на 100%), немедицинское употребление наркотиков ( Улучшилось 47% результатов, связанных с зависимостью), ожирением (улучшилось ≈65% результатов, связанных с ожирением), самооценкой (улучшилось 50% результатов самооценки) и социальной функцией (улучшилось 67% результатов социальной функции). [54]
Наибольшая величина эффекта для улучшения результатов от долгосрочной терапии стимуляторами наблюдается в областях, связанных с учеными (например, средний баллоценки достижений, продолжительности образования и уровня образования), самооценки (например, анкетные оценки самооценки, количество попыток самоубийства и уровень самоубийств) и социальная функция (например, баллы по выдвижению сверстников, социальные навыки и качество сверстников, семьи и романтических отношений). [54]
Долгосрочная комбинированная терапия СДВГ (то есть лечение как стимуляторами, так и поведенческой терапией) дает еще больший эффект для улучшения результатов и улучшает большую долю результатов во всех областях по сравнению с длительной терапией только стимуляторами. [54] - ^ Кокрановские обзоры - это высококачественные метааналитические систематические обзоры рандомизированных контролируемых исследований. [60]
- ^ Заявления, поддерживаемые USFDA, исходят из предписывающей информации, которая является интеллектуальной собственностью производителя, защищенной авторским правом, и одобрена USFDA. Противопоказания USFDA не обязательно предназначены для ограничения медицинской практики, но ограничивают требования фармацевтических компаний. [81]
- ^ Согласно одному обзору, амфетамин может быть прописан людям с историей злоупотребления при условии, что используются соответствующие меры контроля за приемом лекарств, такие как требование ежедневного приема лекарства у лечащего врача. [2]
- ^ У людей, у которых наблюдается субнормальный рост и прибавка в весе, ожидается возврат к нормальному уровню при кратковременном прерывании терапии стимуляторами. [41] [53] [85] Среднее снижение конечного роста взрослого человека за 3 года непрерывной терапии стимуляторами составляет 2 см. [85]
- ^ Факторы транскрипции - это белки, которые увеличивают или уменьшают экспрессию определенных генов. [114]
- ^ Проще говоря, эта необходимая и достаточная взаимосвязь означает, что сверхэкспрессия ΔFosB в прилежащем ядре и связанные с зависимостью поведенческие и нейронные адаптации всегда происходят вместе и никогда не происходят по отдельности.
- ^ Рецепторы NMDA представляют собой потенциал-зависимые ионные каналы , управляемые лигандом, которые требуют одновременного связывания глутамата и коагониста ( D- серина или глицина ) для открытия ионного канала. [128]
- ^ Проверка показалачто магний L-аспартат и магния хлорида производят значительные изменения в аддиктивного поведения; [105] другие формы магния не упоминались.
- ^ 95% доверительный интервал показывает, что существует 95% вероятность того, что истинное число смертей находится между 3425 и 4145.
- ^ a b Переносчик дофамина человека (hDAT) содержит высокоаффинный , внеклеточный и аллостерический сайт связывания Zn 2+ (иона цинка), который при связывании цинка ингибирует обратный захват дофамина , ингибирует индуцированную амфетамином интернализацию hDAT и усиливает амфетамин- индуцированный отток дофамина . [144] [145] [146] [147] Транспортер серотонина человека и транспортер норэпинефрина не содержат сайтов связывания цинка. [146]
- ^ 4-Гидроксиамфетамин метаболизируется в 4-гидроксинорефедрин под действием дофамин-бета-гидроксилазы (DBH) in vitro, и предполагается, что он метаболизируется аналогичным образом in vivo . [13] [185] Данные исследований, в которых измерялось влияние концентрации DBH в сыворотке наметаболизм 4-гидроксиамфетамина у людей, свидетельствуют о том, что другой фермент может опосредовать превращение 4-гидроксиамфетамина в 4-гидроксинорефедрин ; [185] [187] однако другие данные исследований на животных предполагают, что эта реакция катализируется DBH в синаптических везикулах.внутри норадренергических нейронов головного мозга. [188] [189]
- ^ Состав микробиома и концентрация микробов сильно различаются в зависимости от анатомической области. [190] [191] Жидкость из толстой кишки человека, которая содержит самую высокую концентрацию микробов из всех анатомических областей, содержит приблизительно один триллион (10 ^ 12) бактериальных клеток / мл. [190]
- ^ Энантиомеры - это молекулы, которые являются зеркальным отображением друг друга; структурно они идентичны, но имеют противоположную ориентацию. [23]
- ^ Активный ингредиент в некоторых безрецептурных ингаляторах в США указан как левметамфетамин , МНН и USAN левометамфетамина. [220] [221]
- ^ Для однородности молекулярные массы были рассчитаны с использованием калькулятора молекулярной массы Lenntech [258] и находились в пределах 0,01 г / моль от опубликованных фармацевтических значений.
- ^ Процент основания амфетамина = основание молекулярной массы / общая молекулярная масса. Базовый процент амфетамина для Adderall = сумма процентных соотношений компонентов / 4.
- ^ доза = (1 / процент основания амфетамина) × коэффициент масштабирования = ( общая молекулярная масса / основание молекулярной массы) × коэффициент масштабирования. Значения в этой колонке были масштабированы для дозы 30 мг сульфата декстроамфетамина. Из-за фармакологических различий между этими лекарствами (например, различий в высвобождении, абсорбции, конверсии, концентрации, различных эффектах энантиомеров, периоде полувыведения и т. Д.) Указанные значения не следует рассматривать как равноправные дозы.
- Легенда изображения
- ^ Ионный каналG-белки и связанные рецепторы(Цвет текста) Факторы транскрипции
Справочные заметки
- ^ [2] [17] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33]]
- ^ [2] [10] [24] [27] [33] [35] [36]
- ^ [10] [24] [25] [26] [30] [37] [38] [39] [40] [41] [42] [43] »
- ^ [44] [45] [46]
- ^ [1] [26] [37] [85] [86] [87]
- ^ [88] [89] [90] [91]
- ^ [26] [82] [88] [90]
- ^ [30] [26] [37] [92]
- ^ a b [108] [109] [110] [111] [130]
- ^ [106] [108] [107] [115] [116]
- ^ [107] [118] [119] [120]
- ^ [22] [26] [37] [134] [136]
- ^ [48] [138] [141] [142]
- ^ a b [149] [153] [157] [158] [159] [160] [161]
- ^ [35] [149] [157] [158] [162] [167]
- ^ a b [5] [13] [14] [15] [16] [6] [185] [186]
- ^ [25] [215] [216] [217]
Рекомендации
- ^ a b c d e f g h i j Stahl SM (март 2017 г.). «Амфетамин (Д, Л)» . Руководство для назначающего: Essential Psychopharmacology Шталя (6-е изд.). Кембридж, Соединенное Королевство: Издательство Кембриджского университета. С. 45–51. ISBN 9781108228749. Дата обращения 5 августа 2017 .
- ^ a b c d e f g h i j k l m Heal DJ, Smith SL, Gosden J, Nutt DJ (июнь 2013 г.). «Амфетамин, прошлое и настоящее - фармакологическая и клиническая перспектива» . Журнал психофармакологии . 27 (6): 479–496. DOI : 10.1177 / 0269881113482532 . PMC 3666194 . PMID 23539642 .
Внутривенное употребление d-амфетамина и других стимуляторов по-прежнему представляет серьезную угрозу безопасности для людей, занимающихся этой практикой. Некоторые из этих внутривенных злоупотреблений происходят из-за утечки ампул d-амфетамина, которые до сих пор иногда назначают в Великобритании для борьбы с тяжелой нарколепсией и другими нарушениями, связанными с чрезмерным седативным действием. ... По этим причинам наблюдения зависимости и злоупотребления d-амфетамином, отпускаемым по рецепту, в клинической практике редки, и этот стимулятор можно даже прописать людям, злоупотреблявшим наркотиками в анамнезе, при условии соблюдения определенных мер контроля, таких как ежедневное получение рецептов. , введены в действие (Jasinski and Krishnan, 2009b).
- ^ a b Wishart, David S .; Джомбу Феунанг, Янник; Го, Ань Чи; Ло, Элвис Дж .; Марку, Ана; Грант, Джейсон Р .; Саджед, Танвир; Джонсон, Дэниел; Ли, Карин; Сайеда, Зинат; Ассемпур, Назанин; Иинккаран, Итаявани; Лю, Ифэн; Мацеевский, Адам; Гейл, Никола; Уилсон, Алекс; Чин, Люси; Каммингс, Райан; Ле, Диана; Пон, Эллисон; Нокс, Крейг; Уилсон, Майкл. "Декстроамфетамин | Интернет-банк наркотиков" . DrugBank . 5.0.
- ^ a b c d e f g h я Wishart, David S .; Джомбу Феунанг, Янник; Го, Ань Чи; Ло, Элвис Дж .; Марку, Ана; Грант, Джейсон Р .; Саджед, Танвир; Джонсон, Дэниел; Ли, Карин; Сайеда, Зинат; Ассемпур, Назанин; Иинккаран, Итаявани; Лю, Ифэн; Мацеевский, Адам; Гейл, Никола; Уилсон, Алекс; Чин, Люси; Каммингс, Райан; Ле, Диана; Пон, Эллисон; Нокс, Крейг; Уилсон, Майкл. "Амфетамин | Интернет-банк наркотиков" . DrugBank . 5.0.
- ^ a b c d e f g h i j k l m n o p q r s "Информация о предписании Adderall XR" (PDF) . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Shire US Inc., декабрь 2013 г., стр. 12–13 . Проверено 30 декабря 2013 года .
- ^ a b c d Сантагати Н. А., Феррара Г., Марраццо А., Ронсисвалле Г. (сентябрь 2002 г.). «Одновременное определение амфетамина и одного из его метаболитов методом ВЭЖХ с электрохимическим детектированием». Журнал фармацевтического и биомедицинского анализа . 30 (2): 247–255. DOI : 10.1016 / S0731-7085 (02) 00330-8 . PMID 12191709 .
- ^ «Фармакология» . амфетамин / декстроамфетамин . Medscape . WebMD . Проверено 21 января +2016 .
Начало действия: 30–60 мин.
- ^ a b c Милличэп JG (2010). «Глава 9: Лекарства от СДВГ». В Millichap JG (ред.). Справочник по синдрому дефицита внимания с гиперактивностью: Руководство для врача по СДВГ (2-е изд.). Нью-Йорк, США: Springer. п. 112. ISBN 9781441913968.
Таблица 9.2 Декстроамфетаминовые формы стимулирующего лекарства
Декседрин [пик: 2–3 ч] [Продолжительность: 5–6 ч] ...
Аддералл [Пик: 2–3 ч] [Продолжительность: 5–7 ч]
Спансулы декседрина [пик: 7 –8 ч] [Продолжительность: 12 ч] ...
Adderall XR [Пик: 7-8 ч] [Продолжительность: 12 ч]
Виванс [Пик: 3-4 ч] [Продолжительность: 12 ч] - ^ Brams M, Мао AR, Doyle RL (сентябрь 2008). «Начало эффективности психостимуляторов длительного действия при синдроме дефицита внимания / гиперактивности у детей». Аспирантура медицины . 120 (3): 69–88. DOI : 10,3810 / pgm.2008.09.1909 . PMID 18824827 . S2CID 31791162 .
- ^ a b c d «Аддералл-декстроамфетамин сахарат, аспартат амфетамина, сульфат декстроамфетамина и таблетка сульфата амфетамина» . DailyMed . Teva Pharmaceuticals USA, Inc. 8 ноября 2019 . Проверено 22 декабря 2019 .
- ^ a b c d e f "Метаболизм / фармакокинетика". Амфетамин . Национальная медицинская библиотека США - сеть токсикологических данных . Банк данных по опасным веществам. Архивировано из оригинального 2 -го октября 2017 года . Проверено 2 октября 2017 года .
Продолжительность эффекта зависит от агента и pH мочи. Выведение усиливается при более кислой моче. Период полувыведения составляет от 7 до 34 часов и частично зависит от pH мочи (период полувыведения больше в щелочной моче). ... Амфетамины распространяются в большинстве тканей организма, при этом высокие концентрации встречаются в головном мозге и спинномозговой жидкости. Амфетамин появляется с мочой примерно через 3 часа после приема внутрь. ... Через три дня после приема дозы (+ или -) - амфетамина люди вывели 91% (14) C с мочой.
- ^ a b Mignot EJ (октябрь 2012 г.). «Практическое руководство по терапии синдромов нарколепсии и гиперсомнии» . Нейротерапия . 9 (4): 739–752. DOI : 10.1007 / s13311-012-0150-9 . PMC 3480574 . PMID 23065655 .
- ^ Б с д е е г ч я Гленнон RA (2013). «Стимуляторы фенилизопропиламина: вещества, родственные амфетамину» . В Lemke TL, Williams DA, Roche VF, Zito W (ред.). Принципы медицинской химии Фуа (7-е изд.). Филадельфия, США: Wolters Kluwer Health / Lippincott Williams & Wilkins. С. 646–648. ISBN 9781609133450.
Простейший незамещенный фенилизопропиламин, 1-фенил-2-аминопропан или амфетамин, служит общим структурным шаблоном для галлюциногенов и психостимуляторов. Амфетамин оказывает центральное стимулирующее, аноректическое и симпатомиметическое действие, и он является прототипом этого класса (39). ... Метаболизм аналогов амфетамина в фазе 1 катализируется двумя системами: цитохромом P450 и флавинмонооксигеназой. ... Амфетамин также может подвергаться ароматическому гидроксилированию до п- гидроксиамфетамина. ... Последующее окисление в бензильном положении DA β-гидроксилазой дает п- гидроксиноэфедрин. В качестве альтернативы прямое окисление амфетамина β-гидроксилазой DA может дать норэфедрин.
- ^ a b Тейлор КБ (январь 1974 г.). «Дофамин-бета-гидроксилаза. Стереохимический ход реакции» (PDF) . Журнал биологической химии . 249 (2): 454–458. PMID 4809526 . Проверено 6 ноября 2014 .
Дофамин-β-гидроксилаза катализирует удаление атома водорода pro-R и образование 1-норэфедрина, (2
S
, 1
R
) -2-амино-1-гидроксил-1-фенилпропана из d-амфетамина.
- ^ a b c Krueger SK, Williams DE (июнь 2005 г.). «Флавинсодержащие монооксигеназы млекопитающих: структура / функция, генетический полиморфизм и роль в метаболизме лекарств» . Фармакология и терапия . 106 (3): 357–387. DOI : 10.1016 / j.pharmthera.2005.01.001 . PMC 1828602 . PMID 15922018 .
Таблица 5: N-содержащие препараты и ксенобиотики, оксигенированные предприятием - ^ a b Кэшман JR, Xiong YN, Xu L, Janowsky A (март 1999 г.). «N-оксигенация амфетамина и метамфетамина человеческой флавин-содержащей монооксигеназой (форма 3): роль в биоактивации и детоксикации». Журнал фармакологии и экспериментальной терапии . 288 (3): 1251–1260. PMID 10027866 .
- ^ а б в г д Ёсида Т. (1997). «Глава 1: Использование и злоупотребление амфетаминами: международный обзор» . В Klee H (ред.). Злоупотребление амфетамином: международные перспективы текущих тенденций . Амстердам, Нидерланды: Harwood Academic Publishers. п. 2 . ISBN 9789057020810.
Амфетамин в форме единственного числа правильно относится к рацемату 2-амино-1-фенилпропана. ... Однако в самом широком контексте термин [ амфетамины ] может даже охватывать большое количество структурно и фармакологически родственных веществ.
- ^ «Плотность» . Амфетамин . База данных PubChem Compound . Национальная медицинская библиотека США - Национальный центр биотехнологической информации. 5 ноября 2016 . Проверено 9 ноября +2016 .
- ^ «Свойства: Прогнозируемые - EPISuite» . Амфетамин . ChemSpider . Королевское химическое общество . Проверено 6 ноября 2013 года .
- ^ a b «Химические и физические свойства» . Амфетамин . База данных PubChem Compound . Национальная медицинская библиотека США - Национальный центр биотехнологической информации . Проверено 13 октября 2013 года .
- ^ a b c "Резюме соединения" . Амфетамин . База данных PubChem Compound . Национальная медицинская библиотека США - Национальный центр биотехнологической информации. 11 апреля 2015 . Проверено 17 апреля 2015 года .
- ^ a b Грин С.Л., Керр Ф., Брайтберг Г. (октябрь 2008 г.). «Обзорная статья: злоупотребление амфетаминами и родственными им наркотиками». Экстренная медицина Австралии . 20 (5): 391–402. DOI : 10.1111 / j.1742-6723.2008.01114.x . PMID 18973636 . S2CID 20755466 .
- ^ а б «Энантиомер» . Сборник химической терминологии ИЮПАК . Золотая книга ИЮПАК . Международный союз теоретической и прикладной химии. 2009. DOI : 10,1351 / goldbook.E02069 . ISBN 9780967855097. Архивировано из оригинального 17 марта 2013 года . Проверено 14 марта 2014 года .
Один из пары молекулярных объектов, которые являются зеркальным отображением друг друга и не могут быть совмещены.
- ^ a b c d e f g h i j Malenka RC, Nestler EJ, Hyman SE (2009). «Глава 13: Высшие когнитивные функции и поведенческий контроль». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: Фонд клинической неврологии (2-е изд.). Нью-Йорк, США: McGraw-Hill Medical. стр. 318, 321. ISBN 9780071481274.
Терапевтические (относительно низкие) дозы психостимуляторов, таких как метилфенидат и амфетамин, улучшают выполнение задач на рабочую память как у нормальных субъектов, так и у людей с СДВГ. ... стимуляторы действуют не только на функцию рабочей памяти, но и на общий уровень возбуждения и, в пределах прилежащего ядра, улучшают значимость задач. Таким образом, стимуляторы улучшают производительность при выполнении сложных, но утомительных задач ... за счет косвенной стимуляции рецепторов дофамина и норадреналина. ...
Помимо этих общих разрешающих эффектов, дофамин (действующий через рецепторы D1) и норэпинефрин (действующий на несколько рецепторов) могут на оптимальных уровнях улучшать рабочую память и аспекты внимания. - ^ Б с д е е г Liddle DG, Connor DJ (июнь 2013). «Пищевые добавки и эргогенный СПИД». Первичная помощь: клиники в офисной практике . 40 (2): 487–505. DOI : 10.1016 / j.pop.2013.02.009 . PMID 23668655 .
Амфетамины и кофеин - это стимуляторы, которые повышают бдительность, улучшают концентрацию внимания, уменьшают время реакции и задерживают утомление, позволяя увеличить интенсивность и продолжительность тренировки ...
Физиологические эффекты и влияние на производительность
• Амфетамины увеличивают высвобождение дофамина / норадреналина и препятствуют их обратному захвату, что приводит к стимуляция центральной нервной системы (ЦНС)
• Амфетамины, по-видимому, улучшают спортивные результаты в анаэробных условиях 39 40
• Улучшенное время реакции
• Повышенная мышечная сила и отсроченная мышечная усталость
• Повышенное ускорение
• Повышенная бдительность и внимание к задаче - ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an "Adderall XR - сульфат декстроамфетамина, сахарат декстроамфетамина , сульфат амфетамина и капсула аспартата амфетамина, пролонгированного высвобождения " . DailyMed . Шире США Inc. 17 июля 2019 . Получено22 декабря 2019 .
- ^ a b c d Rasmussen N (июль 2006 г.). «Создание первого антидепрессанта: амфетамин в американской медицине, 1929–1950». Журнал истории медицины и смежных наук . 61 (3): 288–323. DOI : 10,1093 / jhmas / jrj039 . PMID 16492800 . S2CID 24974454 .
Однако фирма обнаружила препарат, SKF сначала упаковала его как ингалятор, чтобы использовать летучесть основы, и после спонсирования некоторых испытаний отоларингологами Восточного побережья в конце 1933 года начала рекламировать ингалятор бензедрина как противоотечное средство.
- ^ a b «Конвенция о психотропных веществах» . Сборник договоров Организации Объединенных Наций . Организация Объединенных Наций. Архивировано 31 марта 2016 года . Проверено 11 ноября 2013 года .
- ^ a b Виленс Т.Э., Адлер Л.А., Адамс Дж., Сгамбати С., Ротросен Дж., Савтель Р., Утзингер Л., Фузилло С. (январь 2008 г.). «Злоупотребление и утечка стимуляторов, прописанных при СДВГ: систематический обзор литературы». Журнал Американской академии детской и подростковой психиатрии . 47 (1): 21–31. DOI : 10,1097 / chi.0b013e31815a56f1 . PMID 18174822 .
Злоупотребление стимуляторами, по-видимому, имеет место как для повышения работоспособности, так и для их эйфорогенного эффекта, причем последнее связано с внутренними свойствами стимуляторов (например, профиль IR по сравнению с профилем ER) ...
Хотя стимуляторы полезны при лечении СДВГ, они представляют собой контролируемые вещества II, история которых доклинических исследований и исследований на людях показывает потенциальную возможность злоупотребления. - ^ a b c Монтгомери К.А. (июнь 2008 г.). «Расстройства сексуального влечения» . Психиатрия . 5 (6): 50–55. PMC 2695750 . PMID 19727285 .
- ^ «Амфетамин» . Медицинские тематические рубрики . Национальная медицинская библиотека США . Проверено 16 декабря 2013 года .
- ^ «Руководство по использованию международных непатентованных наименований (INNS) для фармацевтических субстанций» . Всемирная организация здоровья. 1997 . Проверено 1 декабря 2014 .
В принципе, МНН выбираются только для активной части молекулы, которой обычно является основание, кислота или спирт. Однако в некоторых случаях активные молекулы необходимо увеличивать по разным причинам, например, для целей рецептуры, биодоступности или скорости абсорбции. В 1975 году эксперты, назначенные для выбора МНН, решили принять новую политику наименования таких молекул. В дальнейшем названия различных солей или сложных эфиров одного и того же активного вещества должны различаться только в отношении неактивной части молекулы. ... Последние называются модифицированными INN (INNM).
- ^ a b c d e f g h i "Таблетка Evekeo-амфетамина сульфата" . DailyMed . Арбор Фармасьютикалз, ООО. 14 августа 2019 . Проверено 22 декабря 2019 .
- ^ a b c d e f g h «Результаты поиска амфетамина по национальному кодексу наркотиков» . Справочник национальных кодов лекарств . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Архивировано из оригинального 16 декабря 2013 года . Проверено 16 декабря 2013 года .
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Miller GM (январь 2011 г.). «Возникающая роль следового аминосвязанного рецептора 1 в функциональной регуляции переносчиков моноаминов и дофаминергической активности» . Журнал нейрохимии . 116 (2): 164–176. DOI : 10.1111 / j.1471-4159.2010.07109.x . ЧВК 3005101 . PMID 21073468 .
- ^ а б в г д Гранди Д. К., Миллер Г. М., Ли Дж. Х. (февраль 2016 г.). « » TAARgeting Addiction «-The Alamo Медведи Свидетель на другую революцию: Обзор Пленарного симпозиума 2015 Behavior, биологию и химия конференция» . Наркотическая и алкогольная зависимость . 159 : 9–16. DOI : 10.1016 / j.drugalcdep.2015.11.014 . PMC 4724540 . PMID 26644139 .
При рассмотрении вместе с быстро растущей литературой в этой области возникает убедительный аргумент в пользу разработки селективных агонистов TAAR1 в качестве лекарств для предотвращения рецидива злоупотребления психостимуляторами.
- ^ Б с д е е г ч я J к л м п о р Q R сек т у V ш Западный Край DP, TC Западный Край (2010). «Разные симпатомиметические агонисты». В Brunton LL, Chabner BA, Knollmann BC (ред.). Фармакологические основы терапии Гудмана и Гилмана (12-е изд.). Нью-Йорк, США: Макгроу-Хилл. ISBN 9780071624428.
- ^ Б с д е Shoptaw SJ, Као U, Лин Вт (январь 2009 г.). Шоптоу С.Дж., Али Р. (ред.). «Лечение амфетаминового психоза» . Кокрановская база данных систематических обзоров (1): CD003026. DOI : 10.1002 / 14651858.CD003026.pub3 . PMC 7004251 . PMID 19160215 .
У меньшинства людей, употребляющих амфетамины, развивается полномасштабный психоз, требующий оказания помощи в отделениях неотложной помощи или психиатрических больницах. В таких случаях симптомы амфетаминового психоза обычно включают параноидальный бред и бред преследования, а также слуховые и зрительные галлюцинации при сильном возбуждении. Чаще (около 18%) частые потребители амфетамина сообщают о психотических симптомах, которые носят субклинический характер и не требуют интенсивного вмешательства ...
Около 5-15% потребителей, у которых развивается амфетаминовый психоз, не могут полностью вылечиться. (Hofmann 1983) ...
Результаты одного исследования показывают, что использование антипсихотических препаратов эффективно устраняет симптомы острого амфетаминового психоза.
Психотические симптомы людей с амфетаминовым психозом могут быть связаны исключительно с интенсивным употреблением наркотика, или интенсивное употребление наркотика может усугубить скрытую уязвимость к шизофрении. - ^ a b c d e Брамнесс Дж. Г., Гундерсен ØH, Гутерстам Дж., Роньли Э. Б., Контениус М., Лёберг Е. М., Медхус С., Танум Л., Франк Дж. (декабрь 2012 г.). «Психоз, вызванный амфетамином - отдельный диагностический объект или первичный психоз, вызываемый у уязвимых?» . BMC Psychiatry . 12 : 221. DOI : 10,1186 / 1471-244X-12-221 . PMC 3554477 . PMID 23216941 .
В этих исследованиях амфетамин давали в последовательно более высоких дозах до тех пор, пока не разразился психоз, часто после приема 100–300 мг амфетамина ... Во-вторых, психоз рассматривался как нежелательное явление, хотя и редко, у детей с СДВГ, которые лечились с помощью амфетамин
- ^ a b c Грейданус Д. «Злоупотребление стимуляторами: стратегии управления растущей проблемой» (PDF) . Американская ассоциация здоровья колледжей (обзорная статья). Программа профессионального развития ACHA. п. 20. Архивировано из оригинала (PDF) 3 ноября 2013 года . Проверено 2 ноября 2013 года .
- ^ a b c d e f g h Хуанг Ю.С., Цай М.Х. (июль 2011 г.). «Долгосрочные результаты с лекарствами от синдрома дефицита внимания с гиперактивностью: текущий уровень знаний». Препараты ЦНС . 25 (7): 539–554. DOI : 10.2165 / 11589380-000000000-00000 . PMID 21699268 . S2CID 3449435 .
Несколько других исследований
[97-101],
включая метааналитический обзор
[98]
и ретроспективное исследование,
[97]
предположили, что стимулирующая терапия в детстве связана со снижением риска последующего употребления психоактивных веществ, курения сигарет и расстройств, связанных с употреблением алкоголя. ... Недавние исследования показали, что стимуляторы, наряду с нестимуляторами атомоксетином и гуанфацином с пролонгированным высвобождением, постоянно эффективны в течение более чем 2-летних периодов лечения с небольшими и переносимыми побочными эффектами. Эффективность долгосрочной терапии включает не только основные симптомы СДВГ, но также улучшение качества жизни и академических достижений. Наиболее опасные краткосрочные побочные эффекты стимуляторов, такие как повышение артериального давления и частоты сердечных сокращений, в долгосрочных контрольных исследованиях ослабли. ... Текущие данные не подтверждают потенциальное влияние стимуляторов на ухудшение или развитие тиков или злоупотребления психоактивными веществами во взрослом возрасте.В самом продолжительном последующем исследовании (более 10 лет) пожизненное лечение СДВГ с помощью стимуляторов оказалось эффективным и защитным от развития неблагоприятных психических расстройств.
- ^ a b Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). «Глава 16: Закрепление и аддиктивные расстройства». Молекулярная нейрофармакология: Фонд клинической неврологии (3-е изд.). Нью-Йорк: McGraw-Hill Medical. ISBN 9780071827706.
Такие агенты также имеют важное терапевтическое применение; кокаин, например, используется в качестве местного анестетика (глава 2), а амфетамины и метилфенидат используются в низких дозах для лечения синдрома дефицита внимания с гиперактивностью и в более высоких дозах для лечения нарколепсии (глава 12). Несмотря на их клиническое применение, эти препараты обладают сильным подкрепляющим действием, а их длительное использование в высоких дозах связано с потенциальной зависимостью, особенно при быстром введении или при приеме высокоактивных форм.
- ^ a b Коллинз SH (май 2008 г.). «Качественный обзор вопросов, возникающих при использовании психостимулирующих препаратов у пациентов с СДВГ и сопутствующими расстройствами, связанными с употреблением психоактивных веществ». Текущие медицинские исследования и мнения . 24 (5): 1345–1357. DOI : 10.1185 / 030079908X280707 . PMID 18384709 . S2CID 71267668 .
Когда пероральные формы психостимуляторов используются в рекомендуемых дозах и с рекомендованной частотой, они вряд ли дадут эффекты, соответствующие потенциалу злоупотребления у пациентов с СДВГ.
- ^ Б с д е е г Броадли KJ (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. DOI : 10.1016 / j.pharmthera.2009.11.005 . PMID 19948186 .
- ^ a b c d «Амфетамин» . Европейский центр мониторинга наркотиков и наркомании . Проверено 19 октября 2013 года .
- ^ a b c d Хагель Дж. М., Крижевски Р., Марсолайс Ф, Левинсон Э, Факкини П. Дж. (2012). «Биосинтез аналогов амфетамина в растениях». Тенденции в растениеводстве . 17 (7): 404–412. DOI : 10.1016 / j.tplants.2012.03.004 . PMID 22502775 .
Замещенные амфетамины, которые также называют фенилпропиламиноалкалоидами, представляют собой разнообразную группу азотсодержащих соединений, которые имеют основную цепь фенэтиламина с метильной группой в α-положении относительно азота (рис. 1). ... Помимо (1
R
, 2
S
) -эфедрина и (1
S
, 2
S
) -псевдоэфедрин и множество других замещенных амфетаминов имеют важное фармацевтическое применение. ... Например, ( S ) -амфетамин (рис. 4b), ключевой ингредиент в Adderall и Dexedrine, используется для лечения синдрома дефицита внимания и гиперактивности (ADHD) [79]. ...
[Рисунок 4] (b) Примеры синтетических, фармацевтически важных замещенных амфетаминов. - ^ a b Бетт WR (август 1946 г.). «Сульфат бензедрина в клинической медицине; обзор литературы» . Последипломный медицинский журнал . 22 (250): 205–218. DOI : 10.1136 / pgmj.22.250.205 . PMC 2478360 . PMID 20997404 .
- ^ a b Карвалью М., Кармо Х., Коста В.М., Капела Дж. П., Понтес Х., Ремиао Ф., Карвалью Ф., Бастос Мде Л. (август 2012 г.). «Токсичность амфетаминов: обновленная информация». Архив токсикологии . 86 (8): 1167–1231. DOI : 10.1007 / s00204-012-0815-5 . PMID 22392347 . S2CID 2873101 .
- ^ Berman S, O'Neill J, S, Страхи Bartzokis G, London ED (октябрь 2008 г.). «Злоупотребление амфетаминами и структурные нарушения в головном мозге» . Летопись Нью-Йоркской академии наук . 1141 (1): 195–220. DOI : 10.1196 / анналы.1441.031 . PMC 2769923 . PMID 18991959 .
- ^ a b Hart H, Radua J, Nakao T, Mataix-Cols D, Rubia K (февраль 2013 г.). «Мета-анализ функциональной магнитно-резонансной томографии исследований торможения и внимания при синдроме дефицита внимания / гиперактивности: изучение конкретных задач, стимулирующих лекарств и возрастных эффектов» . JAMA Psychiatry . 70 (2): 185–198. DOI : 10,1001 / jamapsychiatry.2013.277 . PMID 23247506 .
- ^ a b Спенсер Т.Дж., Браун А., Сейдман Л.Дж., Валера Е.М., Макрис Н., Ломедико А., Фараоне С.В., Бидерман Дж. (сентябрь 2013 г.). «Влияние психостимуляторов на структуру и функцию мозга при СДВГ: качественный обзор литературы по нейровизуализационным исследованиям на основе магнитно-резонансной томографии» . Журнал клинической психиатрии . 74 (9): 902–917. DOI : 10.4088 / JCP.12r08287 . PMC 3801446 . PMID 24107764 .
- ^ a b Frodl T, Skokauskas N (февраль 2012 г.). «Мета-анализ структурных МРТ-исследований у детей и взрослых с синдромом дефицита внимания и гиперактивности указывает на эффективность лечения» . Acta Psychiatrica Scandinavica . 125 (2): 114–126. DOI : 10.1111 / j.1600-0447.2011.01786.x . PMID 22118249 . S2CID 25954331 .
У детей с СДВГ структурно поражены области базальных ганглиев, такие как правый бледный шар, правая скорлупа и хвостовое ядро. Эти изменения и изменения в лимбических областях, таких как АСС и миндалевидное тело, более выражены в группах населения, не получавших лечения, и, по-видимому, уменьшаются со временем от ребенка к взрослой жизни. Кажется, что лечение положительно влияет на структуру мозга.
- ^ а б в г Милличэп Дж. Г. (2010). «Глава 9: Лекарства от СДВГ». В Millichap JG (ред.). Справочник по синдрому дефицита внимания с гиперактивностью: Руководство для врача по СДВГ (2-е изд.). Нью-Йорк, США: Springer. С. 121–123, 125–127. ISBN 9781441913968.
Текущие исследования дали ответы на многие опасения родителей и подтвердили эффективность и безопасность длительного использования лекарств.
- ^ а б в г д Арнольд Л. Е., Ходжкинс П., Качи Х., Кале Дж., Янг С. (февраль 2015 г.). «Влияние метода лечения на отдаленные результаты при синдроме дефицита внимания / гиперактивности: систематический обзор» . PLOS ONE . 10 (2): e0116407. DOI : 10.1371 / journal.pone.0116407 . PMC 4340791 . PMID 25714373 .
Наибольшая доля улучшенных результатов была отмечена при комбинированном лечении (83% результатов). Среди значительно улучшенных результатов наибольший эффект был обнаружен при комбинированном лечении. Наибольшие улучшения были связаны с академическими результатами, самооценкой или социальными функциями.
Рисунок 3: Польза от лечения по типу лечения и группе результатов - ^ a b c Malenka RC, Nestler EJ, Hyman SE (2009). «Глава 6: Широко распространяющиеся системы: моноамины, ацетилхолин и орексин». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: Фонд клинической неврологии (2-е изд.). Нью-Йорк, США: McGraw-Hill Medical. С. 154–157. ISBN 9780071481274.
- ^ a b c d e Bidwell LC, McClernon FJ, Kollins SH (август 2011 г.). «Когнитивные усилители для лечения СДВГ» . Фармакология, биохимия и поведение . 99 (2): 262–274. DOI : 10.1016 / j.pbb.2011.05.002 . PMC 3353150 . PMID 21596055 .
- ^ Паркер Дж, Уэльс G, Шалхуб N, Harpin V (сентябрь 2013 г. ). «Долгосрочные результаты вмешательств по лечению синдрома дефицита внимания и гиперактивности у детей и подростков: систематический обзор рандомизированных контролируемых исследований» . Психологические исследования и управление поведением . 6 : 87–99. DOI : 10,2147 / PRBM.S49114 . PMC 3785407 . PMID 24082796 .
Только одна статья
53
Критериям обзора соответствовала оценка результатов за период более 36 месяцев. ... Имеются доказательства высокого уровня, свидетельствующие о том, что фармакологическое лечение может иметь значительный положительный эффект на основные симптомы СДВГ (гиперактивность, невнимательность и импульсивность) примерно в 80% случаев по сравнению с контрольной группой плацебо в краткосрочной перспективе.
- ^ Millichap JG (2010). «Глава 9: Лекарства от СДВГ». В Millichap JG (ред.). Справочник по синдрому дефицита внимания с гиперактивностью: Руководство для врача по СДВГ (2-е изд.). Нью-Йорк, США: Springer. С. 111–113. ISBN 9781441913968.
- ^ "Стимуляторы для синдрома дефицита внимания с гиперактивностью" . WebMD . Здорово. 12 апреля 2010 . Проверено 12 ноября 2013 года .
- ^ Scholten RJ, Кларк M, Хейрингтон J (август 2005). «Кокрановское сотрудничество» . Европейский журнал клинического питания . 59 (Дополнение 1): S147 – S149, обсуждение S195 – S196. DOI : 10.1038 / sj.ejcn.1602188 . PMID 16052183 . S2CID 29410060 .
- ^ a b Castells X, Blanco-Silvente L, Cunill R (август 2018 г.). «Амфетамины для лечения синдрома дефицита внимания и гиперактивности (СДВГ) у взрослых» . Кокрановская база данных систематических обзоров . 8 : CD007813. DOI : 10.1002 / 14651858.CD007813.pub3 . PMC 6513464 . PMID 30091808 .
- ^ Punja S, Shamseer л, Хартлинг л, Urichuk л, Вандермеер В, Nikles Дж, Вохра S (февраль 2016). «Амфетамины для лечения синдрома дефицита внимания и гиперактивности (СДВГ) у детей и подростков». Кокрановская база данных систематических обзоров . 2 : CD009996. DOI : 10.1002 / 14651858.CD009996.pub2 . PMID 26844979 .
- ^ Osland ST, Steeves TD, Pringsheim T (June 2018). "Pharmacological treatment for attention deficit hyperactivity disorder (ADHD) in children with comorbid tic disorders". Cochrane Database of Systematic Reviews. 6: CD007990. doi:10.1002/14651858.CD007990.pub3. PMC 6513283. PMID 29944175.
- ^ a b Spencer RC, Devilbiss DM, Berridge CW (June 2015). "The Cognition-Enhancing Effects of Psychostimulants Involve Direct Action in the Prefrontal Cortex". Biological Psychiatry. 77 (11): 940–950. doi:10.1016/j.biopsych.2014.09.013. PMC 4377121. PMID 25499957.
The procognitive actions of psychostimulants are only associated with low doses. Surprisingly, despite nearly 80 years of clinical use, the neurobiology of the procognitive actions of psychostimulants has only recently been systematically investigated. Findings from this research unambiguously demonstrate that the cognition-enhancing effects of psychostimulants involve the preferential elevation of catecholamines in the PFC and the subsequent activation of norepinephrine α2 and dopamine D1 receptors. ... This differential modulation of PFC-dependent processes across dose appears to be associated with the differential involvement of noradrenergic α2 versus α1 receptors. Collectively, this evidence indicates that at low, clinically relevant doses, psychostimulants are devoid of the behavioral and neurochemical actions that define this class of drugs and instead act largely as cognitive enhancers (improving PFC-dependent function). ... In particular, in both animals and humans, lower doses maximally improve performance in tests of working memory and response inhibition, whereas maximal suppression of overt behavior and facilitation of attentional processes occurs at higher doses.
- ^ Ilieva IP, Hook CJ, Farah MJ (June 2015). "Prescription Stimulants' Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-analysis". Journal of Cognitive Neuroscience. 27 (6): 1069–1089. doi:10.1162/jocn_a_00776. PMID 25591060. S2CID 15788121.
Specifically, in a set of experiments limited to high-quality designs, we found significant enhancement of several cognitive abilities. ... The results of this meta-analysis ... do confirm the reality of cognitive enhancing effects for normal healthy adults in general, while also indicating that these effects are modest in size.
- ^ Bagot KS, Kaminer Y (April 2014). "Efficacy of stimulants for cognitive enhancement in non-attention deficit hyperactivity disorder youth: a systematic review". Addiction. 109 (4): 547–557. doi:10.1111/add.12460. PMC 4471173. PMID 24749160.
Amphetamine has been shown to improve consolidation of information (0.02 ≥ P ≤ 0.05), leading to improved recall.
- ^ Devous MD, Trivedi MH, Rush AJ (April 2001). "Regional cerebral blood flow response to oral amphetamine challenge in healthy volunteers". Journal of Nuclear Medicine. 42 (4): 535–542. PMID 11337538.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 10: Neural and Neuroendocrine Control of the Internal Milieu". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. p. 266. ISBN 9780071481274.
Dopamine acts in the nucleus accumbens to attach motivational significance to stimuli associated with reward.
- ^ a b c Wood S, Sage JR, Shuman T, Anagnostaras SG (January 2014). "Psychostimulants and cognition: a continuum of behavioral and cognitive activation". Pharmacological Reviews. 66 (1): 193–221. doi:10.1124/pr.112.007054. PMC 3880463. PMID 24344115.
- ^ Twohey M (26 March 2006). "Pills become an addictive study aid". JS Online. Archived from the original on 15 August 2007. Retrieved 2 December 2007.
- ^ Teter CJ, McCabe SE, LaGrange K, Cranford JA, Boyd CJ (October 2006). "Illicit use of specific prescription stimulants among college students: prevalence, motives, and routes of administration". Pharmacotherapy. 26 (10): 1501–1510. doi:10.1592/phco.26.10.1501. PMC 1794223. PMID 16999660.
- ^ Weyandt LL, Oster DR, Marraccini ME, Gudmundsdottir BG, Munro BA, Zavras BM, Kuhar B (September 2014). "Pharmacological interventions for adolescents and adults with ADHD: stimulant and nonstimulant medications and misuse of prescription stimulants". Psychology Research and Behavior Management. 7: 223–249. doi:10.2147/PRBM.S47013. PMC 4164338. PMID 25228824.
misuse of prescription stimulants has become a serious problem on college campuses across the US and has been recently documented in other countries as well. ... Indeed, large numbers of students claim to have engaged in the nonmedical use of prescription stimulants, which is reflected in lifetime prevalence rates of prescription stimulant misuse ranging from 5% to nearly 34% of students.
- ^ Clemow DB, Walker DJ (September 2014). "The potential for misuse and abuse of medications in ADHD: a review". Postgraduate Medicine. 126 (5): 64–81. doi:10.3810/pgm.2014.09.2801. PMID 25295651. S2CID 207580823.
Overall, the data suggest that ADHD medication misuse and diversion are common health care problems for stimulant medications, with the prevalence believed to be approximately 5% to 10% of high school students and 5% to 35% of college students, depending on the study.
- ^ Bracken NM (January 2012). "National Study of Substance Use Trends Among NCAA College Student-Athletes" (PDF). NCAA Publications. National Collegiate Athletic Association. Retrieved 8 October 2013.
- ^ Docherty JR (June 2008). "Pharmacology of stimulants prohibited by the World Anti-Doping Agency (WADA)". British Journal of Pharmacology. 154 (3): 606–622. doi:10.1038/bjp.2008.124. PMC 2439527. PMID 18500382.
- ^ a b c d Parr JW (July 2011). "Attention-deficit hyperactivity disorder and the athlete: new advances and understanding". Clinics in Sports Medicine. 30 (3): 591–610. doi:10.1016/j.csm.2011.03.007. PMID 21658550.
In 1980, Chandler and Blair47 showed significant increases in knee extension strength, acceleration, anaerobic capacity, time to exhaustion during exercise, pre-exercise and maximum heart rates, and time to exhaustion during maximal oxygen consumption (VO2 max) testing after administration of 15 mg of dextroamphetamine versus placebo. Most of the information to answer this question has been obtained in the past decade through studies of fatigue rather than an attempt to systematically investigate the effect of ADHD drugs on exercise.
- ^ a b c Roelands B, de Koning J, Foster C, Hettinga F, Meeusen R (May 2013). "Neurophysiological determinants of theoretical concepts and mechanisms involved in pacing". Sports Medicine. 43 (5): 301–311. doi:10.1007/s40279-013-0030-4. PMID 23456493. S2CID 30392999.
In high-ambient temperatures, dopaminergic manipulations clearly improve performance. The distribution of the power output reveals that after dopamine reuptake inhibition, subjects are able to maintain a higher power output compared with placebo. ... Dopaminergic drugs appear to override a safety switch and allow athletes to use a reserve capacity that is 'off-limits' in a normal (placebo) situation.
- ^ Parker KL, Lamichhane D, Caetano MS, Narayanan NS (October 2013). "Executive dysfunction in Parkinson's disease and timing deficits". Frontiers in Integrative Neuroscience. 7: 75. doi:10.3389/fnint.2013.00075. PMC 3813949. PMID 24198770.
Manipulations of dopaminergic signaling profoundly influence interval timing, leading to the hypothesis that dopamine influences internal pacemaker, or "clock," activity. For instance, amphetamine, which increases concentrations of dopamine at the synaptic cleft advances the start of responding during interval timing, whereas antagonists of D2 type dopamine receptors typically slow timing;... Depletion of dopamine in healthy volunteers impairs timing, while amphetamine releases synaptic dopamine and speeds up timing.
- ^ Rattray B, Argus C, Martin K, Northey J, Driller M (March 2015). "Is it time to turn our attention toward central mechanisms for post-exertional recovery strategies and performance?". Frontiers in Physiology. 6: 79. doi:10.3389/fphys.2015.00079. PMC 4362407. PMID 25852568.
Aside from accounting for the reduced performance of mentally fatigued participants, this model rationalizes the reduced RPE and hence improved cycling time trial performance of athletes using a glucose mouthwash (Chambers et al., 2009) and the greater power output during a RPE matched cycling time trial following amphetamine ingestion (Swart, 2009). ... Dopamine stimulating drugs are known to enhance aspects of exercise performance (Roelands et al., 2008)
- ^ Roelands B, De Pauw K, Meeusen R (June 2015). "Neurophysiological effects of exercise in the heat". Scandinavian Journal of Medicine & Science in Sports. 25 (Suppl 1): 65–78. doi:10.1111/sms.12350. PMID 25943657. S2CID 22782401.
This indicates that subjects did not feel they were producing more power and consequently more heat. The authors concluded that the "safety switch" or the mechanisms existing in the body to prevent harmful effects are overridden by the drug administration (Roelands et al., 2008b). Taken together, these data indicate strong ergogenic effects of an increased DA concentration in the brain, without any change in the perception of effort.
- ^ Kessler S (January 1996). "Drug therapy in attention-deficit hyperactivity disorder". Southern Medical Journal. 89 (1): 33–38. doi:10.1097/00007611-199601000-00005. PMID 8545689. S2CID 12798818.
statements on package inserts are not intended to limit medical practice. Rather they are intended to limit claims by pharmaceutical companies. ... the FDA asserts explicitly, and the courts have upheld that clinical decisions are to be made by physicians and patients in individual situations.
- ^ a b c d e f g h i j k Heedes G, Ailakis J. "Amphetamine (PIM 934)". INCHEM. International Programme on Chemical Safety. Retrieved 24 June 2014.
- ^ Feinberg SS (November 2004). "Combining stimulants with monoamine oxidase inhibitors: a review of uses and one possible additional indication". The Journal of Clinical Psychiatry. 65 (11): 1520–1524. doi:10.4088/jcp.v65n1113. PMID 15554766.
- ^ Stewart JW, Deliyannides DA, McGrath PJ (June 2014). "How treatable is refractory depression?". Journal of Affective Disorders. 167: 148–152. doi:10.1016/j.jad.2014.05.047. PMID 24972362.
- ^ a b c d Vitiello B (April 2008). "Understanding the risk of using medications for attention deficit hyperactivity disorder with respect to physical growth and cardiovascular function". Child and Adolescent Psychiatric Clinics of North America. 17 (2): 459–474. doi:10.1016/j.chc.2007.11.010. PMC 2408826. PMID 18295156.
- ^ Ramey JT, Bailen E, Lockey RF (2006). "Rhinitis medicamentosa" (PDF). Journal of Investigational Allergology & Clinical Immunology. 16 (3): 148–155. PMID 16784007. Retrieved 29 April 2015.
Table 2. Decongestants Causing Rhinitis Medicamentosa
– Nasal decongestants:
– Sympathomimetic:
• Amphetamine - ^ a b "FDA Drug Safety Communication: Safety Review Update of Medications used to treat Attention-Deficit/Hyperactivity Disorder (ADHD) in children and young adults". United States Food and Drug Administration. 1 November 2011. Archived from the original on 25 August 2019. Retrieved 24 December 2019.
- ^ Cooper WO, Habel LA, Sox CM, Chan KA, Arbogast PG, Cheetham TC, Murray KT, Quinn VP, Stein CM, Callahan ST, Fireman BH, Fish FA, Kirshner HS, O'Duffy A, Connell FA, Ray WA (November 2011). "ADHD drugs and serious cardiovascular events in children and young adults". New England Journal of Medicine. 365 (20): 1896–1904. doi:10.1056/NEJMoa1110212. PMC 4943074. PMID 22043968.
- ^ a b "FDA Drug Safety Communication: Safety Review Update of Medications used to treat Attention-Deficit/Hyperactivity Disorder (ADHD) in adults". United States Food and Drug Administration. 12 December 2011. Archived from the original on 14 December 2019. Retrieved 24 December 2013.
- ^ Habel LA, Cooper WO, Sox CM, Chan KA, Fireman BH, Arbogast PG, Cheetham TC, Quinn VP, Dublin S, Boudreau DM, Andrade SE, Pawloski PA, Raebel MA, Smith DH, Achacoso N, Uratsu C, Go AS, Sidney S, Nguyen-Huynh MN, Ray WA, Selby JV (December 2011). "ADHD medications and risk of serious cardiovascular events in young and middle-aged adults". JAMA. 306 (24): 2673–2683. doi:10.1001/jama.2011.1830. PMC 3350308. PMID 22161946.
- ^ O'Connor PG (February 2012). "Amphetamines". Merck Manual for Health Care Professionals. Merck. Retrieved 8 May 2012.
- ^ a b Childs E, de Wit H (May 2009). "Amphetamine-induced place preference in humans". Biological Psychiatry. 65 (10): 900–904. doi:10.1016/j.biopsych.2008.11.016. PMC 2693956. PMID 19111278.
This study demonstrates that humans, like nonhumans, prefer a place associated with amphetamine administration. These findings support the idea that subjective responses to a drug contribute to its ability to establish place conditioning.
- ^ a b Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and Addictive Disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 364–375. ISBN 9780071481274.
- ^ a b c d e Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues in Clinical Neuroscience. 15 (4): 431–443. PMC 3898681. PMID 24459410.
Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type [nucleus accumbens] neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... Another ΔFosB target is cFos: as ΔFosB accumulates with repeated drug exposure it represses c-Fos and contributes to the molecular switch whereby ΔFosB is selectively induced in the chronic drug-treated state.41. ... Moreover, there is increasing evidence that, despite a range of genetic risks for addiction across the population, exposure to sufficiently high doses of a drug for long periods of time can transform someone who has relatively lower genetic loading into an addict.
- ^ "Glossary of Terms". Mount Sinai School of Medicine. Department of Neuroscience. Retrieved 9 February 2015.
- ^ Volkow ND, Koob GF, McLellan AT (January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". New England Journal of Medicine. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMC 6135257. PMID 26816013.
Substance-use disorder: A diagnostic term in the fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5) referring to recurrent use of alcohol or other drugs that causes clinically and functionally significant impairment, such as health problems, disability, and failure to meet major responsibilities at work, school, or home. Depending on the level of severity, this disorder is classified as mild, moderate, or severe.
Addiction: A term used to indicate the most severe, chronic stage of substance-use disorder, in which there is a substantial loss of self-control, as indicated by compulsive drug taking despite the desire to stop taking the drug. In the DSM-5, the term addiction is synonymous with the classification of severe substance-use disorder. - ^ a b c Renthal W, Nestler EJ (September 2009). "Chromatin regulation in drug addiction and depression". Dialogues in Clinical Neuroscience. 11 (3): 257–268. PMC 2834246. PMID 19877494.
[Psychostimulants] increase cAMP levels in striatum, which activates protein kinase A (PKA) and leads to phosphorylation of its targets. This includes the cAMP response element binding protein (CREB), the phosphorylation of which induces its association with the histone acetyltransferase, CREB binding protein (CBP) to acetylate histones and facilitate gene activation. This is known to occur on many genes including fosB and c-fos in response to psychostimulant exposure. ΔFosB is also upregulated by chronic psychostimulant treatments, and is known to activate certain genes (eg, cdk5) and repress others (eg, c-fos) where it recruits HDAC1 as a corepressor. ... Chronic exposure to psychostimulants increases glutamatergic [signaling] from the prefrontal cortex to the NAc. Glutamatergic signaling elevates Ca2+ levels in NAc postsynaptic elements where it activates CaMK (calcium/calmodulin protein kinases) signaling, which, in addition to phosphorylating CREB, also phosphorylates HDAC5.
Figure 2: Psychostimulant-induced signaling events - ^ Broussard JI (January 2012). "Co-transmission of dopamine and glutamate". The Journal of General Physiology. 139 (1): 93–96. doi:10.1085/jgp.201110659. PMC 3250102. PMID 22200950.
Coincident and convergent input often induces plasticity on a postsynaptic neuron. The NAc integrates processed information about the environment from basolateral amygdala, hippocampus, and prefrontal cortex (PFC), as well as projections from midbrain dopamine neurons. Previous studies have demonstrated how dopamine modulates this integrative process. For example, high frequency stimulation potentiates hippocampal inputs to the NAc while simultaneously depressing PFC synapses (Goto and Grace, 2005). The converse was also shown to be true; stimulation at PFC potentiates PFC–NAc synapses but depresses hippocampal–NAc synapses. In light of the new functional evidence of midbrain dopamine/glutamate co-transmission (references above), new experiments of NAc function will have to test whether midbrain glutamatergic inputs bias or filter either limbic or cortical inputs to guide goal-directed behavior.
- ^ Kanehisa Laboratories (10 October 2014). "Amphetamine – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
Most addictive drugs increase extracellular concentrations of dopamine (DA) in nucleus accumbens (NAc) and medial prefrontal cortex (mPFC), projection areas of mesocorticolimbic DA neurons and key components of the "brain reward circuit". Amphetamine achieves this elevation in extracellular levels of DA by promoting efflux from synaptic terminals. ... Chronic exposure to amphetamine induces a unique transcription factor delta FosB, which plays an essential role in long-term adaptive changes in the brain.
- ^ a b c Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews Neuroscience. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB serves as one of the master control proteins governing this structural plasticity. ... ΔFosB also represses G9a expression, leading to reduced repressive histone methylation at the cdk5 gene. The net result is gene activation and increased CDK5 expression. ... In contrast, ΔFosB binds to the c-fos gene and recruits several co-repressors, including HDAC1 (histone deacetylase 1) and SIRT 1 (sirtuin 1). ... The net result is c-fos gene repression.
Figure 4: Epigenetic basis of drug regulation of gene expression - ^ a b c Nestler EJ (December 2012). "Transcriptional mechanisms of drug addiction". Clinical Psychopharmacology and Neuroscience. 10 (3): 136–143. doi:10.9758/cpn.2012.10.3.136. PMC 3569166. PMID 23430970.
The 35-37 kD ΔFosB isoforms accumulate with chronic drug exposure due to their extraordinarily long half-lives. ... As a result of its stability, the ΔFosB protein persists in neurons for at least several weeks after cessation of drug exposure. ... ΔFosB overexpression in nucleus accumbens induces NFκB ... In contrast, the ability of ΔFosB to repress the c-Fos gene occurs in concert with the recruitment of a histone deacetylase and presumably several other repressive proteins such as a repressive histone methyltransferase
- ^ Nestler EJ (October 2008). "Transcriptional mechanisms of addiction: Role of ΔFosB". Philosophical Transactions of the Royal Society B: Biological Sciences. 363 (1507): 3245–3255. doi:10.1098/rstb.2008.0067. PMC 2607320. PMID 18640924.
Recent evidence has shown that ΔFosB also represses the c-fos gene that helps create the molecular switch—from the induction of several short-lived Fos family proteins after acute drug exposure to the predominant accumulation of ΔFosB after chronic drug exposure
- ^ Kanehisa Laboratories (10 October 2014). "Amphetamine – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
- ^ a b c d e f Nechifor M (March 2008). "Magnesium in drug dependences". Magnesium Research. 21 (1): 5–15. doi:10.1684/mrh.2008.0124 (inactive 15 January 2021). PMID 18557129.CS1 maint: DOI inactive as of January 2021 (link)
- ^ a b c d e Ruffle JK (November 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". The American Journal of Drug and Alcohol Abuse. 40 (6): 428–437. doi:10.3109/00952990.2014.933840. PMID 25083822. S2CID 19157711.
ΔFosB is an essential transcription factor implicated in the molecular and behavioral pathways of addiction following repeated drug exposure.
- ^ a b c d e f g h i j k Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews Neuroscience. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB has been linked directly to several addiction-related behaviors ... Importantly, genetic or viral overexpression of ΔJunD, a dominant negative mutant of JunD which antagonizes ΔFosB- and other AP-1-mediated transcriptional activity, in the NAc or OFC blocks these key effects of drug exposure14,22–24. This indicates that ΔFosB is both necessary and sufficient for many of the changes wrought in the brain by chronic drug exposure. ΔFosB is also induced in D1-type NAc MSNs by chronic consumption of several natural rewards, including sucrose, high fat food, sex, wheel running, where it promotes that consumption14,26–30. This implicates ΔFosB in the regulation of natural rewards under normal conditions and perhaps during pathological addictive-like states. ... ΔFosB serves as one of the master control proteins governing this structural plasticity.
- ^ a b c d e f g h i j k l m n o p q r s t u v Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–1122. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
Similar to environmental enrichment, studies have found that exercise reduces self-administration and relapse to drugs of abuse (Cosgrove et al., 2002; Zlebnik et al., 2010). There is also some evidence that these preclinical findings translate to human populations, as exercise reduces withdrawal symptoms and relapse in abstinent smokers (Daniel et al., 2006; Prochaska et al., 2008), and one drug recovery program has seen success in participants that train for and compete in a marathon as part of the program (Butler, 2005). ... In humans, the role of dopamine signaling in incentive-sensitization processes has recently been highlighted by the observation of a dopamine dysregulation syndrome in some patients taking dopaminergic drugs. This syndrome is characterized by a medication-induced increase in (or compulsive) engagement in non-drug rewards such as gambling, shopping, or sex (Evans et al., 2006; Aiken, 2007; Lader, 2008).
- ^ a b c d Lynch WJ, Peterson AB, Sanchez V, Abel J, Smith MA (September 2013). "Exercise as a novel treatment for drug addiction: a neurobiological and stage-dependent hypothesis". Neuroscience & Biobehavioral Reviews. 37 (8): 1622–1644. doi:10.1016/j.neubiorev.2013.06.011. PMC 3788047. PMID 23806439.
These findings suggest that exercise may "magnitude"-dependently prevent the development of an addicted phenotype possibly by blocking/reversing behavioral and neuroadaptive changes that develop during and following extended access to the drug. ... Exercise has been proposed as a treatment for drug addiction that may reduce drug craving and risk of relapse. Although few clinical studies have investigated the efficacy of exercise for preventing relapse, the few studies that have been conducted generally report a reduction in drug craving and better treatment outcomes ... Taken together, these data suggest that the potential benefits of exercise during relapse, particularly for relapse to psychostimulants, may be mediated via chromatin remodeling and possibly lead to greater treatment outcomes.
- ^ a b c Zhou Y, Zhao M, Zhou C, Li R (July 2015). "Sex differences in drug addiction and response to exercise intervention: From human to animal studies". Frontiers in Neuroendocrinology. 40: 24–41. doi:10.1016/j.yfrne.2015.07.001. PMC 4712120. PMID 26182835.
Collectively, these findings demonstrate that exercise may serve as a substitute or competition for drug abuse by changing ΔFosB or cFos immunoreactivity in the reward system to protect against later or previous drug use. ... The postulate that exercise serves as an ideal intervention for drug addiction has been widely recognized and used in human and animal rehabilitation.
- ^ a b c Linke SE, Ussher M (January 2015). "Exercise-based treatments for substance use disorders: evidence, theory, and practicality". The American Journal of Drug and Alcohol Abuse. 41 (1): 7–15. doi:10.3109/00952990.2014.976708. PMC 4831948. PMID 25397661.
The limited research conducted suggests that exercise may be an effective adjunctive treatment for SUDs. In contrast to the scarce intervention trials to date, a relative abundance of literature on the theoretical and practical reasons supporting the investigation of this topic has been published. ... numerous theoretical and practical reasons support exercise-based treatments for SUDs, including psychological, behavioral, neurobiological, nearly universal safety profile, and overall positive health effects.
- ^ Hyman SE, Malenka RC, Nestler EJ (July 2006). "Neural mechanisms of addiction: the role of reward-related learning and memory" (PDF). Annual Review of Neuroscience. 29: 565–598. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597. S2CID 15139406. Archived from the original (PDF) on 19 September 2018.
- ^ a b c d e Steiner H, Van Waes V (January 2013). "Addiction-related gene regulation: risks of exposure to cognitive enhancers vs. other psychostimulants". Progress in Neurobiology. 100: 60–80. doi:10.1016/j.pneurobio.2012.10.001. PMC 3525776. PMID 23085425.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 4: Signal Transduction in the Brain". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. p. 94. ISBN 9780071481274.
- ^ Kanehisa Laboratories (29 October 2014). "Alcoholism – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
- ^ Kim Y, Teylan MA, Baron M, Sands A, Nairn AC, Greengard P (February 2009). "Methylphenidate-induced dendritic spine formation and DeltaFosB expression in nucleus accumbens". Proceedings of the National Academy of Sciences. 106 (8): 2915–2920. Bibcode:2009PNAS..106.2915K. doi:10.1073/pnas.0813179106. PMC 2650365. PMID 19202072.
- ^ a b Nestler EJ (January 2014). "Epigenetic mechanisms of drug addiction". Neuropharmacology. 76 Pt B: 259–268. doi:10.1016/j.neuropharm.2013.04.004. PMC 3766384. PMID 23643695.
- ^ a b Biliński P, Wojtyła A, Kapka-Skrzypczak L, Chwedorowicz R, Cyranka M, Studziński T (2012). "Epigenetic regulation in drug addiction". Annals of Agricultural and Environmental Medicine. 19 (3): 491–496. PMID 23020045.
- ^ Kennedy PJ, Feng J, Robison AJ, Maze I, Badimon A, Mouzon E, Chaudhury D, Damez-Werno DM, Haggarty SJ, Han MH, Bassel-Duby R, Olson EN, Nestler EJ (April 2013). "Class I HDAC inhibition blocks cocaine-induced plasticity by targeted changes in histone methylation". Nature Neuroscience. 16 (4): 434–440. doi:10.1038/nn.3354. PMC 3609040. PMID 23475113.
- ^ Whalley K (December 2014). "Psychiatric disorders: a feat of epigenetic engineering". Nature Reviews. Neuroscience. 15 (12): 768–769. doi:10.1038/nrn3869. PMID 25409693. S2CID 11513288.
- ^ a b Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Gold M (March 2012). "Sex, drugs, and rock 'n' roll: hypothesizing common mesolimbic activation as a function of reward gene polymorphisms". Journal of Psychoactive Drugs. 44 (1): 38–55. doi:10.1080/02791072.2012.662112. PMC 4040958. PMID 22641964.
It has been found that deltaFosB gene in the NAc is critical for reinforcing effects of sexual reward. Pitchers and colleagues (2010) reported that sexual experience was shown to cause DeltaFosB accumulation in several limbic brain regions including the NAc, medial pre-frontal cortex, VTA, caudate, and putamen, but not the medial preoptic nucleus. ... these findings support a critical role for DeltaFosB expression in the NAc in the reinforcing effects of sexual behavior and sexual experience-induced facilitation of sexual performance. ... both drug addiction and sexual addiction represent pathological forms of neuroplasticity along with the emergence of aberrant behaviors involving a cascade of neurochemical changes mainly in the brain's rewarding circuitry.
- ^ Pitchers KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (February 2013). "Natural and drug rewards act on common neural plasticity mechanisms with ΔFosB as a key mediator". The Journal of Neuroscience. 33 (8): 3434–3442. doi:10.1523/JNEUROSCI.4881-12.2013. PMC 3865508. PMID 23426671.
- ^ Beloate LN, Weems PW, Casey GR, Webb IC, Coolen LM (February 2016). "Nucleus accumbens NMDA receptor activation regulates amphetamine cross-sensitization and deltaFosB expression following sexual experience in male rats". Neuropharmacology. 101: 154–164. doi:10.1016/j.neuropharm.2015.09.023. PMID 26391065. S2CID 25317397.
- ^ Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 16: Reinforcement and Addictive Disorders". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 9780071827706.
Pharmacologic treatment for psychostimulant addiction is generally unsatisfactory. As previously discussed, cessation of cocaine use and the use of other psychostimulants in dependent individuals does not produce a physical withdrawal syndrome but may produce dysphoria, anhedonia, and an intense desire to reinitiate drug use.
- ^ a b c d Chan B, Freeman M, Kondo K, Ayers C, Montgomery J, Paynter R, Kansagara D (December 2019). "Pharmacotherapy for methamphetamine/amphetamine use disorder-a systematic review and meta-analysis". Addiction (Abingdon, England). 114 (12): 2122–2136. doi:10.1111/add.14755. PMID 31328345.
- ^ Stoops WW, Rush CR (May 2014). "Combination pharmacotherapies for stimulant use disorder: a review of clinical findings and recommendations for future research". Expert Review of Clinical Pharmacology. 7 (3): 363–374. doi:10.1586/17512433.2014.909283. PMC 4017926. PMID 24716825.
Despite concerted efforts to identify a pharmacotherapy for managing stimulant use disorders, no widely effective medications have been approved.
- ^ a b Jing L, Li JX (August 2015). "Trace amine-associated receptor 1: A promising target for the treatment of psychostimulant addiction". European Journal of Pharmacology. 761: 345–352. doi:10.1016/j.ejphar.2015.06.019. PMC 4532615. PMID 26092759.
Existing data provided robust preclinical evidence supporting the development of TAAR1 agonists as potential treatment for psychostimulant abuse and addiction.
- ^ a b Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 5: Excitatory and Inhibitory Amino Acids". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. pp. 124–125. ISBN 9780071481274.
- ^ a b c Carroll ME, Smethells JR (February 2016). "Sex Differences in Behavioral Dyscontrol: Role in Drug Addiction and Novel Treatments". Frontiers in Psychiatry. 6: 175. doi:10.3389/fpsyt.2015.00175. PMC 4745113. PMID 26903885.
Physical Exercise
There is accelerating evidence that physical exercise is a useful treatment for preventing and reducing drug addiction ... In some individuals, exercise has its own rewarding effects, and a behavioral economic interaction may occur, such that physical and social rewards of exercise can substitute for the rewarding effects of drug abuse. ... The value of this form of treatment for drug addiction in laboratory animals and humans is that exercise, if it can substitute for the rewarding effects of drugs, could be self-maintained over an extended period of time. Work to date in [laboratory animals and humans] regarding exercise as a treatment for drug addiction supports this hypothesis. ... Animal and human research on physical exercise as a treatment for stimulant addiction indicates that this is one of the most promising treatments on the horizon. - ^ Perez-Mana C, Castells X, Torrens M, Capella D, Farre M (September 2013). "Efficacy of psychostimulant drugs for amphetamine abuse or dependence". Cochrane Database of Systematic Reviews. 9 (9): CD009695. doi:10.1002/14651858.CD009695.pub2. PMID 23996457.
- ^ "Amphetamines: Drug Use and Abuse". Merck Manual Home Edition. Merck. February 2003. Archived from the original on 17 February 2007. Retrieved 28 February 2007.
- ^ a b c d Shoptaw SJ, Kao U, Heinzerling K, Ling W (April 2009). Shoptaw SJ (ed.). "Treatment for amphetamine withdrawal". Cochrane Database of Systematic Reviews (2): CD003021. doi:10.1002/14651858.CD003021.pub2. PMC 7138250. PMID 19370579.
The prevalence of this withdrawal syndrome is extremely common (Cantwell 1998; Gossop 1982) with 87.6% of 647 individuals with amphetamine dependence reporting six or more signs of amphetamine withdrawal listed in the DSM when the drug is not available (Schuckit 1999) ... The severity of withdrawal symptoms is greater in amphetamine dependent individuals who are older and who have more extensive amphetamine use disorders (McGregor 2005). Withdrawal symptoms typically present within 24 hours of the last use of amphetamine, with a withdrawal syndrome involving two general phases that can last 3 weeks or more. The first phase of this syndrome is the initial "crash" that resolves within about a week (Gossop 1982;McGregor 2005) ...
- ^ a b Spiller HA, Hays HL, Aleguas A (June 2013). "Overdose of drugs for attention-deficit hyperactivity disorder: clinical presentation, mechanisms of toxicity, and management". CNS Drugs. 27 (7): 531–543. doi:10.1007/s40263-013-0084-8. PMID 23757186. S2CID 40931380.
Amphetamine, dextroamphetamine, and methylphenidate act as substrates for the cellular monoamine transporter, especially the dopamine transporter (DAT) and less so the norepinephrine (NET) and serotonin transporter. The mechanism of toxicity is primarily related to excessive extracellular dopamine, norepinephrine, and serotonin.
- ^ Collaborators (2015). "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013". The Lancet. 385 (9963): 117–171. doi:10.1016/S0140-6736(14)61682-2. hdl:11655/15525. PMC 4340604. PMID 25530442.
Amphetamine use disorders ... 3,788 (3,425–4,145)
- ^ Albertson TE (2011). "Amphetamines". In Olson KR, Anderson IB, Benowitz NL, Blanc PD, Kearney TE, Kim-Katz SY, Wu AH (eds.). Poisoning & Drug Overdose (6th ed.). New York: McGraw-Hill Medical. pp. 77–79. ISBN 9780071668330.
- ^ Advokat C (July 2007). "Update on amphetamine neurotoxicity and its relevance to the treatment of ADHD". Journal of Attention Disorders. 11 (1): 8–16. doi:10.1177/1087054706295605. PMID 17606768. S2CID 7582744.
- ^ a b c d Bowyer JF, Hanig JP (November 2014). "Amphetamine- and methamphetamine-induced hyperthermia: Implications of the effects produced in brain vasculature and peripheral organs to forebrain neurotoxicity". Temperature. 1 (3): 172–182. doi:10.4161/23328940.2014.982049. PMC 5008711. PMID 27626044.
Hyperthermia alone does not produce amphetamine-like neurotoxicity but AMPH and METH exposures that do not produce hyperthermia (≥40 °C) are minimally neurotoxic. Hyperthermia likely enhances AMPH and METH neurotoxicity directly through disruption of protein function, ion channels and enhanced ROS production. ... The hyperthermia and the hypertension produced by high doses amphetamines are a primary cause of transient breakdowns in the blood-brain barrier (BBB) resulting in concomitant regional neurodegeneration and neuroinflammation in laboratory animals. ... In animal models that evaluate the neurotoxicity of AMPH and METH, it is quite clear that hyperthermia is one of the essential components necessary for the production of histological signs of dopamine terminal damage and neurodegeneration in cortex, striatum, thalamus and hippocampus.
- ^ "Amphetamine". United States National Library of Medicine – Toxicology Data Network. Hazardous Substances Data Bank. Archived from the original on 2 October 2017. Retrieved 2 October 2017.
Direct toxic damage to vessels seems unlikely because of the dilution that occurs before the drug reaches the cerebral circulation.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and addictive disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. p. 370. ISBN 9780071481274.
Unlike cocaine and amphetamine, methamphetamine is directly toxic to midbrain dopamine neurons.
- ^ Sulzer D, Zecca L (February 2000). "Intraneuronal dopamine-quinone synthesis: a review". Neurotoxicity Research. 1 (3): 181–195. doi:10.1007/BF03033289. PMID 12835101. S2CID 21892355.
- ^ Miyazaki I, Asanuma M (June 2008). "Dopaminergic neuron-specific oxidative stress caused by dopamine itself" (PDF). Acta Medica Okayama. 62 (3): 141–150. doi:10.18926/AMO/30942. PMID 18596830.
- ^ Hofmann FG (1983). A Handbook on Drug and Alcohol Abuse: The Biomedical Aspects (2nd ed.). New York, USA: Oxford University Press. p. 329. ISBN 9780195030570.
- ^ Hasenhuetl PS, Bhat S, Freissmuth M, Sandtner W (March 2019). "Functional Selectivity and Partial Efficacy at the Monoamine Transporters: A Unified Model of Allosteric Modulation and Amphetamine-Induced Substrate Release". Molecular Pharmacology. 95 (3): 303–312. doi:10.1124/mol.118.114793. PMID 30567955. S2CID 58557130.
Although the monoamine transport cycle has been resolved in considerable detail, kinetic knowledge on the molecular actions of synthetic allosteric modulators is still scarce. Fortunately, the DAT catalytic cycle is allosterically modulated by an endogenous ligand (namely, Zn2+; Norregaard et al., 1998). It is worth consulting Zn2+ as an instructive example, because its action on the DAT catalytic cycle has been deciphered to a large extent ... Zn+ binding stabilizes the outward-facing conformation of DAT ... This potentiates both the forward-transport mode (i.e., DA uptake; Li et al., 2015) and the substrate-exchange mode (i.e., amphetamine-induced DA release; Meinild et al., 2004; Li et al., 2015). Importantly, the potentiating effect on substrate uptake is only evident when internal Na+ concentrations are low ... If internal Na+ concentrations rise during the experiment, the substrate-exchange mode dominates and the net effect of Zn2+ on uptake is inhibitory. Conversely, Zn2+ accelerates amphetamine-induced substrate release via DAT. ... t is important to emphasize that Zn2+ has been shown to reduce dopamine uptake under conditions that favor intracellular Na+ accumulation
Fig. 3. Functional selectivity by conformational selection. - ^ Krause J (April 2008). "SPECT and PET of the dopamine transporter in attention-deficit/hyperactivity disorder". Expert Review of Neurotherapeutics. 8 (4): 611–625. doi:10.1586/14737175.8.4.611. PMID 18416663. S2CID 24589993.
Zinc binds at ... extracellular sites of the DAT [103], serving as a DAT inhibitor. In this context, controlled double-blind studies in children are of interest, which showed positive effects of zinc [supplementation] on symptoms of ADHD [105,106]. It should be stated that at this time [supplementation] with zinc is not integrated in any ADHD treatment algorithm.
- ^ a b Scholze P, Nørregaard L, Singer EA, Freissmuth M, Gether U, Sitte HH (June 2002). "The role of zinc ions in reverse transport mediated by monoamine transporters". Journal of Biological Chemistry. 277 (24): 21505–21513. doi:10.1074/jbc.M112265200. PMID 11940571. S2CID 10521850.
The human dopamine transporter (hDAT) contains an endogenous high affinity Zn2+ binding site with three coordinating residues on its extracellular face (His193, His375, and Glu396). ... Although Zn2+ inhibited uptake, Zn2+ facilitated [3H]MPP+ release induced by amphetamine, MPP+, or K+-induced depolarization specifically at hDAT but not at the human serotonin and the norepinephrine transporter (hNET). ... Surprisingly, this amphetamine-elicited efflux was markedly enhanced, rather than inhibited, by the addition of 10 μM Zn2+ to the superfusion buffer (Fig. 2 A, open squares). ... The concentrations of Zn2+ shown in this study, required for the stimulation of dopamine release (as well as inhibition of uptake), covered this physiologically relevant range, with maximum stimulation occurring at 3–30 μM. ... Thus, when Zn2+ is co-released with glutamate, it may greatly augment the efflux of dopamine.
- ^ Kahlig KM, Lute BJ, Wei Y, Loland CJ, Gether U, Javitch JA, Galli A (August 2006). "Regulation of dopamine transporter trafficking by intracellular amphetamine". Molecular Pharmacology. 70 (2): 542–548. doi:10.1124/mol.106.023952. PMID 16684900. S2CID 10317113.
Coadministration of Zn(2+) and AMPH consistently reduced WT-hDAT trafficking
- ^ Scassellati C, Bonvicini C, Faraone SV, Gennarelli M (October 2012). "Biomarkers and attention-deficit/hyperactivity disorder: a systematic review and meta-analyses". Journal of the American Academy of Child & Adolescent Psychiatry. 51 (10): 1003–1019.e20. doi:10.1016/j.jaac.2012.08.015. PMID 23021477.
With regard to zinc supplementation, a placebo controlled trial reported that doses up to 30 mg/day of zinc were safe for at least 8 weeks, but the clinical effect was equivocal except for the finding of a 37% reduction in amphetamine optimal dose with 30 mg per day of zinc.110
- ^ a b c d e f g h i j k l m n Eiden LE, Weihe E (January 2011). "VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse". Annals of the New York Academy of Sciences. 1216 (1): 86–98. doi:10.1111/j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... [Trace aminergic] neurons in mammalian CNS would be identifiable as neurons expressing VMAT2 for storage, and the biosynthetic enzyme aromatic amino acid decarboxylase (AADC). ... AMPH release of DA from synapses requires both an action at VMAT2 to release DA to the cytoplasm and a concerted release of DA from the cytoplasm via "reverse transport" through DAT.
- ^ a b c d Sulzer D, Cragg SJ, Rice ME (August 2016). "Striatal dopamine neurotransmission: regulation of release and uptake". Basal Ganglia. 6 (3): 123–148. doi:10.1016/j.baga.2016.02.001. PMC 4850498. PMID 27141430.
Despite the challenges in determining synaptic vesicle pH, the proton gradient across the vesicle membrane is of fundamental importance for its function. Exposure of isolated catecholamine vesicles to protonophores collapses the pH gradient and rapidly redistributes transmitter from inside to outside the vesicle. ... Amphetamine and its derivatives like methamphetamine are weak base compounds that are the only widely used class of drugs known to elicit transmitter release by a non-exocytic mechanism. As substrates for both DAT and VMAT, amphetamines can be taken up to the cytosol and then sequestered in vesicles, where they act to collapse the vesicular pH gradient.
- ^ a b Ledonne A, Berretta N, Davoli A, Rizzo GR, Bernardi G, Mercuri NB (July 2011). "Electrophysiological effects of trace amines on mesencephalic dopaminergic neurons". Frontiers in Systems Neuroscience. 5: 56. doi:10.3389/fnsys.2011.00056. PMC 3131148. PMID 21772817.
Three important new aspects of TAs action have recently emerged: (a) inhibition of firing due to increased release of dopamine; (b) reduction of D2 and GABAB receptor-mediated inhibitory responses (excitatory effects due to disinhibition); and (c) a direct TA1 receptor-mediated activation of GIRK channels which produce cell membrane hyperpolarization.
- ^ a b "TAAR1". GenAtlas. University of Paris. 28 January 2012. Retrieved 29 May 2014.
• tonically activates inwardly rectifying K(+) channels, which reduces the basal firing frequency of dopamine (DA) neurons of the ventral tegmental area (VTA)
- ^ a b c d e f Underhill SM, Wheeler DS, Li M, Watts SD, Ingram SL, Amara SG (July 2014). "Amphetamine modulates excitatory neurotransmission through endocytosis of the glutamate transporter EAAT3 in dopamine neurons". Neuron. 83 (2): 404–416. doi:10.1016/j.neuron.2014.05.043. PMC 4159050. PMID 25033183.
AMPH also increases intracellular calcium (Gnegy et al., 2004) that is associated with calmodulin/CamKII activation (Wei et al., 2007) and modulation and trafficking of the DAT (Fog et al., 2006; Sakrikar et al., 2012). ... For example, AMPH increases extracellular glutamate in various brain regions including the striatum, VTA and NAc (Del Arco et al., 1999; Kim et al., 1981; Mora and Porras, 1993; Xue et al., 1996), but it has not been established whether this change can be explained by increased synaptic release or by reduced clearance of glutamate. ... DHK-sensitive, EAAT2 uptake was not altered by AMPH (Figure 1A). The remaining glutamate transport in these midbrain cultures is likely mediated by EAAT3 and this component was significantly decreased by AMPH
- ^ a b Vaughan RA, Foster JD (September 2013). "Mechanisms of dopamine transporter regulation in normal and disease states". Trends in Pharmacological Sciences. 34 (9): 489–496. doi:10.1016/j.tips.2013.07.005. PMC 3831354. PMID 23968642.
AMPH and METH also stimulate DA efflux, which is thought to be a crucial element in their addictive properties [80], although the mechanisms do not appear to be identical for each drug [81]. These processes are PKCβ– and CaMK–dependent [72, 82], and PKCβ knock-out mice display decreased AMPH-induced efflux that correlates with reduced AMPH-induced locomotion [72].
- ^ a b Maguire JJ, Davenport AP (2 December 2014). "TA1 receptor". IUPHAR database. International Union of Basic and Clinical Pharmacology. Retrieved 8 December 2014.
- ^ Borowsky B, Adham N, Jones KA, Raddatz R, Artymyshyn R, Ogozalek KL, Durkin MM, Lakhlani PP, Bonini JA, Pathirana S, Boyle N, Pu X, Kouranova E, Lichtblau H, Ochoa FY, Branchek TA, Gerald C (July 2001). "Trace amines: identification of a family of mammalian G protein-coupled receptors". Proceedings of the National Academy of Sciences. 98 (16): 8966–8971. Bibcode:2001PNAS...98.8966B. doi:10.1073/pnas.151105198. PMC 55357. PMID 11459929.
- ^ a b "SLC18 family of vesicular amine transporters". IUPHAR database. International Union of Basic and Clinical Pharmacology. Retrieved 13 November 2015.
- ^ a b c d "SLC1A1 solute carrier family 1 (neuronal/epithelial high affinity glutamate transporter, system Xag), member 1 [ Homo sapiens (human) ]". NCBI Gene. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 11 November 2014.
Amphetamine modulates excitatory neurotransmission through endocytosis of the glutamate transporter EAAT3 in dopamine neurons. ... internalization of EAAT3 triggered by amphetamine increases glutamatergic signaling and thus contributes to the effects of amphetamine on neurotransmission.
- ^ Zhu HJ, Appel DI, Gründemann D, Markowitz JS (July 2010). "Interaction of organic cation transporter 3 (SLC22A3) and amphetamine". Journal of Neurochemistry. 114 (1): 142–149. doi:10.1111/j.1471-4159.2010.06738.x. PMC 3775896. PMID 20402963.
- ^ Rytting E, Audus KL (January 2005). "Novel organic cation transporter 2-mediated carnitine uptake in placental choriocarcinoma (BeWo) cells". Journal of Pharmacology and Experimental Therapeutics. 312 (1): 192–198. doi:10.1124/jpet.104.072363. PMID 15316089. S2CID 31465243.
- ^ Inazu M, Takeda H, Matsumiya T (August 2003). "[The role of glial monoamine transporters in the central nervous system]". Nihon Shinkei Seishin Yakurigaku Zasshi (in Japanese). 23 (4): 171–178. PMID 13677912.
- ^ a b c Vicentic A, Jones DC (February 2007). "The CART (cocaine- and amphetamine-regulated transcript) system in appetite and drug addiction". Journal of Pharmacology and Experimental Therapeutics. 320 (2): 499–506. doi:10.1124/jpet.105.091512. PMID 16840648. S2CID 14212763.
The physiological importance of CART was further substantiated in numerous human studies demonstrating a role of CART in both feeding and psychostimulant addiction. ... Colocalization studies also support a role for CART in the actions of psychostimulants. ... CART and DA receptor transcripts colocalize (Beaudry et al., 2004). Second, dopaminergic nerve terminals in the NAc synapse on CART-containing neurons (Koylu et al., 1999), hence providing the proximity required for neurotransmitter signaling. These studies suggest that DA plays a role in regulating CART gene expression possibly via the activation of CREB.
- ^ Zhang M, Han L, Xu Y (June 2012). "Roles of cocaine- and amphetamine-regulated transcript in the central nervous system". Clinical and Experimental Pharmacology and Physiology. 39 (6): 586–592. doi:10.1111/j.1440-1681.2011.05642.x. PMID 22077697. S2CID 25134612.
Recently, it was demonstrated that CART, as a neurotrophic peptide, had a cerebroprotective against focal ischaemic stroke and inhibited the neurotoxicity of β-amyloid protein, which focused attention on the role of CART in the central nervous system (CNS) and neurological diseases. ... The literature indicates that there are many factors, such as regulation of the immunological system and protection against energy failure, that may be involved in the cerebroprotection afforded by CART
- ^ a b Rogge G, Jones D, Hubert GW, Lin Y, Kuhar MJ (October 2008). "CART peptides: regulators of body weight, reward and other functions". Nature Reviews Neuroscience. 9 (10): 747–758. doi:10.1038/nrn2493. PMC 4418456. PMID 18802445.
Several studies on CART (cocaine- and amphetamine-regulated transcript)-peptide-induced cell signalling have demonstrated that CART peptides activate at least three signalling mechanisms. First, CART 55–102 inhibited voltage-gated L-type Ca2+ channels ...
- ^ Lin Y, Hall RA, Kuhar MJ (October 2011). "CART peptide stimulation of G protein-mediated signaling in differentiated PC12 cells: identification of PACAP 6–38 as a CART receptor antagonist". Neuropeptides. 45 (5): 351–358. doi:10.1016/j.npep.2011.07.006. PMC 3170513. PMID 21855138.
- ^ "Monoamine oxidase (Homo sapiens)". BRENDA. Technische Universität Braunschweig. 1 January 2014. Retrieved 4 May 2014.
- ^ a b c "Targets". Amphetamine. T3DB. University of Alberta. Retrieved 24 February 2015.
- ^ a b Toll L, Berzetei-Gurske IP, Polgar WE, Brandt SR, Adapa ID, Rodriguez L, Schwartz RW, Haggart D, O'Brien A, White A, Kennedy JM, Craymer K, Farrington L, Auh JS (March 1998). "Standard binding and functional assays related to medications development division testing for potential cocaine and opiate narcotic treatment medications". NIDA Research Monograph. 178: 440–466. PMID 9686407.
- ^ a b Finnema SJ, Scheinin M, Shahid M, Lehto J, Borroni E, Bang-Andersen B, Sallinen J, Wong E, Farde L, Halldin C, Grimwood S (November 2015). "Application of cross-species PET imaging to assess neurotransmitter release in brain". Psychopharmacology. 232 (21–22): 4129–4157. doi:10.1007/s00213-015-3938-6. PMC 4600473. PMID 25921033.
More recently, Colasanti and colleagues reported that a pharmacologically induced elevation in endogenous opioid release reduced [11C]carfentanil binding in several regions of the human brain, including the basal ganglia, frontal cortex, and thalamus (Colasanti et al. 2012). Oral administration of d-amphetamine, 0.5 mg/kg, 3 h before [11C]carfentanil injection, reduced BPND values by 2–10%. The results were confirmed in another group of subjects (Mick et al. 2014). However, Guterstam and colleagues observed no change in [11C]carfentanil binding when d-amphetamine, 0.3 mg/kg, was administered intravenously directly before injection of [11C]carfentanil (Guterstam et al. 2013). It has been hypothesized that this discrepancy may be related to delayed increases in extracellular opioid peptide concentrations following amphetamine-evoked monoamine release (Colasanti et al. 2012; Mick et al. 2014).
- ^ a b Loseth GE, Ellingsen DM, Leknes S (December 2014). "State-dependent μ-opioid modulation of social motivation". Frontiers in Behavioral Neuroscience. 8: 430. doi:10.3389/fnbeh.2014.00430. PMC 4264475. PMID 25565999.
Similar MOR activation patterns were reported during positive mood induced by an amusing video clip (Koepp et al., 2009) and following amphetamine administration in humans (Colasanti et al., 2012).
- ^ a b Colasanti A, Searle GE, Long CJ, Hill SP, Reiley RR, Quelch D, Erritzoe D, Tziortzi AC, Reed LJ, Lingford-Hughes AR, Waldman AD, Schruers KR, Matthews PM, Gunn RN, Nutt DJ, Rabiner EA (September 2012). "Endogenous opioid release in the human brain reward system induced by acute amphetamine administration". Biological Psychiatry. 72 (5): 371–377. doi:10.1016/j.biopsych.2012.01.027. PMID 22386378. S2CID 18555036.
- ^ a b c Gunne LM (2013). "Effects of Amphetamines in Humans". Drug Addiction II: Amphetamine, Psychotogen, and Marihuana Dependence. Berlin, Germany; Heidelberg, Germany: Springer. pp. 247–260. ISBN 9783642667091. Retrieved 4 December 2015.
- ^ a b c Oswald LM, Wong DF, McCaul M, Zhou Y, Kuwabara H, Choi L, Brasic J, Wand GS (April 2005). "Relationships among ventral striatal dopamine release, cortisol secretion, and subjective responses to amphetamine". Neuropsychopharmacology. 30 (4): 821–832. doi:10.1038/sj.npp.1300667. PMID 15702139. S2CID 12302237.
Findings from several prior investigations have shown that plasma levels of glucocorticoids and ACTH are increased by acute administration of AMPH in both rodents and humans
- ^ a b c d e f g h i j Angeli A, Vaiano F, Mari F, Bertol E, Supuran CT (December 2017). "Psychoactive substances belonging to the amphetamine class potently activate brain carbonic anhydrase isoforms VA, VB, VII, and XII". Journal of Enzyme Inhibition and Medicinal Chemistry. 32 (1): 1253–1259. doi:10.1080/14756366.2017.1375485. PMC 6009978. PMID 28936885.
Here, we report the first such study, showing that amphetamine, methamphetamine, phentermine, mephentermine, and chlorphenteramine, potently activate several CA isoforms, some of which are highly abundant in the brain, where they play important functions connected to cognition and memory, among others26,27. ... We investigated psychotropic amines based on the phenethylamine scaffold, such as amphetamine 5, methamphetamine 6, phentermine 7, mephentermine 8, and the structurally diverse chlorphenteramine 9, for their activating effects on 11 CA isoforms of human origin ... The widespread hCA I and II, the secreted hCA VI, as well as the cytosolic hCA XIII and membrane-bound hCA IX and XIV were poorly activated by these amines, whereas the extracellular hCA IV, the mitochondrial enzymes hCA VA/VB, the cytosolic hCA VII, and the transmembrane isoform hCA XII were potently activated. Some of these enzymes (hCA VII, VA, VB, XII) are abundant in the brain, raising the possibility that some of the cognitive effects of such psychoactive substances might be related to the activation of these enzymes. ... CAAs started to be considered only recently for possible pharmacologic applications in memory/cognition therapy27. This work may bring new lights on the intricate relationship between CA activation by this type of compounds and the multitude of pharmacologic actions that they can elicit.
Table 1: CA activation of isoforms hCA I, II, IV, VII, and XIII [5: amphetamine]
Table 2: CA activation of isoforms hCA VA, VB, VI, IX, XII, and XIV [5: amphetamine] - ^ a b Lewin AH, Miller GM, Gilmour B (December 2011). "Trace amine-associated receptor 1 is a stereoselective binding site for compounds in the amphetamine class". Bioorganic & Medicinal Chemistry. 19 (23): 7044–7048. doi:10.1016/j.bmc.2011.10.007. PMC 3236098. PMID 22037049.
- ^ a b Maguire JJ, Parker WA, Foord SM, Bonner TI, Neubig RR, Davenport AP (March 2009). "International Union of Pharmacology. LXXII. Recommendations for trace amine receptor nomenclature". Pharmacological Reviews. 61 (1): 1–8. doi:10.1124/pr.109.001107. PMC 2830119. PMID 19325074.
- ^ Revel FG, Moreau JL, Gainetdinov RR, Bradaia A, Sotnikova TD, Mory R, Durkin S, Zbinden KG, Norcross R, Meyer CA, Metzler V, Chaboz S, Ozmen L, Trube G, Pouzet B, Bettler B, Caron MG, Wettstein JG, Hoener MC (May 2011). "TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity". Proceedings of the National Academy of Sciences. 108 (20): 8485–8490. doi:10.1073/pnas.1103029108. PMC 3101002. PMID 21525407.
- ^ a b "Amphetamine: Biological activity". IUPHAR/BPS Guide to Pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 31 December 2019.
- ^ a b Bozdag M, Altamimi AA, Vullo D, Supuran CT, Carta F (2019). "State of the Art on Carbonic Anhydrase Modulators for Biomedical Purposes". Current Medicinal Chemistry. 26 (15): 2558–2573. doi:10.2174/0929867325666180622120625. PMID 29932025.
CARBONIC ANHYDRASE INHIBITORS (CAIs). The design and development of CAIs represent the most prolific area within the CA research field. Since the introduction of CAIs in the clinical use in the 40', they still are the first choice for the treatment of edema [9], altitude sickness [9], glaucoma [7] and epilepsy [31]. ... CARBONIC ANHYDRASE ACTIVATORS (CAAs) ... The emerging class of CAAs has recently gained attraction as the enhancement of the kinetic properties in hCAs expressed in the CNS were proved in animal models to be beneficial for the treatment of both cognitive and memory impairments. Thus, CAAs have enormous potentiality in medicinal chemistry to be developed for the treatment of symptoms associated to aging, trauma or deterioration of the CNS tissues.
- ^ a b c d e f "Vyvanse- lisdexamfetamine dimesylate capsule Vyvanse- lisdexamfetamine dimesylate tablet, chewable". DailyMed. Shire US Inc. 30 October 2019. Retrieved 22 December 2019.
- ^ "Compound Summary". p-Hydroxyamphetamine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Compound Summary". p-Hydroxynorephedrine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Compound Summary". Phenylpropanolamine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Pharmacology and Biochemistry". Amphetamine. Pubchem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 12 October 2013.
- ^ a b c Sjoerdsma A, von Studnitz W (April 1963). "Dopamine-beta-oxidase activity in man, using hydroxyamphetamine as substrate". British Journal of Pharmacology and Chemotherapy. 20: 278–284. doi:10.1111/j.1476-5381.1963.tb01467.x. PMC 1703637. PMID 13977820.
Hydroxyamphetamine was administered orally to five human subjects ... Since conversion of hydroxyamphetamine to hydroxynorephedrine occurs in vitro by the action of dopamine-β-oxidase, a simple method is suggested for measuring the activity of this enzyme and the effect of its inhibitors in man. ... The lack of effect of administration of neomycin to one patient indicates that the hydroxylation occurs in body tissues. ... a major portion of the β-hydroxylation of hydroxyamphetamine occurs in non-adrenal tissue. Unfortunately, at the present time one cannot be completely certain that the hydroxylation of hydroxyamphetamine in vivo is accomplished by the same enzyme which converts dopamine to noradrenaline.
- ^ a b Badenhorst CP, van der Sluis R, Erasmus E, van Dijk AA (September 2013). "Glycine conjugation: importance in metabolism, the role of glycine N-acyltransferase, and factors that influence interindividual variation". Expert Opinion on Drug Metabolism & Toxicology. 9 (9): 1139–1153. doi:10.1517/17425255.2013.796929. PMID 23650932.
Figure 1. Glycine conjugation of benzoic acid. The glycine conjugation pathway consists of two steps. First benzoate is ligated to CoASH to form the high-energy benzoyl-CoA thioester. This reaction is catalyzed by the HXM-A and HXM-B medium-chain acid:CoA ligases and requires energy in the form of ATP. ... The benzoyl-CoA is then conjugated to glycine by GLYAT to form hippuric acid, releasing CoASH. In addition to the factors listed in the boxes, the levels of ATP, CoASH, and glycine may influence the overall rate of the glycine conjugation pathway.
- ^ Horwitz D, Alexander RW, Lovenberg W, Keiser HR (May 1973). "Human serum dopamine-β-hydroxylase. Relationship to hypertension and sympathetic activity". Circulation Research. 32 (5): 594–599. doi:10.1161/01.RES.32.5.594. PMID 4713201.
The biologic significance of the different levels of serum DβH activity was studied in two ways. First, in vivo ability to β-hydroxylate the synthetic substrate hydroxyamphetamine was compared in two subjects with low serum DβH activity and two subjects with average activity. ... In one study, hydroxyamphetamine (Paredrine), a synthetic substrate for DβH, was administered to subjects with either low or average levels of serum DβH activity. The percent of the drug hydroxylated to hydroxynorephedrine was comparable in all subjects (6.5-9.62) (Table 3).
- ^ Freeman JJ, Sulser F (December 1974). "Formation of p-hydroxynorephedrine in brain following intraventricular administration of p-hydroxyamphetamine". Neuropharmacology. 13 (12): 1187–1190. doi:10.1016/0028-3908(74)90069-0. PMID 4457764.
In species where aromatic hydroxylation of amphetamine is the major metabolic pathway, p-hydroxyamphetamine (POH) and p-hydroxynorephedrine (PHN) may contribute to the pharmacological profile of the parent drug. ... The location of the p-hydroxylation and β-hydroxylation reactions is important in species where aromatic hydroxylation of amphetamine is the predominant pathway of metabolism. Following systemic administration of amphetamine to rats, POH has been found in urine and in plasma.
The observed lack of a significant accumulation of PHN in brain following the intraventricular administration of (+)-amphetamine and the formation of appreciable amounts of PHN from (+)-POH in brain tissue in vivo supports the view that the aromatic hydroxylation of amphetamine following its systemic administration occurs predominantly in the periphery, and that POH is then transported through the blood-brain barrier, taken up by noradrenergic neurones in brain where (+)-POH is converted in the storage vesicles by dopamine β-hydroxylase to PHN. - ^ Matsuda LA, Hanson GR, Gibb JW (December 1989). "Neurochemical effects of amphetamine metabolites on central dopaminergic and serotonergic systems". Journal of Pharmacology and Experimental Therapeutics. 251 (3): 901–908. PMID 2600821.
The metabolism of p-OHA to p-OHNor is well documented and dopamine-β hydroxylase present in noradrenergic neurons could easily convert p-OHA to p-OHNor after intraventricular administration.
- ^ a b c d e f ElRakaiby M, Dutilh BE, Rizkallah MR, Boleij A, Cole JN, Aziz RK (July 2014). "Pharmacomicrobiomics: the impact of human microbiome variations on systems pharmacology and personalized therapeutics". Omics. 18 (7): 402–414. doi:10.1089/omi.2014.0018. PMC 4086029. PMID 24785449.
The hundred trillion microbes and viruses residing in every human body, which outnumber human cells and contribute at least 100 times more genes than those encoded on the human genome (Ley et al., 2006), offer an immense accessory pool for inter-individual genetic variation that has been underestimated and largely unexplored (Savage, 1977; Medini et al., 2008; Minot et al., 2011; Wylie et al., 2012). ... Meanwhile, a wealth of literature has long been available about the biotransformation of xenobiotics, notably by gut bacteria (reviewed in Sousa et al., 2008; Rizkallah et al., 2010; Johnson et al., 2012; Haiser and Turnbaugh, 2013). This valuable information is predominantly about drug metabolism by unknown human-associated microbes; however, only a few cases of inter-individual microbiome variations have been documented [e.g., digoxin (Mathan et al., 1989) and acetaminophen (Clayton et al., 2009)].
- ^ a b c Cho I, Blaser MJ (March 2012). "The human microbiome: at the interface of health and disease". Nature Reviews Genetics. 13 (4): 260–270. doi:10.1038/nrg3182. PMC 3418802. PMID 22411464.
The composition of the microbiome varies by anatomical site (Figure 1). The primary determinant of community composition is anatomical location: interpersonal variation is substantial23,24 and is higher than the temporal variability seen at most sites in a single individual25. ... How does the microbiome affect the pharmacology of medications? Can we "micro-type" people to improve pharmacokinetics and/or reduce toxicity? Can we manipulate the microbiome to improve pharmacokinetic stability?
- ^ Hutter T, Gimbert C, Bouchard F, Lapointe FJ (2015). "Being human is a gut feeling". Microbiome. 3: 9. doi:10.1186/s40168-015-0076-7. PMC 4359430. PMID 25774294.
Some metagenomic studies have suggested that less than 10% of the cells that comprise our bodies are Homo sapiens cells. The remaining 90% are bacterial cells. The description of this so-called human microbiome is of great interest and importance for several reasons. For one, it helps us redefine what a biological individual is. We suggest that a human individual is now best described as a super-individual in which a large number of different species (including Homo sapiens) coexist.
- ^ a b c d Kumar K, Dhoke GV, Sharma AK, Jaiswal SK, Sharma VK (January 2019). "Mechanistic elucidation of amphetamine metabolism by tyramine oxidase from human gut microbiota using molecular dynamics simulations". Journal of Cellular Biochemistry. 120 (7): 11206–11215. doi:10.1002/jcb.28396. PMID 30701587. S2CID 73413138.
Particularly in the case of the human gut, which harbors a large diversity of bacterial species, the differences in microbial composition can significantly alter the metabolic activity in the gut lumen.4 The differential metabolic activity due to the differences in gut microbial species has been recently linked with various metabolic disorders and diseases.5–12 In addition to the impact of gut microbial diversity or dysbiosis in various human diseases, there is an increasing amount of evidence which shows that the gut microbes can affect the bioavailability and efficacy of various orally administrated drug molecules through promiscuous enzymatic metabolism.13,14 ... The present study on the atomistic details of amphetamine binding and binding affinity to the tyramine oxidase along with the comparison with two natural substrates of this enzyme namely tyramine and phenylalanine provides strong evidence for the promiscuity-based metabolism of amphetamine by the tyramine oxidase enzyme of E. coli. The obtained results will be crucial in designing a surrogate molecule for amphetamine that can help either in improving the efficacy and bioavailability of the amphetamine drug via competitive inhibition or in redesigning the drug for better pharmacological effects. This study will also have useful clinical implications in reducing the gut microbiota caused variation in the drug response among different populations.
- ^ a b Khan MZ, Nawaz W (October 2016). "The emerging roles of human trace amines and human trace amine-associated receptors (hTAARs) in central nervous system". Biomedicine & Pharmacotherapy. 83: 439–449. doi:10.1016/j.biopha.2016.07.002. PMID 27424325.
- ^ a b c d e Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ "Determination That Delcobese (Amphetamine Adipate, Amphetamine Sulfate, Dextroamphetamine Adipate, Dextroamphetamine Sulfate) Tablets and Capsules Were Not Withdrawn From Sale for Reasons of Safety or Effectiveness". Federal Register. 10 November 2003. Retrieved 3 January 2020.
- ^ "Amphetamine Hydrochloride". Pubchem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 8 November 2013.
- ^ "Amphetamine Phosphate". Pubchem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 8 November 2013.
- ^ Cavallito, John (23 August 1960). "Amphetamine Tannate. Patent Application No. 2,950,309" (PDF). United States Patent Office.
- ^ Brussee J, Jansen AC (May 1983). "A highly stereoselective synthesis of s(−)-[1,1'-binaphthalene]-2,2'-diol". Tetrahedron Letters. 24 (31): 3261–3262. doi:10.1016/S0040-4039(00)88151-4.
- ^ a b Schep LJ, Slaughter RJ, Beasley DM (August 2010). "The clinical toxicology of metamfetamine". Clinical Toxicology. 48 (7): 675–694. doi:10.3109/15563650.2010.516752. ISSN 1556-3650. PMID 20849327. S2CID 42588722.
- ^ Lillsunde P, Korte T (March 1991). "Determination of ring- and N-substituted amphetamines as heptafluorobutyryl derivatives". Forensic Science International. 49 (2): 205–213. doi:10.1016/0379-0738(91)90081-s. PMID 1855720.
- ^ a b c d "Historical overview of methamphetamine". Vermont Department of Health. Government of Vermont. Archived from the original on 5 October 2012. Retrieved 29 January 2012.
- ^ a b c Allen A, Ely R (April 2009). "Review: Synthetic Methods for Amphetamine" (PDF). Crime Scene. Northwest Association of Forensic Scientists. 37 (2): 15–25. Retrieved 6 December 2014.
- ^ a b c Allen A, Cantrell TS (August 1989). "Synthetic reductions in clandestine amphetamine and methamphetamine laboratories: A review". Forensic Science International. 42 (3): 183–199. doi:10.1016/0379-0738(89)90086-8.
- ^ a b c d "Recommended methods of the identification and analysis of amphetamine, methamphetamine, and their ring-substituted analogues in seized materials" (PDF). United Nations Office on Drugs and Crime. United Nations. 2006. pp. 9–12. Retrieved 14 October 2013.
- ^ Pollard CB, Young DC (May 1951). "The Mechanism of the Leuckart Reaction". The Journal of Organic Chemistry. 16 (5): 661–672. doi:10.1021/jo01145a001.
- ^ US patent 2276508, Nabenhauer FP, "Method for the separation of optically active alpha-methylphenethylamine", published 17 March 1942, assigned to Smith Kline French
- ^ a b Gray DL (2007). "Approved Treatments for Attention Deficit Hyperactivity Disorder: Amphetamine (Adderall), Methylphenidate (Ritalin), and Atomoxetine (Straterra)". In Johnson DS, Li JJ (eds.). The Art of Drug Synthesis. New York, USA: Wiley-Interscience. p. 247. ISBN 9780471752158.
- ^ Patrick TM, McBee ET, Hass HB (June 1946). "Synthesis of arylpropylamines; from allyl chloride". Journal of the American Chemical Society. 68 (6): 1009–1011. doi:10.1021/ja01210a032. PMID 20985610.
- ^ Ritter JJ, Kalish J (December 1948). "A new reaction of nitriles; synthesis of t-carbinamines". Journal of the American Chemical Society. 70 (12): 4048–4050. doi:10.1021/ja01192a023. PMID 18105933.
- ^ Krimen LI, Cota DJ (March 2011). "The Ritter Reaction". Organic Reactions. 17. p. 216. doi:10.1002/0471264180.or017.03. ISBN 9780471264187.
- ^ US patent 2413493, Bitler WP, Flisik AC, Leonard N, "Synthesis of isomer-free benzyl methyl acetoacetic methyl ester", published 31 December 1946, assigned to Kay Fries Chemicals Inc.
- ^ Collins M, Salouros H, Cawley AT, Robertson J, Heagney AC, Arenas-Queralt A (June 2010). "δ13C and δ2H isotope ratios in amphetamine synthesized from benzaldehyde and nitroethane". Rapid Communications in Mass Spectrometry. 24 (11): 1653–1658. doi:10.1002/rcm.4563. PMID 20486262.
- ^ Kraemer T, Maurer HH (August 1998). "Determination of amphetamine, methamphetamine and amphetamine-derived designer drugs or medicaments in blood and urine". Journal of Chromatography B. 713 (1): 163–187. doi:10.1016/S0378-4347(97)00515-X. PMID 9700558.
- ^ Kraemer T, Paul LD (August 2007). "Bioanalytical procedures for determination of drugs of abuse in blood". Analytical and Bioanalytical Chemistry. 388 (7): 1415–1435. doi:10.1007/s00216-007-1271-6. PMID 17468860. S2CID 32917584.
- ^ Goldberger BA, Cone EJ (July 1994). "Confirmatory tests for drugs in the workplace by gas chromatography-mass spectrometry". Journal of Chromatography A. 674 (1–2): 73–86. doi:10.1016/0021-9673(94)85218-9. PMID 8075776.
- ^ a b "Clinical Drug Testing in Primary Care" (PDF). University of Colorado Denver. Technical Assistance Publication Series 32. United States Department of Health and Human Services – Substance Abuse and Mental Health Services Administration. 2012. p. 55. Archived (PDF) from the original on 14 May 2018. Retrieved 31 October 2013.
A single dose of amphetamine or methamphetamine can be detected in the urine for approximately 24 hours, depending upon urine pH and individual metabolic differences. People who use chronically and at high doses may continue to have positive urine specimens for 2–4 days after last use (SAMHSA, 2010b).
- ^ a b c d e Paul BD, Jemionek J, Lesser D, Jacobs A, Searles DA (September 2004). "Enantiomeric separation and quantitation of (±)-amphetamine, (±)-methamphetamine, (±)-MDA, (±)-MDMA, and (±)-MDEA in urine specimens by GC-EI-MS after derivatization with (R)-(−)- or (S)-(+)-α-methoxy-α-(trifluoromethyl)phenylacetyl chloride (MTPA)". Journal of Analytical Toxicology. 28 (6): 449–455. doi:10.1093/jat/28.6.449. PMID 15516295.
- ^ "Part 341 – cold, cough, allergy, bronchodilator, and antiasthmatic drug products for over-the-counter human use". Code of Federal Regulations Title 21: Subchapter D – Drugs for human use. United States Food and Drug Administration. 1 April 2019. Archived from the original on 25 December 2019. Retrieved 24 December 2019.
Topical nasal decongestants --(i) For products containing levmetamfetamine identified in 341.20(b)(1) when used in an inhalant dosage form. The product delivers in each 800 milliliters of air 0.04 to 0.150 milligrams of levmetamfetamine.
- ^ "Identification". Levomethamphetamine. Pubchem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 2 January 2014.
- ^ a b Verstraete AG, Heyden FV (August 2005). "Comparison of the sensitivity and specificity of six immunoassays for the detection of amphetamines in urine". Journal of Analytical Toxicology. 29 (5): 359–364. doi:10.1093/jat/29.5.359. PMID 16105261.
- ^ Baselt RC (2011). Disposition of Toxic Drugs and Chemicals in Man (9th ed.). Seal Beach, USA: Biomedical Publications. pp. 85–88. ISBN 9780962652387.
- ^ a b Musshoff F (February 2000). "Illegal or legitimate use? Precursor compounds to amphetamine and methamphetamine". Drug Metabolism Reviews. 32 (1): 15–44. doi:10.1081/DMR-100100562. PMID 10711406. S2CID 20012024.
- ^ a b Cody JT (May 2002). "Precursor medications as a source of methamphetamine and/or amphetamine positive drug testing results". Journal of Occupational and Environmental Medicine. 44 (5): 435–450. doi:10.1097/00043764-200205000-00012. PMID 12024689. S2CID 44614179.
- ^ "Annual prevalence of use of drugs, by region and globally, 2016". World Drug Report 2018. United Nations Office on Drugs and Crime. 2018. Retrieved 7 July 2018.
- ^ Rassool GH (2009). Alcohol and Drug Misuse: A Handbook for Students and Health Professionals. London, England: Routledge. p. 113. ISBN 9780203871171.
- ^ a b Sulzer D, Sonders MS, Poulsen NW, Galli A (April 2005). "Mechanisms of neurotransmitter release by amphetamines: a review". Progress in Neurobiology. 75 (6): 406–433. doi:10.1016/j.pneurobio.2005.04.003. PMID 15955613. S2CID 2359509.
- ^ Rasmussen N (August 2011). "Medical science and the military: the Allies' use of amphetamine during World War II". Journal of Interdisciplinary History. 42 (2): 205–233. doi:10.1162/JINH_a_00212. PMID 22073434. S2CID 34332132.
- ^ Defalque RJ, Wright AJ (April 2011). "Methamphetamine for Hitler's Germany: 1937 to 1945". Bulletin of Anesthesia History. 29 (2): 21–24, 32. doi:10.1016/s1522-8649(11)50016-2. PMID 22849208.
- ^ "Controlled Substances Act". United States Food and Drug Administration. 11 June 2009. Archived from the original on 2 March 2017. Retrieved 4 November 2013.
- ^ "Controlled Substance Schedules". DEA Diversion Control Division. Retrieved 25 December 2019.
- ^ Gyenis A. "Forty Years of On the Road 1957–1997". wordsareimportant.com. DHARMA beat. Archived from the original on 14 February 2008. Retrieved 18 March 2008.
- ^ Wilson A (2008). "Mixing the Medicine: The unintended consequence of amphetamine control on the Northern Soul Scene" (PDF). Internet Journal of Criminology. Archived from the original (PDF) on 13 July 2011. Retrieved 25 May 2013.
- ^ Hill J (4 June 2004). "Paul Erdos, Mathematical Genius, Human (In That Order)" (PDF). Retrieved 2 November 2013.
- ^ a b c Mohan J, ed. (June 2014). "World Drug Report 2014" (PDF). United Nations Office on Drugs and Crime. p. 3. Retrieved 18 August 2014.
- ^ "Statistical Bulletin 2018 − prevalence of drug use". European Monitoring Centre for Drugs and Drug Addiction. Retrieved 5 February 2019.
- ^ a b European drug report 2014: Trends and developments (PDF) (Report). Lisbon, Portugal: European Monitoring Centre for Drugs and Drug Addiction. May 2014. pp. 13, 24. doi:10.2810/32306. ISSN 2314-9086. Retrieved 18 August 2014.
1.2 million or 0.9% of young adults (15–34) used amphetamines in the last year
- ^ United Nations Office on Drugs and Crime (2007). Preventing Amphetamine-type Stimulant Use Among Young People: A Policy and Programming Guide (PDF). New York, USA: United Nations. ISBN 9789211482232. Retrieved 11 November 2013.
- ^ "List of psychotropic substances under international control" (PDF). International Narcotics Control Board. United Nations. August 2003. Archived from the original (PDF) on 5 December 2005. Retrieved 19 November 2005.
- ^ "Importing or Bringing Medication into Japan for Personal Use". Japanese Ministry of Health, Labour and Welfare. 1 April 2004. Retrieved 3 November 2013.
- ^ "Controlled Drugs and Substances Act". Canadian Justice Laws Website. Government of Canada. Archived from the original on 22 November 2013. Retrieved 11 November 2013.
- ^ "Opiumwet". Government of the Netherlands. Retrieved 3 April 2015.
- ^ "Schedule 8". Poisons Standard. Australian Government Department of Health. October 2015. Retrieved 15 December 2015.
- ^ "Table of controlled Narcotic Drugs under the Thai Narcotics Act" (PDF). Thailand Food and Drug Administration. 22 May 2013. Archived from the original (PDF) on 8 March 2014. Retrieved 11 November 2013.
- ^ "Class A, B and C drugs". Home Office, Government of the United Kingdom. Archived from the original on 4 August 2007. Retrieved 23 July 2007.
- ^ a b "Adzenys XR-ODT- amphetamine tablet, orally disintegrating". DailyMed. Neos Therapeutics, Inc. 9 February 2018. Retrieved 22 December 2019.
ADZENYS XR-ODT (amphetamine extended-release orally disintegrating tablet) contains a 3 to 1 ratio of d- to l-amphetamine, a central nervous system stimulant.
- ^ "Mydayis- dextroamphetamine sulfate, dextroamphetamine saccharate, amphetamine aspartate monohydrate, and amphetamine sulfate capsule, extended release". DailyMed. Shire US Inc. 11 October 2019. Retrieved 22 December 2019.
- ^ "Drug Approval Package: Mydayis (mixed salts of a single-entity amphetamine product)". United States Food and Drug Administration. 6 June 2018. Retrieved 22 December 2019.
- ^ "Adzenys ER- amphetamine suspension, extended release". DailyMed. Neos Therapeutics, Inc. 8 December 2017. Retrieved 25 December 2019.
- ^ "Drug Approval Package: Adzenys XR-ODT (amphetamine)". United States Food and Drug Administration. Retrieved 22 December 2019.
- ^ "Evekeo". United States Food and Drug Administration. Retrieved 11 August 2015.
- ^ "Evekeo ODT- amphetamine sulfate tablet, orally disintegrating". DailyMed. Arbor Pharmaceuticals, LLC. 7 June 2019. Retrieved 25 December 2019.
- ^ "Zenzedi- dextroamphetamine sulfate tablet". DailyMed. Arbor Pharmaceuticals, LLC. 14 August 2019. Retrieved 22 December 2019.
- ^ "Drug Approval Package: Vyvanse (Lisdexamfetamine Dimesylate) NDA #021977". United States Food and Drug Administration. 24 December 1999. Retrieved 22 December 2019.
- ^ "Molecular Weight Calculator". Lenntech. Retrieved 19 August 2015.
- ^ a b "Dextroamphetamine Sulfate USP". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ a b "D-amphetamine sulfate". Tocris. 2015. Retrieved 19 August 2015.
- ^ a b "Amphetamine Sulfate USP". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ "Dextroamphetamine Saccharate". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ "Amphetamine Aspartate". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
External links
- "Amphetamine". Drug Information Portal. United States National Library of Medicine.
- CID 5826 from PubChem – Dextroamphetamine
- CID 32893 from PubChem – Levoamphetamine
- Comparative Toxicogenomics Database entry: Amphetamine
- Comparative Toxicogenomics Database entry: CARTPT