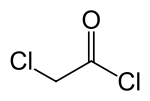
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Хлорацетилхлорид | |
| Другие имена 2-Хлорацетилхлорид Хлоруксусная кислота Хлорид Хлоруксусный хлорид Монохлорацетилхлорид | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.001.065 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1752 |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| С 2 Н 2 Cl 2 O | |
| Молярная масса | 112,94 г · моль -1 |
| Внешность | От бесцветной до желтой жидкости |
| Плотность | 1,42 г / мл |
| Температура плавления | -22 ° С (-8 ° F, 251 К) |
| Точка кипения | 106 ° С (223 ° F, 379 К) |
| Реагирует | |
| Давление газа | 19 мм рт. Ст. (20 ° C) [1] |
| Опасности | |
| Паспорт безопасности | Оксфордский паспорт безопасности материалов |
| Пиктограммы GHS |     |
| Сигнальное слово GHS | Опасность |
| H301 , H311 , H314 , H331 , H372 , H400 | |
| Р260 , Р261 , Р264 , Р270 , Р271 , Р273 , Р280 , Р301 + 310 , P301 + 330 + 331 , P302 + 352 , P303 + 361 + 353 , Р304 + 340 , P305 + 351 + 338 , Р310 , Р311 , P312 , P314 , P321 , P322 , P330 , P361 , P363 , P391 , P403 + 233 , P405 | |
| точка возгорания | негорючие [1] |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (Допустимо) | нет [1] |
REL (рекомендуется) | TWA 0,05 частей на миллион (0,2 мг / м 3 ) [1] |
IDLH (Непосредственная опасность) | ND [1] |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорацетилхлорид представляет собой хлорированный ацилхлорид . Это бифункциональное соединение , что делает его полезным химическим строительным блоком.
Производство [ править ]
Промышленно, он производится путем карбонилирования из метиленхлорида , окисления из винилиденхлорида , или добавления хлора к кетен . [2] Его можно получить из хлоруксусной кислоты и тионилхлорида , пентахлорида фосфора или фосгена .
Реакции [ править ]
Хлорацетилхлорид является бифункциональным - ацилхлорид легко образует сложные эфиры [3] и амиды , в то время как другой конец молекулы способен образовывать другие связи, например, с аминами. Показательно использование хлорацетилхлорида в синтезе лидокаина : [4]
Приложения [ править ]
В основном хлорацетилхлорид используется в качестве промежуточного продукта при производстве гербицидов из семейства хлорацетанилидов, включая метолахлор , ацетохлор , алахлор и бутахлор ; ежегодно используется примерно 100 миллионов фунтов стерлингов. Некоторое количество хлорацетилхлорида также используется для производства фенацилхлорида , другого промежуточного химического соединения, также используемого в качестве слезоточивого газа. [2] хлорацетофенон синтезируется в Фриделя-Крафтса из бензола , с хлорида алюминия катализатора: [5]
С анизолом они используют его для синтеза венлафаксина.
Безопасность [ править ]
Как и другие ацилхлориды, при реакции с другими протонными соединениями, такими как амины, спирты и вода, образуется соляная кислота , что делает ее лакриматором .
Не существует регулируемого допустимого предела воздействия, установленного Управлением по охране труда . Тем не менее, Национальный институт безопасности и гигиены труда установил рекомендуемый предел воздействия на уровне 0,05 частей на миллион в течение восьмичасового рабочего дня. [6]
Ссылки [ править ]
- ^ a b c d e Карманный справочник NIOSH по химической опасности. «# 0120» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Пол Р. Уоршем (1993). «15. Галогенированные производные». В Zoeller, Joseph R .; Агреда, В.Х. (ред.). Уксусная кислота и ее производные ( выдержка из Google Книг ) . Нью-Йорк: М. Деккер. С. 288–298. ISBN 0-8247-8792-7.
- ^ Роберт Х. Бейкер и Фредерик Г. Бордвелл (1955). «трет-Бутилацетат» . Органический синтез .; Коллективный объем , 3
- ^ TJ Reilly (1999). «Приготовление лидокаина» . J. Chem. Educ. 76 (11): 1557. DOI : 10.1021 / ed076p1557 .
- ^ Натан Левин и Уолтер Х. Хартунг (1955). «ω-Хлоризонитрозоацетофенон» . Органический синтез .; Сборник , 3 , с. 191
- ^ "Карманный справочник NIOSH по химическим опасностям" . Центры по контролю и профилактике заболеваний. 2011 г.