 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Диазометан | |
| Другие названия Азиметилен, Азометилен, Диазирин | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.005.803 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
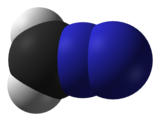
| CH 2 N 2 | |
| Молярная масса | 42,04 г / моль |
| Появление | Желтый газ |
| Запах | затхлый |
| Плотность | 1,4 (воздух = 1) |
| Температура плавления | -145 ° С (-229 ° F, 128 К) |
| Точка кипения | -23 ° С (-9 ° F, 250 К) |
| гидролиз [1] | |
| Состав | |
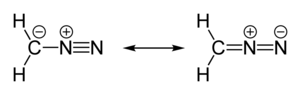
| линейный C = N = N | |
| полярный | |
| Опасности | |
| Основные опасности | токсичный и взрывоопасный |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H350 | |
| P201 , P202 , P281 , P308 + 313 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (LD, LC): | |
ЛК 50 ( средняя концентрация ) | 175 частей на миллион (кошка, 10 мин) [3] |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 0,2 частей на миллион (0,4 мг / м 3 ) [2] |
REL (рекомендуется) | TWA 0,2 частей на миллион (0,4 мг / м 3 ) [2] |
IDLH (Непосредственная опасность) | 2 частей на миллион [2] |
| Родственные соединения | |
Связанные функциональные группы ; соединения | RN = N = N ( азид ), RN = NR (азо); R 2 CN 2 R = Ph, tms, CF 3 |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Диазометан - это химическое соединение CH 2 N 2 , открытое немецким химиком Гансом фон Пехманном в 1894 году. Это простейшее диазосоединение . В чистом виде при комнатной температуре это чрезвычайно чувствительный взрывоопасный газ желтого цвета ; таким образом, он почти повсеместно используется в виде раствора в диэтиловом эфире . Это соединение является популярным метилирующим агентом в лаборатории, но оно слишком опасно для использования в промышленных масштабах без специальных мер предосторожности. [4] Использование диазометана было значительно сокращено за счет введения более безопасного и эквивалентного реагента триметилсилилдиазометана .[5]
Используйте [ редактировать ]
Для безопасности и удобства диазометан всегда при необходимости готовят в виде раствора в эфире и используют как таковой. Он превращает карбоновые кислоты в метиловые эфиры и фенолы в их метиловые эфиры . Считается, что реакция протекает через перенос протона от карбоновой кислоты к диазометану с образованием метилдиазониевого катиона, который реагирует с карбоксилат-ионом с образованием метилового эфира и газообразного азота. Исследования по маркировке показывают, что начальный перенос протона происходит быстрее, чем этап переноса метила. [6] Поскольку для протекания реакции требуется перенос протона, эта реакция является селективной для более кислых карбоновых кислот (p K a ~ 5) и фенолов (p K a~ 10) над алифатическими спиртами (p K a ~ 15). [7]
В более специализированных приложениях диазометан и гомологи используются в синтезе Арндта-Эйстерта и реакции Бюхнера- Куртиуса-Шлоттербека для гомологации. [8] [9]
Диазометан реагирует со спиртами или фенолами в присутствии трифторида бора (BF 3 ) с образованием метиловых эфиров .
Диазометан также часто используется в качестве источника карбена . Легко участвует в 1,3-диполярных циклоприсоединениях .
Подготовка [ править ]
Диазометан получают гидролизом эфирного раствора N- метилнитрозамида водным основанием. Традиционный предшественник представляет собой N -nitroso- N -метилмочевина , но это соединение само по себе довольно нестабильным, и в настоящее время такие соединения, как N - метил - N» -nitro- N -nitrosoguanidine (MNNG) и N - метил - N -nitroso- р -толуолсульфонамид (диазальд) [10] являются предпочтительными. [11]
- Общие способы получения диазометана.
CH 2 N 2 реагирует с основными растворами D 2 O с образованием дейтерированного производного CD 2 N 2 . [12]
Концентрацию CH 2 N 2 можно определить любым из двух удобных способов. Его можно обработать избытком бензойной кислоты в холодном Et 2 O. Затем непрореагировавшую бензойную кислоту подвергают обратному титрованию стандартным NaOH. В качестве альтернативы концентрацию CH 2 N 2 в Et 2 O можно определить спектрофотометрически при 410 нм, где его коэффициент экстинкции ε равен 7,2. [ необходима цитата ] Концентрация диазометана в газовой фазе может быть определена с помощью фотоакустической спектроскопии . [4]
Родственные соединения [ править ]
Диазометан является и изомерным, и изоэлектронным с более стабильным цианамидом , но они не могут преобразовываться друг в друга. Получено много замещенных производных диазометана:
- Очень стабильный (CF 3 ) 2 CN 2 (2-диазо-1,1,1,3,3,3-гексафторпропан; т.кип. 12–13 ° C), [13]
- Ph 2 CN 2 ( диазодифенилметан ; т.пл.29–30 ° C). [14]
- (CH 3 ) 3 SiCHN 2 ( триметилсилилдиазометан ), который коммерчески доступен в виде раствора и столь же эффективен, как CH 2 N 2 для метилирования. [15]
- PhC (H) N 2 , жидкость красного цвета, т.кип. <25 ° C при 0,1 мм рт. Ст. [16]
Безопасность [ править ]
Диазометан токсичен при вдыхании, попадании на кожу или в глаза (TLV 0,2 ppm). Симптомы включают дискомфорт в груди, головную боль, слабость и, в тяжелых случаях, коллапс. [17] Симптомы могут проявиться позже. Сообщалось о случаях смерти от отравления диазометаном. В одном случае лабораторный работник съел гамбургер возле дымового очага, где производил большое количество диазометана, и через четыре дня скончался от молниеносной пневмонии. [18] Предполагается, что, как и любой другой алкилирующий агент, он будет канцерогенным, но такие опасения омрачены его серьезной острой токсичностью.
CH 2 N 2 может взорваться при контакте с острыми краями, такими как стыки матового стекла, даже царапины на стеклянной посуде. [19] Стеклянная посуда должна быть проверена перед использованием, а подготовка должна производиться за защитным экраном. В продаже имеются специализированные комплекты для приготовления диазометана с полированными пламенем стыками.
Компаунд взрывается при нагревании выше 100 ° C, под воздействием интенсивного света, щелочных металлов или сульфата кальция. При использовании этого состава настоятельно рекомендуется использовать защиту от взрыва.
Доказательство правильности концепции работы было сделано с микрофлюидики , в котором непрерывная точка в использовании синтеза из N - метил - N -nitrosourea и 0,93 М гидроксида калия в воде с последующей точкой в использовании преобразования с бензойной кислотой , в результате чего с выходом 65% сложного метилбензоатного эфира за секунды при температуре от 0 до 50 ° C. Выход был лучше, чем в капиллярных условиях; микрофлюидике приписывают «подавление горячих точек, низкую задержку, изотермические условия и интенсивное перемешивание». [20]
Изомеры [ править ]
Стабильное соединение цианамид , второстепенным таутомером которого является карбодиимид , является изомером диазометана. Менее стабильные, но все же выделяемые изомеры диазометана включают циклический 3 H -диазирин и изоцианоамин ( изодиазометан ). [21] [22] Кроме того, исходный нитрилимин наблюдали в условиях матричной изоляции. [23]
Ссылки [ править ]
- ^ ICSC 1256 - ДИАЗОМЕТАН
- ^ a b c Карманный справочник NIOSH по химической опасности. «# 0182» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Диазометан» . Немедленно опасная для жизни или здоровья концентрация (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b Проктор, Ли Д .; Уорр, Энтони Дж. (Ноябрь 2002 г.). «Разработка непрерывного процесса промышленного производства диазометана». Исследования и разработки в области органических процессов . 6 (6): 884–892. DOI : 10.1021 / op020049k .
- ^ Shioiri, Такаюки; Аояма, Тоёхико; Сноуден, Тимоти (2001). «Триметилсилилдиазометан». Энциклопедия реагентов для органического синтеза . Энциклопедия реагентов для органического синтеза e-EROS . DOI : 10.1002 / 047084289X.rt298.pub2 . ISBN 0471936235.
- ^ ван дер Мерве, KJ; Стейн, П.С.; Эггерс, Ш. (январь 1964 г.). «Простая подготовка меченых дейтерием O-метильных групп для масс-спектрометрии» . Буквы тетраэдра . 5 (52): 3923–3925. DOI : 10.1016 / S0040-4039 (01) 89341-2 .
- ^ Клейден, Джонатан. (2012). Органическая химия . Гривс, Ник., Уоррен, Стюарт Г. (2-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-927029-3. OCLC 761379371 .
- ^ Buchner, E .; Курций, Т. (1885). "Synthese von Ketonsäureäthern aus Aldehyden und Diazoessigäther" . Berichte der Deutschen Chemischen Gesellschaft . 18 (2): 2371–2377. DOI : 10.1002 / cber.188501802118 .
- ^ Шлоттербек, Ф. (1907). «Превращение альдегидов и кетонов через диазометан» . Berichte der Deutschen Chemischen Gesellschaft . 40 : 479–483. DOI : 10.1002 / cber.19070400179 .
- ^ "Synthese und Stoffwissen" . Organic-btc-ilmenaus Webseite! (на немецком языке) . Проверено 2 ноября 2020 .
- ^ Рид, Дональд Э .; Джеймс А. Мур (1961). «ДИАЗОМЕТАН». Органический синтез . 41 : 16. DOI : 10,15227 / orgsyn.041.0016 .
- ^ PG Гассман & WJ Greenlee (1988). «Дидейтеродиазометан» . Органический синтез .; Сборник , 6 , с. 432
- ^ WJ Миддлтон; Д.М. Гейл (1988). «Бис (Трифторметил) диазометан» . Органический синтез .; Сборник , 6 , с. 161
- ^ Л. И. Смит; К.Л. Ховард (1955). «Дифенилдиазометано » " . Органические синтезы .; Сборник , 3 , с. 351
- ^ Т. Шиоири; Т. Аояма; С. Мори. «Триметилсилилдиазометан» . Органический синтез .; Сборник , 8 , с. 612
- ^ X. Creary (1990). «Пиролиз солей тозилгидразона: фенидиазометаны» . Органический синтез .; Сборник , 7 , с. 438
- ^ Muir, GD (ed.) 1971, Опасности в химической лаборатории , Королевский институт химии, Лондон.
- ^ LeWinn, EB "Отравление диазометаном: отчет о смертельном случае при вскрытии", Американский журнал медицинских наук , 1949, 218, 556-562.
- ^ де Бур, Th. J .; Бэкер, HJ (1956). «ДИАЗОМЕТАН». Органический синтез . 36 : 16. DOI : 10,15227 / orgsyn.036.0016 .
- ^ Wladimir Reschetilowski (2013-09-13). Микрореакторы в препаративной химии: практические аспекты биотехнологии, нанотехнологии, катализа и др . Вайли. п. 6–15. ISBN 9783527652914.
- ^ Ансельм, Ж.-П. (1977-05-01). "Новый взгляд на изодиазометан. N-аминоизонитрилы". Журнал химического образования . 54 (5): 296. DOI : 10.1021 / ed054p296 . ISSN 0021-9584 .
- ^ Ансельм, JP (1966-11-01). «Химия изодиазометана». Журнал химического образования . 43 (11): 596. DOI : 10.1021 / ed043p596 . ISSN 0021-9584 .
- ^ Комплексные преобразования органических функциональных групп II . Катрицки, Алан Р., Тейлор, Ричард Дж. К. (1-е изд.). Амстердам: Эльзевир. 2005. ISBN 9780080523477. OCLC 213375246 .CS1 maint: другие ( ссылка )
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме диазометана . |
- MSDS диазометан
- CDC - Карманный справочник NIOSH по химическим опасностям
- Технический бюллетень Sigmaaldrich (PDF)
- Применение диазометана Sigma-Aldrich и коммерческая доступность прекурсора (диазальда)
- Реакция Бюхнера – Курциуса – Шлоттербека @ Институт химии, Скопье, Македония
- Идентификация артефактов (побочных продуктов) в реакциях диазометана и триметилсилилдиазометана
