| Иммуноглобулиноподобный рецептор | |
|---|---|
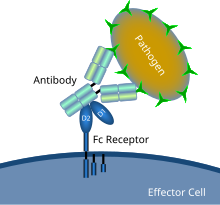 Схематическая диаграмма, показывающая взаимодействие рецептора Fc с микробным патогеном, покрытым антителами | |
| Идентификаторы | |
| Символ | Рецептор Fc |
| Мембранома | 10 |
Fc - рецептора представляет собой белок , обнаруженный на поверхности некоторых клеток - в том числе, среди других, B - лимфоциты , фолликулярные дендритные клетки , естественные клетки - киллеры , макрофаги , нейтрофилы , эозинофилы , базофилы , человеческие тромбоциты , а тучные клетки - которые вносят вклад в защитный функции иммунной системы . Его название происходит от его специфичности связывания с частью антитела, известной как область Fc (фрагмент, кристаллизующийся).. Рецепторы Fc связываются с антителами, которые прикреплены к инфицированным клеткам или вторгающимся патогенам . Их стимулирует активность фагоцитирующих или цитотоксические клетки , чтобы уничтожить микробы , или инфицированные клетки с помощью антител-опосредованной фагоцитоза или антитело-зависимой клеточно-опосредованной цитотоксичности . Некоторые вирусы, такие как флавивирусы, используют рецепторы Fc, чтобы помочь им инфицировать клетки с помощью механизма, известного как антитело-зависимое усиление инфекции . [1]
Классы [ править ]
Существует несколько различных типов рецепторов Fc (сокращенно FcR), которые классифицируются в зависимости от типа распознаваемых ими антител . Латинская буква, используемая для идентификации типа антитела, преобразуется в соответствующую греческую букву, которая помещается после части имени «Fc». Например, те, которые связывают наиболее распространенный класс антител, IgG , называются Fc-гамма-рецепторами (FcγR), те, которые связывают IgA , называются Fc-альфа-рецепторами (FcαR), а те, которые связывают IgE , называются рецепторами Fc-эпсилон ( FcεR). Классы FcR также различаются по экспрессирующим их клеткам (макрофаги, гранулоциты, естественные клетки-киллеры, Т- и В-клетки) и по сигнальным свойствам каждого рецептора. [2]
Fc-гамма рецепторы [ править ]
Все рецепторы Fcγ (FcγR) принадлежат надсемейства иммуноглобулинов и являются наиболее важными рецепторы Fc для индукции фагоцитоза в опсонированных (маркированные) микробов. [3] Это семейство включает несколько членов, FcγRI (CD64), FcγRIIA ( CD32 ), FcγRIIB (CD32), FcγRIIIA (CD16a), FcγRIIIB (CD16b), которые различаются по аффинности к антителам из-за разной молекулярной структуры . [4] Например, FcγRI связывается с IgG сильнее, чем FcγRII или FcγRIII. FcγRI также имеет внеклеточную часть, состоящую из трех иммуноглобулиновых (Ig) -подобных доменов., на один домен больше, чем у FcγRII или FcγRIII. Это свойство позволяет FcγRI связывать единственную молекулу IgG (или мономер ), но все рецепторы Fcγ должны связывать несколько молекул IgG в иммунном комплексе для активации. [5]
Рецепторы Fc-гамма различаются по своему сродству к IgG, и аналогично различные подклассы IgG обладают уникальным сродством к каждому из рецепторов Fc гамма. [6] Эти взаимодействия дополнительно регулируются гликаном (олигосахаридом) в положении CH2-84.4 IgG. [6] Например, создавая стерические препятствия, фукоза, содержащая гликаны CH2-84.4, снижает сродство IgG к FcγRIIIA. [6] Напротив, гликаны G0, которые лишены галактозы и заканчиваются вместо этого фрагментами GlcNAc, обладают повышенным сродством к FcγRIIIA. [6]
Другой FcR экспрессируется на нескольких типах клеток и сходен по структуре с ГКГ класса I . Этот рецептор также связывает IgG и участвует в сохранении этого антитела. [7] Однако, поскольку этот рецептор Fc , также участвует в передаче IgG от матери либо через плаценту к ее плоду или в молоке с ней молочным младенцем , она называется неонатальным Fc - рецептором ( FcRn ). [8] [9] Недавние исследования показали, что этот рецептор играет роль в гомеостазе сывороточных уровней IgG.
Fc-альфа рецепторы [ править ]
Только один рецептор Fc принадлежит к подгруппе FcαR, который называется FcαRI (или CD89). [10] FcαRI обнаружен на поверхности нейтрофилов , эозинофилов, моноцитов, некоторых макрофагов (включая клетки Купфера ) и некоторых дендритных клеток . [10] Он состоит из двух внеклеточных Ig-подобных доменов и является членом суперсемейства иммуноглобулинов и семейства рецепторов многоцепочечного иммунного распознавания (MIRR). [3] Он сигнализирует, связываясь с двумя сигнальными цепями FcRγ. [10] Другой рецептор также может связывать IgA, хотя он имеет более высокое сродство к другому антителу, называемому IgM . [11]Этот рецептор называют Fc-альфа / мю - рецептор (Fcα / мкР) и представляет собой тип I трансмембранный белок . С одним Ig-подобным доменом во внеклеточной части этот рецептор Fc также является членом суперсемейства иммуноглобулинов. [12]
Fc-эпсилон рецепторы [ править ]
Известны два типа FcεR: [3]
- высокоаффинный рецептор FcεRI является членом суперсемейства иммуноглобулинов (он имеет два Ig-подобных домена). FcεRI обнаруживается на эпидермальных клетках Лангерганса , эозинофилах, тучных клетках и базофилах. [13] [14] В результате своего клеточного распределения этот рецептор играет важную роль в контроле аллергических реакций . FcεRI также экспрессируется на антигенпрезентирующих клетках и контролирует выработку важных иммунных медиаторов, называемых цитокинами, которые способствуют воспалению . [15]
- низкоаффинный рецептор FcεRII ( CD23 ) представляет собой лектин С-типа . FcεRII выполняет множество функций в качестве мембраносвязанного или растворимого рецептора; он контролирует рост и дифференцировку В-клеток и блокирует связывание IgE эозинофилов, моноцитов и базофилов. [16]
Сводная таблица [ править ]
| Имя рецептора | Лиганд основного антитела | Сродство к лиганду | Распределение клеток | Эффект после связывания с антителом |
| FcγRI ( CD64 ) | IgG1 и IgG3 | Высокая (Kd ~ 10-9 M) | Макрофаги Нейтрофилы Эозинофилы Дендритные клетки | Фагоцитоз Активация клеток Активация респираторного взрыва Индукция уничтожения микробов |
| FcγRIIA ( CD32 ) | IgG | Низкая (Kd> 10 −7 M) | Макрофаги Нейтрофилы Эозинофилы Тромбоциты Клетки Лангерганса | Фагоцитоз Дегрануляция (эозинофилы) |
| FcγRIIB1 (CD32) | IgG | Низкая (Kd> 10 −7 M) | В-клетки Тучные клетки | Нет фагоцитоза Подавление активности клеток |
| FcγRIIB2 (CD32) | IgG | Низкая (Kd> 10 −7 M) | Макрофаги Нейтрофилы Эозинофилы | Фагоцитоз Подавление активности клеток |
| FcγRIIIA ( CD16a ) | IgG | Низкая (Kd> 10 −6 M) | NK-клетки Макрофаги (некоторые ткани) | Индукция антителозависимой клеточно-опосредованной цитотоксичности (ADCC) Индукция высвобождения цитокинов макрофагами |
| FcγRIIIB ( CD16b ) | IgG | Низкая (Kd> 10 −6 M) | Эозинофилы Макрофаги Нейтрофилы Тучные клетки Фолликулярные дендритные клетки | Индукция уничтожения микробов |
| FcεRI | IgE | Высокая (Kd ~ 10 −10 M) | Тучные клетки Эозинофилы Базофилы Клетки Лангерганса Моноциты | Дегрануляция Фагоцитоз |
| FcεRII ( CD23 ) | IgE | Низкая (Kd> 10 −7 M) | В-клетки Эозинофилы Клетки Лангерганса | Возможный транспорт молекулы адгезии IgE через эпителий кишечника человека Механизм положительной обратной связи для усиления аллергической сенсибилизации (В-клетки) |
| FcαRI ( CD89 ) | IgA | Низкая (Kd> 10 −6 M) | Моноциты Макрофаги Нейтрофилы Эозинофилы | Фагоцитоз Индукция уничтожения микробов |
| Fcα / мкР | IgA и IgM | Высокий для IgM, средний для IgA | В-клетки Мезангиальные клетки Макрофаги | Эндоцитоз Индукция уничтожения микробов |
| FcRn | IgG | Моноциты Макрофаги Дендритные клетки Эпителиальные клетки Эндотелиальные клетки Гепатоциты | Переносит IgG от матери к плоду через плаценту Переносит IgG от матери к ребенку в молоке Защищает IgG от деградации |
Функции [ править ]
Fc - рецепторы обнаружены на ряде клеток в иммунной системе , включающей в фагоцитах , как макрофаги и моноциты , гранулоциты , таких как нейтрофилы и эозинофилы , а также лимфоцитов в врожденной иммунной системы ( естественных клеток - киллеров ) или адаптивной иммунной системы (например, B - клеток ). [17] [18] [19] Они позволяют этим клеткам связываться с антителами, которые прикреплены к поверхности микробов или инфицированных микробами клеток, помогая этим клеткам идентифицировать и устранять микробные патогены.. Рецепторы Fc связывают антитела в своей области Fc (или хвосте), взаимодействие, которое активирует клетку, обладающую рецептором Fc. [20] Активация фагоцитов - наиболее распространенная функция, приписываемая рецепторам Fc. Например, макрофаги начинают поглощать и убивать патоген, покрытый IgG, путем фагоцитоза после задействования их рецепторов Fcγ. [21] Другой процесс с участием Fc-рецепторов называется антителозависимой клеточно-опосредованной цитотоксичностью (ADCC). Во время ADCC рецепторы FcγRIII на поверхности естественных клеток-киллеров (NK) стимулируют NK-клетки высвобождать цитотоксические молекулы из своих гранул.убить клетки-мишени, покрытые антителами. [22] FcεRI выполняет другую функцию. FcεRI представляет собой рецептор Fc на гранулоцитах , который участвует в аллергических реакциях и защите от паразитарных инфекций . Когда присутствует соответствующий аллергический антиген или паразит, перекрестное сшивание по крайней мере двух молекул IgE и их рецепторов Fc на поверхности гранулоцита заставит клетку быстро высвобождать предварительно сформированные медиаторы из своих гранул. [3]
Сигнальные механизмы - гамма-рецепторы Fc [ править ]
Активация [ править ]
Гамма-рецепторы Fc принадлежат к группе некаталитических рецепторов, фосфорилированных тирозином, которые имеют сходный сигнальный путь, включающий фосфорилирование остатков тирозина. [23] Рецепторы генерируют сигналы внутри своих клеток через важный мотив активации, известный как мотив активации иммунорецептора на основе тирозина (ITAM). [24] ITAM представляет собой специфическую последовательность аминокислот (YXXL), дважды встречающуюся в тесной последовательности во внутриклеточном хвосте рецептора. Когда фосфатные группы добавляются к остатку тирозина (Y) ITAM с помощью закрепленных за мембраной ферментов семейства киназ Src, А сигнальный каскад генерируется внутри клетки. Эта реакция фосфорилирования обычно следует за взаимодействием рецептора Fc с его лигандом . ITAM присутствует во внутриклеточном хвосте FcγRIIA, и его фосфорилирование вызывает фагоцитоз в макрофагах. FcγRI и FcγRIIIA не имеют ITAM, но могут передавать активирующий сигнал своим фагоцитам, взаимодействуя с другим белком, который имеет. Этот адаптерный белок называется субъединицей Fcγ и, как и FcγRIIA, содержит две последовательности YXXL, характерные для ITAM.
Запрещение [ править ]
Присутствия только одного мотива YXXL недостаточно для активации клеток, и он представляет собой мотив (I / VXXYXXL), известный как иммунорецепторный ингибирующий мотив на основе тирозина (ITIM). FcγRIIB1 и FcγRIIB2 имеют последовательность ITIM и являются ингибирующими рецепторами Fc; они не вызывают фагоцитоз. Ингибирующее действие этих рецепторов контролируется ферментами, удаляющими фосфатные группы из остатков тирозина; фосфатаз ШП-1 и ШИП-1 сигнализации запрета рецепторами Fcγ. [25]Связывание лиганда с FcγRIIB приводит к фосфорилированию тирозина мотива ITAM. Эта модификация генерирует сайт связывания для фосфатазы, домен узнавания SH2. Отмена передачи сигналов активации ITAM вызывается ингибированием протеинтирозинкиназ семейства Src и гидролизом мембраны PIP3, прерывая дальнейшую передачу сигналов ниже по течению активирующими рецепторами, такими как активация FcγR, TCR, BCR и рецепторов цитокинов (например, c-Kit ). [26]
Отрицательная передача сигналов с помощью FcγRIIB в основном важна для регуляции активированных В-клеток. Положительная передача сигналов В-клеток инициируется связыванием чужеродного антигена с поверхностным иммуноглобулином. Выделяется одно и то же антиген-специфическое антитело, которое может подавлять или стимулировать передачу негативных сигналов. Эта негативная передача сигналов обеспечивается FcγRIIB .: [27] Эксперименты с использованием делеционных мутантов В-клеток и доминантно-негативных ферментов твердо установили важную роль SH2-домен-содержащей инозитол-5-фосфатазы (SHIP) в негативной передаче сигналов. Отрицательная передача сигналов через SHIP, по-видимому, ингибирует путь Rasчерез конкуренцию домена SH2 с Grb2 и Shc и может включать потребление внутриклеточных липидных медиаторов, которые действуют как активаторы аллостерических ферментов или способствуют проникновению внеклеточного Ca2 +. [28]
Сотовая активация [ править ]
О фагоцитах [ править ]
Когда молекулы IgG , специфичные к определенному антигену или поверхностному компоненту, связываются с патогеном своей Fab-областью (фрагмент антигенсвязывающей области), их Fc-области указывают наружу, в непосредственной близости от фагоцитов . Фагоциты связывают эти области Fc своими рецепторами Fc. [21] Между рецептором и антителом образуется множество низкоаффинных взаимодействий, которые вместе прочно связывают микроб, покрытый антителами. Низкая индивидуальная аффинность не позволяет рецепторам Fc связывать антитела в отсутствие антигена и, следовательно, снижает вероятность активации иммунных клеток в отсутствие инфекции. Это также предотвращает агглютинацию (свертывание) фагоцитов.антителом при отсутствии антигена. После связывания патогена взаимодействия между Fc-областью антитела и Fc-рецепторами фагоцита приводят к инициации фагоцитоза . Патоген поглощается фагоцитом в результате активного процесса, включающего связывание и высвобождение комплекса Fc-область / Fc-рецептор до тех пор, пока клеточная мембрана фагоцита полностью не закроет патоген. [29]
О клетках NK [ править ]
Рецептор Fc на NK-клетках распознает IgG, который связан с поверхностью инфицированной патогеном клетки-мишени и называется CD16 или FcγRIII. [30] Активация FcγRIII с помощью IgG вызывает высвобождение цитокинов, таких как IFN-γ, которые сигнализируют другим иммунным клеткам, и цитотоксических медиаторов, таких как перфорин и гранзим, которые проникают в клетку-мишень и способствуют гибели клеток, вызывая апоптоз . Этот процесс известен как антителозависимая клеточно-опосредованная цитотоксичность (ADCC). FcγRIII на NK-клетках также может связываться с мономерным IgG (т.е. с IgG, который не связан с антигеном). Когда это происходит, рецептор Fc подавляет активность NK-клетки. [31]
На тучных клетках [ править ]
IgE антитела связываются с антигенами из аллергенов . Эти связанные с аллергеном молекулы IgE взаимодействуют с рецепторами Fcε на поверхности тучных клеток . Активация тучных клеток после вовлечения FcεRI приводит к процессу, называемому дегрануляцией , в результате чего тучные клетки высвобождают предварительно сформированные молекулы из своих цитоплазматических гранул; это смесь соединений, включая гистамин , протеогликаны и сериновые протеазы . [32] Активированные тучные клетки также синтезируют и секретируют производные липидов медиаторы (такие как простагландины , лейкотриены).и фактор активации тромбоцитов ) и цитокины (такие как интерлейкин 1 , интерлейкин 3 , интерлейкин 4 , интерлейкин 5 , интерлейкин 6 , интерлейкин 13 , фактор некроза опухоли альфа , GM-CSF и несколько хемокинов . [33] [34] Эти медиаторы способствуют воспалению , привлекая другие лейкоциты .
Об эозинофилах [ править ]
Крупные паразиты, такие как гельминт (червь) Schistosoma mansoni , слишком велики для поглощения фагоцитами. У них также есть внешняя структура, называемая покровом, который устойчив к атакам веществ, выделяемых макрофагами и тучными клетками. Однако эти паразиты могут быть покрыты IgE и распознаваться FcεRI на поверхности эозинофилов . Активированные эозинофилы высвобождают предварительно сформированные медиаторы, такие как основной основной белок , и ферменты, такие как пероксидаза , к которым гельминты не устойчивы. [35] [36] Взаимодействие FcεRIрецептор с Fc-частью связанного с гельминтом IgE заставляет эозинофил высвобождать эти молекулы по механизму, аналогичному механизму NK-клетки во время ADCC. [37]
О Т-лимфоцитах [ править ]
CD4 + Т-клетки ( зрелые Т- h- клетки ) помогают В-клеткам, вырабатывающим антитела. При патологии заболевания наблюдается несколько подмножеств активированных эффекторных CD4 + Т-клеток. Более ранние исследования, обобщенные Сандерсом и Линчем в 1993 г., предполагали критическую роль FcR в иммунных ответах, опосредованных CD4 + Т-клетками, и предполагали образование совместного сигнального комплекса между FcR и TCR на поверхности клетки. [38] [39] [40] [41] Чаухан и его коллеги сообщили о совместной локализации меченых IC с комплексом CD3 на активированной поверхности CD4 + Т-клеток, что, таким образом, предполагает сосуществование FcR вместе с комплексом TCR. [42]Оба этих рецептора образуют апикальную структуру на мембране активированных CD4 + Т-клеток, что свидетельствует о боковом движении этих рецепторов. [43] Совместная миграция FcR с TCR и комплексом BCR наблюдается на поверхности клеток, и цитоконъюгаты T: B-клеток демонстрируют это сосуществование в точке контакта. [44] В более раннем обзоре было высказано предположение, что экспрессия FcR на CD4 + Т-клетках является открытым вопросом. [45] Это установило текущую парадигму, согласно которой Т-клетки не экспрессируют FcR, и эти результаты никогда не подвергались сомнению и экспериментально не проверялись. [46] Чаухан и его коллеги показали связывание иммунных комплексов (IC), лиганда FcR, с активированными CD4 + Т-клетками. [46]Экспрессия CD16a индуцируется в активированных наивных CD4 + Т-клетках человека, которые экспрессируют CD25, CD69 и CD98, и лигирование с IC приводит к образованию эффекторных клеток памяти. [47] Передача сигнала CD16a опосредуется фосфорилированием Syk (pSyk). [47] [48] [49]
В настоящее время исследование предполагает индуцированную экспрессию CD32a при активации CD4 + Т-клеток человека, аналогичную CD16a. [48] [50] Экспрессия CD32a на CD4 + Т-клетках также была подтверждена тремя независимыми исследованиями исследователей ВИЧ-1. Экспрессия CD16a и CD32a в подмножестве активированных CD4 + Т-клеток теперь подтверждена. [48] [50] FcR на поверхности клетки при связывании с IC, состоящими из нуклеиновых кислот, запускают продукцию цитокинов и активируют пути восприятия нуклеиновых кислот. FcR присутствуют как на поверхности клетки, так и в цитозоле. Передача сигнала CD16a усиливает экспрессию толл-подобных рецепторов, чувствительных к нуклеиновым кислотам, и перемещает их на поверхность клетки. [47] [51]CD16a - это новый костимулирующий сигнал для CD4 + Т-клеток человека, который успешно заменяет потребность в CD28 во время аутоиммунитета. [52] На аутоиммунном фоне CD4 + Т-клетки обходят требование косигнализации CD28, чтобы стать полностью активированными. [52] Кроме того, блокада косигнализации CD28 не подавляет развитие клеток TFH, ключевой субпопуляции для генерации аутоантител, продуцирующих аутореактивные В-клетки плазмы. [53]Для иммунного гомеостаза необходим баланс между костимулирующими и тормозными сигналами. Чрезмерная костимуляция и / или недостаточное совместное ингибирование приводит к нарушению толерантности и аутоиммунитету. Опосредованная CD16a костимуляция обеспечивает положительный сигнал в активированных CD4 + Т-клетках, а не в покоящихся клетках, в которых отсутствует экспрессия FcγR. [48]
См. Также [ править ]
- Fc-рецептор-подобная молекула
Ссылки [ править ]
- ^ Андерсон R (2003). «Манипуляция флавивирусами макромолекул клеточной поверхности» . Достижения в вирусных исследованиях . 59 : 229–74. DOI : 10.1016 / S0065-3527 (03) 59007-8 . ISBN 9780120398591. PMC 7252169 . PMID 14696331 .
- ^ Оуэн Дж, Punt Дж, Stranford S, Джонс P (2009). Иммунология (7-е изд.). Нью-Йорк: WH Freeman and Company. п. 423. ISBN. 978-14641-3784-6.
- ^ а б в г Фридман WH (сентябрь 1991 г.). «Рецепторы Fc и факторы связывания иммуноглобулина» . Журнал FASEB . 5 (12): 2684–90. DOI : 10.1096 / fasebj.5.12.1916092 . PMID 1916092 .
- ^ Indik ZK, Парк JG, Хантер, Schreiber AD (декабрь 1995). «Молекулярное рассечение фагоцитоза, опосредованного рецептором Fc гамма» . Кровь . 86 (12): 4389–99. DOI : 10.1182 / blood.V86.12.4389.bloodjournal86124389 . PMID 8541526 .
- ^ Харрисон PT, Davis W, Norman JC, Hockaday AR, Аллен JM (сентябрь 1994). «Связывание мономерного иммуноглобулина G запускает Fc-гамма-RI-опосредованный эндоцитоз». Журнал биологической химии . 269 (39): 24396–402. PMID 7929100 .
- ^ a b c d Маверакис Э., Ким К., Шимода М., Гершвин М.Э., Патель Ф., Уилкен Р., Райчаудхури С., Рухак Л. Р., Лебрилла CB (февраль 2015 г.). «Гликаны в иммунной системе и измененная теория гликанов аутоиммунитета: критический обзор» . Журнал аутоиммунитета . 57 (6): 1–13. DOI : 10.1016 / j.jaut.2014.12.002 . PMC 4340844 . PMID 25578468 .
- ↑ Zhu X, Meng G, Dickinson BL, Li X, Mizoguchi E, Miao L, Wang Y, Роберт C, Wu B, Smith PD, Lencer WI, Blumberg RS (март 2001 г.). «Связанный с MHC класс I неонатальный Fc-рецептор IgG функционально экспрессируется в моноцитах, кишечных макрофагах и дендритных клетках» . Журнал иммунологии . 166 (5): 3266–76. DOI : 10.4049 / jimmunol.166.5.3266 . PMC 2827247 . PMID 11207281 .
- ^ Firan М, Bawdon Р, Раду С, Обер RJ, Eaken D, Antohe Ж, Ghetie В, Уорд ES (август 2001 г.). «Рецептор, связанный с MHC класса I, FcRn, играет важную роль в материнско-фетальном переносе гамма-глобулина у людей» . Международная иммунология . 13 (8): 993–1002. DOI : 10.1093 / intimm / 13.8.993 . PMID 11470769 .
- ^ Симистер NE, Якубовиц Израиль E, Ahouse JC, история CM (май 1997). «Новые функции рецептора Fc, относящегося к MHC класса I, FcRn». Сделки Биохимического Общества . 25 (2): 481–6. DOI : 10,1042 / bst0250481 . PMID 9191140 .
- ^ a b c Оттен М.А., ван Эгмонд М. (март 2004 г.). «Рецептор Fc для IgA (FcalphaRI, CD89)». Письма иммунологии . 92 (1–2): 23–31. DOI : 10.1016 / j.imlet.2003.11.018 . PMID 15081523 .
- ↑ Сибуя A, Honda S (декабрь 2006 г.). «Молекулярные и функциональные характеристики Fcalpha / muR, нового рецептора Fc для IgM и IgA». Семинары Springer по иммунопатологии . 28 (4): 377–82. DOI : 10.1007 / s00281-006-0050-3 . PMID 17061088 .
- ↑ Cho Y, Usui K, Honda S, Tahara-Hanaoka S, Shibuya K, Shibuya A (июнь 2006). «Молекулярные характеристики связывания IgA и IgM Fc с Fcalpha / muR» . Сообщения о биохимических и биофизических исследованиях . 345 (1): 474–8. DOI : 10.1016 / j.bbrc.2006.04.084 . hdl : 2241/102010 . PMID 16681999 .
- ^ Очиаи К, Ван В, Rieger А, Kilgus О, Маурер D, Födinger D, Kinet JP, Stingl G, Томиока Н (1994). «Обзор Fc epsilon RI на эпидермальных клетках Лангерганса человека». Международный архив аллергии и иммунологии . 104 Дополнение 1 (1): 63–4. DOI : 10.1159 / 000236756 . PMID 8156009 .
- ^ Prussin C, Меткалф DD (февраль 2006). «5. IgE, тучные клетки, базофилы и эозинофилы». Журнал аллергии и клинической иммунологии . 117 (2 доп. Мини-праймера): S450-6. DOI : 10.1016 / j.jaci.2005.11.016 . PMID 16455345 .
- ^ Фон Bubnoff D, Новак N, S Крафт, Бибер Т (март 2003 г.). «Центральная роль FcepsilonRI при аллергии». Клиническая и экспериментальная дерматология . 28 (2): 184–7. DOI : 10.1046 / j.1365-2230.2003.01209.x . PMID 12653710 .
- ^ Kikutani Н, Ёкота А, Uchibayashi Н, юкавская К, Т Танака, Сугияма К, Barsumian Е.Л., Suemura М, Т Kishimoto (1989). «Структура и функция рецептора Fc-эпсилон II (Fc-эпсилон RII / CD23): точка контакта между эффекторной фазой аллергии и дифференцировкой В-клеток». Симпозиум Фонда Ciba . Симпозиумы Фонда Новартис. 147 : 23–31, обсуждение 31–5. DOI : 10.1002 / 9780470513866.ch3 . ISBN 9780470513866. PMID 2695308 .
- ^ Selvaraj Р, Fifadara Н, Нагараджан S, Симин А, Ван G (2004). «Функциональная регуляция человеческих нейтрофильных Fc-рецепторов гамма». Иммунологические исследования . 29 (1–3): 219–30. DOI : 10.1385 / IR: 29: 1-3: 219 . PMID 15181284 .
- ^ Sulica А, Камеры WH, Manciulea М, Metes D, Кори S, Rabinowich Н, Витезид TL, Herberman РБ (1995). «Дивергентные пути передачи сигнала и эффекты на функции естественных клеток-киллеров, индуцированные взаимодействием рецепторов Fc с физиологическими лигандами или антирецепторными антителами». Естественный иммунитет . 14 (3): 123–33. PMID 8832896 .
- ^ Sarfati М, Фурнье S, Ву CY, Delespesse G (1992). «Экспрессия, регуляция и функция человеческого антигена Fc epsilon RII (CD23)». Иммунологические исследования . 11 (3–4): 260–72. DOI : 10.1007 / BF02919132 . PMID 1287120 .
- ^ Raghavan M, Бьоркман PJ (1996). «Рецепторы Fc и их взаимодействие с иммуноглобулинами» (PDF) . Ежегодный обзор клеточной биологии и биологии развития . 12 : 181–220. DOI : 10.1146 / annurev.cellbio.12.1.181 . PMID 8970726 .
- ^ a b Swanson JA, Hoppe AD (декабрь 2004 г.). «Координация передачи сигналов во время фагоцитоза, опосредованного рецептором Fc». Журнал биологии лейкоцитов . 76 (6): 1093–103. DOI : 10,1189 / jlb.0804439 . ЛВП : 2027,42 / 141562 . PMID 15466916 .
- Перейти ↑ Sun PD (2003). «Структура и функция рецепторов естественных киллеров» . Иммунологические исследования . 27 (2–3): 539–48. DOI : 10.1385 / IR: 27: 2-3: 539 . PMID 12857997 .
- ^ Dushek O, Goyette J, ван дер Мерве PA (ноябрь 2012). «Некаталитические тирозин-фосфорилированные рецепторы». Иммунологические обзоры . 250 (1): 258–276. DOI : 10.1111 / imr.12008 . PMID 23046135 .
- ^ Cambier JC (февраль 1995). «Новая номенклатура для мотива Reth (или ARH1 / TAM / ARAM / YXXL)». Иммунология сегодня . 16 (2): 110. DOI : 10,1016 / 0167-5699 (95) 80105-7 . PMID 7888063 .
- ^ Хуан ZY, Хантер, Ким М.К., Indik ZK, Schreiber AD (июнь 2003). «Влияние фосфатаз SHP-1 и SHIP-1 на передачу сигналов ITIM- и ITAM-содержащими рецепторами Fcgamma FcgammaRIIB и FcgammaRIIA» . Журнал биологии лейкоцитов . 73 (6): 823–9. DOI : 10,1189 / jlb.0902454 . PMID 12773515 .
- ^ Cambier JC (июнь 1997). "Тормозных рецепторов предостаточно?" . Труды Национальной академии наук Соединенных Штатов Америки . 94 (12): 5993–5. Bibcode : 1997PNAS ... 94.5993C . DOI : 10.1073 / pnas.94.12.5993 . PMC 33673 . PMID 9177155 .
- ^ Такай Т, Ono М, Hikida М, Ohmori Н, Ravetch СП (январь 1996). «Усиленные гуморальные и анафилактические ответы у мышей с дефицитом Fc гамма RII». Природа . 379 (6563): 346–9. Bibcode : 1996Natur.379..346T . DOI : 10.1038 / 379346a0 . PMID 8552190 .
- ^ Coggeshall KM (июнь 1998). «Ингибирующая передача сигналов с помощью B-клеточного Fc гамма RIIb». Текущее мнение в иммунологии . 10 (3): 306–12. DOI : 10.1016 / s0952-7915 (98) 80169-6 . PMID 9638367 .
- ^ Joshi T, Butchar JP, Tridandapani S (октябрь 2006). «Передача сигналов рецептора Fcgamma в фагоцитах». Международный журнал гематологии . 84 (3): 210–6. DOI : 10.1532 / IJH97.06140 . PMID 17050193 .
- ^ Trinchieri G, Н Валианте (1993). «Рецепторы для Fc-фрагмента IgG на естественных клетках-киллерах». Естественный иммунитет . 12 (4–5): 218–34. PMID 8257828 .
- ^ Sulica A, C Galatiuc, Manciulea M, Bancu AC, DeLeo A, Витезид TL, Herberman РБ (апрель 1993). «Регулирование естественной цитотоксичности человека с помощью IgG. IV. Связь между связыванием мономерного IgG с рецепторами Fc на больших гранулярных лимфоцитах и ингибированием активности естественных киллеров (NK)». Клеточная иммунология . 147 (2): 397–410. DOI : 10,1006 / cimm.1993.1079 . PMID 8453679 .
- ^ Ямасаки S, Т Саито (2005). «Регулирование активации тучных клеток через FcepsilonRI». Химическая иммунология и аллергия . 87 : 22–31. DOI : 10.1159 / 000087568 . ISBN 3-8055-7948-9. PMID 16107760 .
- ^ Wakahara S, Фуджи Y, Накао Т, Tsuritani К, Хара Т, Саито Н, Ра С (ноябрь 2001 года). «Профили экспрессии генов для Fc-эпсилон RI, цитокинов и хемокинов при активации Fc-эпсилон RI в культивируемых тучных клетках человека, полученных из периферической крови». Цитокин . 16 (4): 143–52. DOI : 10,1006 / cyto.2001.0958 . PMID 11792124 .
- ^ Меткалф DD, Baram D, Mekori YA (октябрь 1997). "Тучные клетки". Физиологические обзоры . 77 (4): 1033–79. DOI : 10.1152 / Physrev.1997.77.4.1033 . PMID 9354811 .
- ↑ Дэвид JR, Баттерворт AE, Вадас Массачусетс (сентябрь 1980 г.). «Механизм взаимодействия, опосредующего убийство Schistosoma mansoni человеческими эозинофилами». Американский журнал тропической медицины и гигиены . 29 (5): 842–8. DOI : 10,4269 / ajtmh.1980.29.842 . PMID 7435788 .
- ^ Капрон М, Soussi Gounni А, Морита М, Труонга МДж, Прин л, Kinet JP, капроновая А (1995). «Эозинофилы: от низкоаффинных до высокоаффинных рецепторов иммуноглобулина Е» . Аллергия . 50 (25 Suppl): 20–3. DOI : 10.1111 / j.1398-9995.1995.tb04270.x . PMID 7677229 .
- ^ Gounni А.С., Lamkhioued В, Очиаи К, Танака У, Делапорт Е, капроновые А, Kinet ДП, капроновые М (январь 1994). «Рецептор IgE с высоким сродством к эозинофилам участвует в защите от паразитов». Природа . 367 (6459): 183–6. Bibcode : 1994Natur.367..183S . DOI : 10.1038 / 367183a0 . PMID 8114916 .
- ^ Пихлер WJ, Lum L, Broder S (1978). «Fc-рецепторы на Т-лимфоцитах человека. I. Переход Tgamma в Tmu-клетки». J Immunol . 121 (4): 1540–1548. PMID 308968 .
- Перейти ↑ Sandor M, Lynch RG (май 1993 г.). «Лимфоцитарные рецепторы Fc: частный случай Т-клеток». Иммунол. Сегодня . 14 (5): 227–31. DOI : 10.1016 / 0167-5699 (93) 90168-K . PMID 8517922 .
- Перейти ↑ Engelhardt W, Matzke J, Schmidt RE (1995). «Зависимая от активации экспрессия низкоаффинных рецепторов IgG Fc гамма RII (CD32) и Fc гамма RIII (CD16) в субпопуляциях Т-лимфоцитов человека». Иммунобиология . 192 (5): 297–320. DOI : 10.1016 / s0171-2985 (11) 80172-5 . PMID 7649565 .
- ^ Moretta L, Уэбб SR, Grossi CE, Lydyard PM, Купер MD (1977). «Функциональный анализ двух субпопуляций человеческих Т-клеток: помощь и подавление В-клеточных ответов Т-клетками, несущими рецепторы IgM или IgG» . J Exp Med . 146 (1): 184–200. DOI : 10,1084 / jem.146.1.184 . PMC 2180738 . PMID 301544 .
- ^ Чаухан А.К., Мур TL (2011). «Активация Т-клеток терминальным комплексом комплемента и иммунных комплексов» . Журнал биологической химии . 286 (44): 38627–38637. DOI : 10.1074 / jbc.M111.266809 . PMC 3207419 . PMID 21900254 .
- ^ Чаухан А.К., Мур TL (2011). «Активация Т-клеток терминальным комплексом комплемента и иммунных комплексов» . Журнал биологической химии . 286 (44): 38627–38637. DOI : 10.1074 / jbc.M111.266809 . PMC 3207419 . PMID 21900254 .
- Перейти ↑ Sandor M, Lynch RG (1993). «Лимфоцитарные рецепторы Fc: частный случай Т-клеток». Иммунология сегодня . 14 (5): 227–231. DOI : 10.1016 / 0167-5699 (93) 90168-K . PMID 8517922 .
- ^ Nimmerjahn F, Ravetch СП (январь 2008). «Рецепторы Fcgamma как регуляторы иммунных ответов». Nat. Rev. Immunol . 8 (1): 34–47. DOI : 10.1038 / nri2206 . PMID 18064051 .
- ↑ a b Bruhns P, Jönsson F (ноябрь 2015 г.). «Эффекторные функции FcR мыши и человека». Иммунол. Ред . 268 (1): 25–51. DOI : 10.1111 / imr.12350 . PMID 26497511 .
- ^ a b c Чаухан А.К., Мур Т.Л., Би Y, Чен С. (январь 2016 г.). «Ко-сигнал FcγRIIIa-Syk модулирует CD4 + Т-клеточный ответ и повышает экспрессию Toll-подобного рецептора (TLR)» . J. Biol. Chem . 291 (3): 1368–86. DOI : 10.1074 / jbc.M115.684795 . PMC 4714221 . PMID 26582197 .
- ^ а б в г Чаухан А.К., Чен С., Мур Т.Л., ДиПаоло Р.Дж. (февраль 2015 г.). «Индуцированная экспрессия FcγRIIIa (CD16a) на CD4 + Т-клетках запускает генерацию IFN-γhigh подмножества» . J. Biol. Chem . 290 (8): 5127–40. DOI : 10.1074 / jbc.M114.599266 . PMC 4335247 . PMID 25556651 .
- ^ Чаухан А.К., Мур TL (2012). «Иммунные комплексы и поздние белки комплемента запускают активацию тирозинкиназы Syk в CD4 (+) Т-клетках человека» . Clin Exp Immunol . 167 (2): 235–245. DOI : 10.1111 / j.1365-2249.2011.04505.x . PMC 3278689 . PMID 22235999 .
- ^ Б Holgado МП, Sananez I, S, Raiden Geffner JR, Arruvito L (2018). «Лигирование CD32 способствует активации CD4 + Т-клеток» . Фронт Иммунол . 9 : 2814. DOI : 10.3389 / fimmu.2018.02814 . PMC 6284025 . PMID 30555482 .
- ^ Чаухан AK (2017). «Передача сигналов FcgammaRIIIa модулирует эндосомные ответы TLR в CD4 + Т-клетках человека» . J Immunol . 198 (12): 4596–4606. DOI : 10.4049 / jimmunol.1601954 . PMC 5505339 . PMID 28500073 .
- ^ a b Bour-Jordan H, Esensten JH, Martinez-Llordella M, Penaranda C, Stumpf M, Bluestone JA (2011). «Внутренний и внешний контроль толерантности периферических Т-клеток костимулирующими молекулами семейства CD28 / B7» . Immunol Rev . 241 (1): 180–205. DOI : 10.1111 / j.1600-065X.2011.01011.x . PMC 3077803 . PMID 21488898 .
- ↑ Weber JP, Fuhrmann F, Feist RK, Lahmann A, Al Baz MS, Gentz LJ, Vu Van D, Mages HW, Haftmann C, Riedel R, Grun JR, Schuh W, Kroczek RA, Radbruch A, Mashreghi MF, Hutloff A (2015). «ICOS поддерживает фенотип Т-фолликулярных клеток-помощников, подавляя Kruppel-подобный фактор 2» . Журнал экспериментальной медицины . 212 (2): 217–233. DOI : 10.1084 / jem.20141432 . PMC 4322049 . PMID 25646266 .
Дальнейшее чтение [ править ]
- Laneway CA, Трэверс П., Уолдпорт М., Шломчик М.Дж. (2001). «Глава 9. Гуморальный иммунный ответ» . Иммунобиология: иммунная система в здоровье и болезнях (5-е изд.). Нью-Йорк: Гарленд. ISBN 978-0-8153-3642-6.
- Аббас А.К., Лихтман А.Х., Пиллай С. (2012). «Глава 12: Эффекторные механизмы гуморального иммунитета». Клеточная и молекулярная иммунология (7-е изд.). Филадельфия: Эльзевьер / Сондерс. ISBN 978-1-4377-1528-6.
- Гербер Дж. С., Моссер Д. М. (февраль 2001 г.). «Стимулирующие и тормозящие сигналы, исходящие от рецепторов макрофагов Fcgamma». Микробы и инфекции . 3 (2): 131–9. DOI : 10.1016 / s1286-4579 (00) 01360-5 . PMID 11251299 .
- Маверакис Э., Ким К., Шимода М., Гершвин М.Э., Патель Ф., Уилкен Р., Райчаудхури С., Рухак Л. Р., Лебрилла CB (февраль 2015 г.). «Гликаны в иммунной системе и измененная теория гликанов аутоиммунитета: критический обзор» . Журнал аутоиммунитета . 57 : 1–13. DOI : 10.1016 / j.jaut.2014.12.002 . PMC 4340844 . PMID 25578468 .
Внешние ссылки [ править ]
- Fc + Receptor в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)