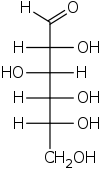
Проекции Фишера , разработанный Эмиля Фишера в 1891 году, [1] является двумерным представлением трехмерного органической молекулы по проекции . Проекции Фишера были первоначально предложены для изображения углеводов и использовались химиками , особенно в органической химии и биохимии . Не рекомендуется использовать проекции Фишера для неуглеводных диаграмм, так как такие рисунки неоднозначны, если их путают с другими типами рисунков. [2]
Соглашения [ править ]
Все нетерминальные связи изображены горизонтальными или вертикальными линиями. Углеродная цепь изображена вертикально, с углеродными атомами , иногда не показанные и представленными в центре пересечения линий (смотрите рисунок ниже). Ориентация углеродной цепи такова, что первый углерод (С1) находится наверху. [3] В альдозе C1 представляет собой атом углерода альдегидной группы; в кетозе C1 - это атом углерода, ближайший к кетоновой группе, которая обычно находится у C2. [4]
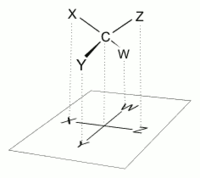
В проекции Фишера все горизонтальные связи должны быть наклонены к зрителю. Молекулы с простой тетраэдрической геометрией легко вращаются в пространстве, так что это условие выполняется (см. Рисунки). Например, моносахарид с тремя атомами углерода ( триоза ), такой как D- глицеральдегид, изображенный выше, имеет тетраэдрическую геометрию с C2 в его центре и может вращаться в пространстве так, чтобы углеродная цепь была вертикальной с C1 наверху. , и горизонтальные связи, соединяющие C2 с -H и -OH, обе наклонены к зрителю.
Однако при создании проекции Фишера для моносахарида с более чем тремя атомами углерода невозможно ориентировать молекулу в пространстве так, чтобы все горизонтальные связи были наклонены к наблюдателю. После поворота молекулы так, чтобы обе горизонтальные связи с C2 были наклонены к наблюдателю, горизонтальные связи с C3 обычно будут наклонены в сторону. Итак, после построения связей с C2, перед тем, как нарисовать связи с C3, молекула должна быть повернута в пространстве на 180 ° вокруг своей вертикальной оси. Для завершения чертежа могут потребоваться другие подобные повороты.
Это означает, что в большинстве случаев проекция Фишера не является точным представлением реальной трехмерной конфигурации молекулы. Его можно рассматривать как проекцию модифицированной версии молекулы, идеально скрученной на нескольких уровнях вдоль ее основной цепи. Например, молекула D- глюкозы с открытой цепью , повернутая так, что горизонтальные связи с C2 наклонены к наблюдателю, будет иметь связи с C3 и C5 наклонно от наблюдателя, и, следовательно, ее точная проекция не будет совпадать с Проекция Фишера. Для более точного представления молекулы с открытой цепью можно использовать проекцию Натта .
Согласно правилам IUPAC, все атомы водорода предпочтительно должны быть нарисованы явно; в частности, должны присутствовать атомы водорода концевой группы углеводов.[2] В этом отношении проекция Фишера отличается от скелетных формул .
Использование [ править ]
Проекции Фишера чаще всего используются в биохимии и органической химии для представления моносахаридов . Их также можно использовать для аминокислот или других органических молекул, хотя это не одобряется рекомендациями IUPAC 2006 года. [2]
Проекции Фишера может быть использовано для различения L- и D - молекул . Например, по определению в проекции Фишера предпоследний ( предпоследний ) углерод D-сахаров изображен с водородом слева и гидроксилом справа. L-сахара будут показаны с водородом справа и гидроксилом слева. [5]
Другие системы [ править ]
Проекции Хаворта - это связанное химическое обозначение, используемое для представления сахаров в кольцевой форме. Группы в правой части проекции Фишера эквивалентны группам, расположенным ниже плоскости кольца в проекциях Хаворта. [6] Проекции Фишера не следует путать со структурами Льюиса , которые не содержат никакой информации о трехмерной геометрии . Обозначения в виде клина и тире используются для представления стереохимии большинства классов органических соединений, а проекции Ньюмана используются для изображения конкретных конформаций вращающихся связей органических молекул (включая, но не ограничиваясь, углеводы).
См. Также [ править ]
| Викискладе есть медиафайлы по теме проекции Фишера . |
- Структурная формула
- Формула скелета
- Проекция Хаворта
- Проекция Ньюмана
- Натта проекция
Ссылки [ править ]
- ^ Джон Макмерри (2008). Органическая химия (7-е изд.). Брукс / Коул - Thomson Learning, Inc. стр. 975. ISBN 978-0-13-286261-5.
- ^ a b c Графическое представление стереохимической конфигурации (Рекомендации IUPAC 2006 г.), стр. 1933-1934
- ^ Понимание проекции Фишера и преобразования представления угловой линии Луис Ф. Морено Журнал химического образования 2012 89 (1), 175-176 doi : 10.1021 / ed101011c
- ^ «Правила номенклатуры углеводов». Журнал органической химии . 28 (2): 281–291. Февраль 1963 г. doi : 10.1021 / jo01037a001 .
- ^ «Сахара и полисахариды» . Политехнический институт Ренсселера (RPI). Архивировано из оригинала на 2011-07-12 . Проверено 10 июля 2011 .
- ^ Мэтьюз, CE; К.Э. Ван Холде; К.Г. Ахерн (1999) Биохимия . 3-е издание. Бенджамин Каммингс. ISBN 0-8053-3066-6