| Имена | |||
|---|---|---|---|
| Другие названия Цитопорфирин железа IX, формилпорфирин | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ChemSpider | |||
| MeSH | Heme + a | ||
PubChem CID | |||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| C 49 H 56 O 6 N 4 Fe | |||
| Молярная масса | 852,837 | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
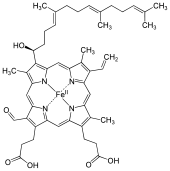
Гем А (или гем А ) представляет собой гем , координационный комплекс, состоящий из макроциклического лиганда, называемого порфирином , хелатирующего атом железа. Гем А - это биомолекула, которую в естественных условиях вырабатывают многие организмы. Гем A, который в растворе часто кажется дихроичным зеленым / красным, является структурным родственником гема B , компонента гемоглобина , красного пигмента в крови.
Отношение к другим гемам [ править ]
Гем А отличается от гема В тем, что метильная боковая цепь в положении 8 кольца окисляется до формильной группы, а гидроксиэтилфарнезильная группа , изопреноидная цепь, присоединена к винильной боковой цепи в положении 2 кольца гема тетрапиррола железа . Гем A подобен гему o , в том, что оба имеют это фарнезильное присоединение в положении 2, но гем O не имеет формильной группы в положении 8, все еще содержащей метильную группу. Правильная структура гема A, основанная на экспериментах ЯМР и ИК восстановленной формы гема Fe (II), была опубликована в 1975 году [1].Структура подтверждена синтезом диметилового эфира в форме, не содержащей железа. [2]
История [ править ]
Гем А был впервые выделен немецким биохимиком Отто Варбургом в 1951 году и показал, что он является активным компонентом интегральной мембранной металлопротеиновой цитохром с оксидазы. [3]
Стереохимия [ править ]
Последний структурный вопрос о точной геометрической конфигурации первого атома углерода в положении 3 кольца I, углерод, связанный с гидроксильной группой, был недавно опубликован как хиральная S-конфигурация. [4]
Подобно гему B, гем A часто присоединяется к апопротеину через координационную связь между гемовым железом и консервативной боковой цепью аминокислоты. В важной респираторной белковой цитохром с оксидазе (CCO) этот лиганд 5 для гема A в кислородном реакционном центре представляет собой гистидильную группу. [5] Это общий лиганд для многих гемопротеинов, включая гемоглобин и миоглобин .
Гем А в цитохроме - это часть циктохрома с-оксидазы, связанная двумя остатками гистидина (показаны розовым цветом ) [6]
Примером металлопротеина, содержащего гем А, является цитохром с оксидаза. Этот очень сложный белок содержит гем А на двух разных участках, каждый из которых выполняет свою функцию. Железо гема А цитохрома а гексакоординировано, то есть связано с 6 другими атомами. Железо гема А цитохрома а3 иногда связывается с 5 другими атомами, оставляя шестой участок доступным для связывания дикислорода (молекулярного кислорода ). [6] Кроме того, этот фермент связывает 3 меди, магний, цинк и несколько ионов калия и натрия. Считается, что две группы гема A в CCO легко обмениваются электронами между собой, ионами меди и тесно связанным белком цитохромом c.
Считается, что как формильная группа, так и изопреноидная боковая цепь играют важную роль в сохранении энергии восстановления кислорода цитохром с оксидазой . Считается, что CCO отвечает за сохранение энергии восстановления двуокиси кислорода путем перекачки протонов в межмембранное пространство митохондрий. Считается, что как формильная, так и гидроксиэтилфарнезильная группы гема А играют важную роль в этом критическом процессе, как опубликовано влиятельной группой С. Йошикавы. [7]
См. Также [ править ]
- Гем
- Гемопротеин
- Цитохром с оксидаза (комплекс IV клеточного дыхания )
Ссылки [ править ]
- ^ Caughey, WS; Смайт, Джорджия; О'Киф, DH; Маскаски, JE; Смит, ML (1975). «Гем А цитохром с оксидазы» . Журнал биологической химии . 250 (19): 7602–7622. DOI : 10.1016 / S0021-9258 (19) 40860-0 . PMID 170266 .
- ^ Battersby, Алан R .; Макдональд, Эдвард; Томпсон, Мервин; Chaudhry, Irshad A .; Клези, Питер С .; Фукс, Кристофер-младший; Хай, Тон То (1985). «Выделение, кристаллизация и синтез диметилового эфира порфирина а, не содержащей железа простетической группы цитохром с оксидазы». Журнал химического общества, Перкин Сделка 1 : 135. DOI : 10.1039 / P19850000135 .
- ^ Варбург, О; Гевиц Х. С. (1951). "Cytohämin aus Herzmuskel". Zeitschrift für Physiologische Chemie . 288 (1): 1–4. DOI : 10.1515 / bchm2.1951.288.1.1 . PMID 14860765 .
- ↑ Yamashita E, Aoyama H, Yao M, Muramoto K, Shinzawa-Itoh K, Yoshikawa S, Tsukihara T .; Сюжета; Яо; Мурамото; Синдзава-Ито; Йошикава; Цукихара (2005). «Абсолютная конфигурация гидроксифарнезилэтильной группы гема А, определенная с помощью рентгеноструктурного анализа цитохром с оксидазы сердца крупного рогатого скота с использованием методов, применимых при разрешении 2,8 ангстрем» . Acta Crystallographica D . 61 (10): 1373–1377. DOI : 10.1107 / S0907444905023358 . PMID 16204889 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Tsukihara Т, Shimokata К, Катаяма У, Shimada Н, Muramoto К, Аояма Н, Мочизуки М, Shinzawa-Ито К, Ямашита Е, Яо М, Ишимура Y, Ёшикава S .; Симоката; Катаяма; Шимада; Мурамото; Сюжета; Мотидзуки; Синдзава-Ито; Ямасита; Яо; Ишимура; Йошикава (2003). «Низкоспиновый гем цитохром с оксидазы как движущий элемент процесса протонной накачки» . PNAS . 100 (26): 15304–15309. Bibcode : 2003PNAS..10015304T . DOI : 10.1073 / pnas.2635097100 . PMC 307562 . PMID 14673090 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ a b Yoshikawa, S .; Shinzawa-Itoh, K .; Накашима, р .; Yaono, R .; Yamashita, E .; Inoue, N .; Yao, M .; Фей, MJ; и другие. (1998). «Редокс-связанные кристаллические структурные изменения в цитохром с оксидазе сердца крупного рогатого скота» . Наука . 280 (5370): 1723–1729. DOI : 10.1126 / science.280.5370.1723 . PMID 9624044 . S2CID 37147458 .
- ^ Симоката К., Катаяма Y, Мураяма Х, Суэмацу М, Цукихара Т, Мурамото К., Аояма Х, Йошикава С., Симада Х .; Катаяма; Мураяма; Суэмацу; Цукихара; Мурамото; Сюжета; Йошикава; Шимада (2007). "Путь протонной перекачки цитохром с оксидазы сердца крупного рогатого скота" . PNAS . 104 (10): 4200–4205. Bibcode : 2007PNAS..104.4200S . DOI : 10.1073 / pnas.0611627104 . PMC 1820732 . PMID 17360500 . CS1 maint: несколько имен: список авторов ( ссылка )