 | |||
| Имена | |||
|---|---|---|---|
| Другие имена Фторид йода (VII) Гептафториодин | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.037.241 | ||
PubChem CID | |||
| UNII | |||
Панель управления CompTox ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| ЕСЛИ 7 | |||
| Молярная масса | 259,90 г / моль | ||
| Внешность | бесцветный газ | ||
| Плотность | 2,6 г / см 3 (6 ° C) 2,7 г / см 3 (25 ° C) | ||
| Температура плавления | 4,5 ° C (40,1 ° F, 277,6 K) (тройная точка) | ||
| Точка кипения | 4,8 ° C (40,6 ° F, 277,9 К) (возгоняется при 1 атм) | ||
| растворимый [1] | |||
| Родственные соединения | |||
Родственные соединения | пентафторид йода | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
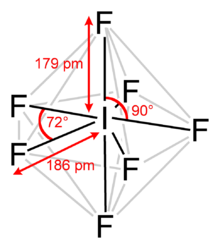
Гептафторид йода , также известный как фторид йода (VII) или фторид йода, представляет собой межгалогенное соединение с химической формулой I F 7 . [2] [3] Он имеет необычную пентагональную бипирамидальную структуру, как и предсказывает теория VSEPR . [4] Молекула может подвергаться псевдовращательной перестройке, называемой механизмом Бартелла , который подобен механизму Берри, но для гептакоординированной системы. [5]Он образует бесцветные кристаллы, которые плавятся при 4,5 ° C: диапазон жидкостей чрезвычайно узкий, с температурой кипения 4,77 ° C. Плотный пар имеет резкий запах плесени. Молекула имеет симметрию D 5h .
Подготовка [ править ]
IF 7 получают путем пропускания F 2 через жидкий IF 5 при 90 ° C с последующим нагреванием паров до 270 ° C. В качестве альтернативы это соединение может быть получено из фтора и высушенного иодида палладия или калия, чтобы минимизировать образование IOF 5 , примеси, возникающей при гидролизе. [6] [7] Гептафторид йода также производится в качестве побочного продукта, когда диоксигенилгексафтороплатинат используется для получения других соединений платины (V), таких как гексафтороплатинат калия (V) , с использованием фторида калия в растворе пентафторида йода: [8]
- 2 O 2 PtF 6 + 2 KF + IF 5 → 2 KPtF 6 + 2 O 2 + IF 7
Соображения безопасности [ править ]
IF 7 сильно раздражает как кожу, так и слизистые оболочки . Он также является сильным окислителем и может вызвать возгорание при контакте с органическими материалами.
Ссылки [ править ]
- ^ Прадёт Патнаик. Справочник неорганических химикатов . Макгроу-Хилл, 2002, ISBN 0-07-049439-8
- ^ Макинтайр, JE (ред.). (1992). Словарь неорганических соединений (Том 3). Лондон: Чепмен и Холл.
- ^ O'Neil, Maryadele Дж (ред.). (2001). Индекс Merck (13-е изд.). Станция Уайтхаус, Нью-Джерси: Merck.
- ^ КО Кристе; EC Curtis; Д.А. Диксон (1993). «К проблеме гептакоординации: колебательные спектры, структура и текучесть гептафторида йода». Журнал Американского химического общества . 115 (4): 1520–1526. DOI : 10.1021 / ja00057a044 .
- ^ WJ Adams; Х. Брэдфорд Томпсон; Л.С. Бартелл (1970). «Структура, псевдовращение и связь колебательных мод в IF 7 : исследование дифракции электронов» (PDF) . Журнал химической физики . 53 (10): 4040–4046. DOI : 10.1063 / 1.1673876 .
- ^ Шумб, WC; Линч, Массачусетс (1950). «Гептафторид йода». Промышленная и инженерная химия . 42 (7): 1383–1386. DOI : 10.1021 / ie50487a035 .
- ^ Ruff, O .; Кейм, Р. (1930). " " Das Йод-7-fluorid "(йод-7-фтор)". Zeitschrift für Anorganische und Allgemeine Chemie (на немецком языке). 193 (1/2): 176–186. DOI : 10.1002 / zaac.19301930117 .
- ^ Беверидж, AD; Кларк, ХК (1967). «Пентагалогениды переходных металлов». Виктор Гутманн (ред.). Галогенная химия . 3 . Академическая пресса . С. 179–226. ISBN 9780323148474.
Внешние ссылки [ править ]
- Страница веб-книги для IF7
- Национальный реестр загрязнителей - информационный бюллетень по фторидам и соединениям
- список веб-элементов