 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Пирен | |
| Другие имена Бензо [ деф ] фенантрен | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| 1307225 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.004.481 |
| 84203 | |
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
CompTox Dashboard ( EPA ) | |
| |
| |
| Характеристики | |
| С 16 Н 10 | |
| Молярная масса | 202,256 г · моль -1 |
| Внешность | бесцветное твердое вещество (желтые примеси часто обнаруживаются в следовых количествах во многих пробах). |
| Плотность | 1,271 г / мл |
| Температура плавления | От 145 до 148 ° C (от 293 до 298 ° F, от 418 до 421 K) |
| Точка кипения | 404 ° С (759 ° F, 677 К) |
| 0,135 мг / л | |
| -147,9 · 10 −6 см 3 / моль | |
| Опасности | |
| Основные опасности | раздражитель |
| R-фразы (устаревшие) | 36/37 / 38-45-53 |
| S-фразы (устарели) | 24 / 25-26-36 |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | негорючий |
| Родственные соединения | |
Связанные ПАУ | бензопирен |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
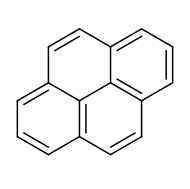
Пирен - это полициклический ароматический углеводород (ПАУ), состоящий из четырех конденсированных бензольных колец, образующих плоскую ароматическую систему. Химическая формула - C
16ЧАС
10. Это твердое вещество желтого цвета является наименьшим слитым ПАУ (в котором кольца сливаются более чем с одной стороны). Пирен образуется при неполном сгорании органических соединений.
Возникновение и свойства [ править ]
Впервые пирен был выделен из каменноугольной смолы , где его содержание составляет до 2% по весу. Как периконденсированный ПАУ, пирен гораздо более стабилизирован резонансом, чем его пятичленное кольцо, содержащее изомер флуорантен . Поэтому его производят в широком диапазоне условий горения. Например, автомобили производят около 1 мкг / км. [1]
Реакции [ править ]
Окисление хроматом дает перинафтенон, а затем нафталин-1,4,5,8-тетракарбоновую кислоту. Он подвергается ряду реакций гидрирования и подвержен галогенированию, добавкам Дильса-Альдера и нитрованию, причем все с различной степенью селективности. [1] Бромирование происходит в одном из трех положений. [2]
Фотофизика [ править ]
Пирен и его производные используются в коммерческих целях для изготовления красителей и предшественников красителей, например пиранина и нафталин-1,4,5,8-тетракарбоновой кислоты. Он имеет сильное поглощение в УФ-видимой области в трех резких полосах при 330 нм в DCM. Излучение близко к поглощению, но движется на 375 нм. [3] Морфология сигналов меняется в зависимости от растворителя. Его производные также представляют собой ценные молекулярные зонды с помощью флуоресцентной спектроскопии, имеющие высокий квантовый выход и время жизни (0,65 и 410 наносекунд соответственно в этаноле при 293 К). Пирен был первой молекулой, для которой было обнаружено эксимерное поведение. [4] Такой эксимер появляется около 450 нм. Теодор Ферстер сообщил об этом в 1954 году. [5]
Приложения [ править ]
Спектр флуоресцентного излучения пирена очень чувствителен к полярности растворителя, поэтому пирен использовался в качестве зонда для определения среды растворителя. Это связано с тем, что его возбужденное состояние имеет непланарную структуру, отличную от основной. Некоторые полосы излучения остаются неизменными, но другие различаются по интенсивности из-за силы взаимодействия с растворителем.
Хотя он не так опасен, как бензопирен , исследования на животных показали, что пирен токсичен для почек и печени . Сейчас известно, что пирен влияет на несколько жизненных функций рыб и водорослей. [7] [8] [9] [10]
Эксперименты на свиньях показывают, что 1-гидроксипирен с мочой является метаболитом пирена при пероральном введении. [11]
Пирены являются сильными электронодонорными материалами и могут быть объединены с несколькими материалами для создания электронодонорно-акцепторных систем, которые могут использоваться в приложениях преобразования энергии и сбора света. [3]
См. Также [ править ]
- Список межзвездных и околозвездных молекул
- Пергидропирен
Ссылки [ править ]
- ^ a b Сенкан, Селим и Кастальди, Марко (2003) «Горение» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Weinheim.
- ^ Gumprecht, WH (1968). «3-Бромопирен». Орг. Synth . 48 : 30. DOI : 10,15227 / orgsyn.048.0030 .
- ^ a b Тагматархис, Никос; Ewels, Christopher P .; Биттенкур, Карла; Ареналь, Рауль; Пелаэс-Фернандес, Марио; Сайед-Ахмад-Бараза, Юман; Кантон-Витория, Рубен (2017-06-05). «Функционализация MoS 2 1,2-дитиоланами: в сторону донорно-акцепторных наногибридов для преобразования энергии» . NPJ 2D Материалы и приложения . 1 (1): 13. DOI : 10.1038 / s41699-017-0012-8 . ISSN 2397-7132 .
- ^ Ван Дайк, Дэвид А .; Прайор, Брайан А .; Смит, Филип Дж .; Топп, Майкл Р. (май 1998 г.). «Наносекундная флуоресцентная спектроскопия с временным разрешением в лаборатории физической химии: образование эксимера пирена в растворе». Журнал химического образования . 75 (5): 615. DOI : 10.1021 / ed075p615 .
- ^ Förster, Th .; Каспер, К. (июнь 1954 г.). "Ein Konzentrationsumschlag der Fluoreszenz". Zeitschrift für Physikalische Chemie . 1 (5_6): 275–277. DOI : 10.1524 / zpch.1954.1.5_6.275 .
- ^ Фам, Туан Ань; Сун, Фэй; Нгуен, Мань-Тхыонг; Штёр, Мейке (2014). «Самосборка производных пирена на Au (111): влияние заместителей на межмолекулярные взаимодействия» . Chem. Commun . 50 (91): 14089–92. DOI : 10.1039 / C4CC02753A . PMID 24905327 .
- ^ Oliveira, M .; Ribeiro, A .; Hylland, K .; Гильермино, Л. (2013). «Единичное и комбинированное воздействие микропластиков и пирена на молодь (группа 0+) микропов бычка Pomatoschistus (Teleostei, Gobiidae)». Экологические показатели . 34 : 641–647. DOI : 10.1016 / j.ecolind.2013.06.019 .
- ^ Oliveira, M .; Gravato, C .; Гильермино, Л. (2012). «Острое токсическое действие пирена на микробы Pomatoschistus (Teleostei, Gobiidae): смертность, биомаркеры и способность плавать». Экологические показатели . 19 : 206–214. DOI : 10.1016 / j.ecolind.2011.08.006 .
- ^ Oliveira, M .; Ribeiro, A .; Гильермино, Л. (2012). «Влияние микропластика и ПАУ на микроводоросли Rhodomonas baltica и Tetraselmis chuii». Сравнительная биохимия и физиология. Часть A: Молекулярная и интегративная физиология . 163 : S19 – S20. DOI : 10.1016 / j.cbpa.2012.05.062 .
- ^ Oliveira, M .; Ribeiro, A .; Гильермино, Л. (2012). «Влияние кратковременного воздействия микропластиков и пирена на микробы Pomatoschistus (Teleostei, Gobiidae)». Сравнительная биохимия и физиология. Часть A: Молекулярная и интегративная физиология . 163 : S20. DOI : 10.1016 / j.cbpa.2012.05.063 .
- ^ Кеймиг, SD; Кирби, KW; Морган, Д.П .; Кейзер, JE; Хуберт, Т. Д. (1983). «Идентификация 1-гидроксипирена как основного метаболита пирена в моче свиньи». Xenobiotica . 13 (7): 415–20. DOI : 10.3109 / 00498258309052279 . PMID 6659544 .
Дальнейшее чтение [ править ]
- Биркс, Дж. Б. (1969). Фотофизика ароматических молекул . Лондон: Уайли.
- Валер, Б. (2002). Молекулярная флуоресценция: принципы и применение . Нью-Йорк: Wiley-VCH.
- Биркс, Дж. Б. (1975). «Эксимеры». Отчеты о достижениях физики . 38 (8): 903–974. DOI : 10.1088 / 0034-4885 / 38/8/001 . ISSN 0034-4885 .
- Фетцер, JC (2000). Химия и анализ крупных полициклических ароматических углеводородов . Нью-Йорк: Вили.
