 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид урана (VI) | |
| Другие имена Гексахлорид урана Перуранхлорид | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| UCl 6 | |
| Молярная масса | 450,745 г / моль |
| Внешность | темно-зеленое кристаллическое твердое вещество |
| Плотность | 3600 кг / м 3 |
| Температура плавления | 177 ° С (351 ° F, 450 К) |
| Точка кипения | 75 ° С (167 ° F, 348 К) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
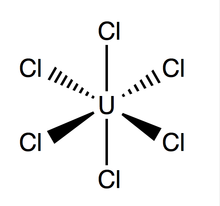
Уран гексахлорид (UCL 6 ) представляет собой неорганическое химическое соединение из урана в +6 , степени окисления . [1] [2] UCl 6 представляет собой галогенид металла, состоящий из урана и хлора . Это мультилюминесцентное темно-зеленое кристаллическое твердое вещество с давлением пара 1-3 мм рт.ст. при 373,15 К. [3] UCl 6 устойчив в вакууме , сухом воздухе, азоте и гелии при комнатной температуре . Растворим в четыреххлористом углероде (CCl 4). По сравнению с другими галогенидами урана о UCl 6 известно немного .
Структура и связь [ править ]
Гексахлорид урана имеет октаэдрическую геометрию с точечной группой O h . Его решетка (размеры: 10,95 ± 0,02 Å x 6,03 ± 0,01 Å) имеет гексагональную форму с тремя молекулами на ячейку; средняя теоретическая длина связи U-Cl составляет 2,472 Å (экспериментальная длина U-Cl, определенная с помощью дифракции рентгеновских лучей, составляет 2,42 Å) [4], а расстояние между двумя соседними атомами хлора составляет 3,65 Å.
Химические свойства [ править ]
Гексахлорид урана - это очень гигроскопичное соединение, которое легко разлагается при воздействии обычных атмосферных условий. [5] поэтому с ним следует обращаться либо в вакуумном аппарате, либо в сухом ящике.
Термическое разложение [ править ]
UCl 6 стабилен при температурах от 120 ° C до 150 ° C. Разложение по UCL 6 результатов в твердом фазовом переходе из одной кристаллической формы UCL 6 на другую более стабильную форму. [6] Однако, разложение на газообразном UCL 6 производит UCL 5 . Энергия активации этой реакции составляет около 40 ккал на моль .
- 2 UCl 6 (г) → 2 UCl 5 (т) + Cl 2 (г)
Растворимость [ править ]
UCl 6 - не очень растворимое соединение. Он растворяется в CCl 4 с образованием коричневого раствора. Он слабо растворим в изобутилбромиде и фторуглероде (C 7 F 16 ). [7]
| Растворители | Температура (° C) | Грамм UCL 6 /100 г раствора |
|---|---|---|
| CCl 4 | −18 | 2,64 |
| CCl 4 | 0 | 4.9 |
| CCl 4 | 20 | 7,8 |
| 6,6% Cl 2 : 93,4% CCl 4 | −20 | 2,4 |
| 12,5% Cl 2 : 87,5% CCl 4 | −20 | 2,23 |
| 12,5% Cl 2 : 87,5% CCl 4 | 0 | 3,98 |
| Жидкий Cl 2 | −33 | 2,20 |
| CH 3 Cl | −24 | 1,16 |
| Бензол | 80 | Нерастворимый |
| Фреон 113 | 45 | 1,83 |
Реакция с фтористым водородом [ править ]
Когда UCl 6 реагирует с очищенным безводным жидким фтористым водородом (HF) при комнатной температуре, образуется UF 5 . [8]
- 2 UCl 6 + 10 HF → 2 UF 5 + 10 HCl + Cl 2
Синтез [ править ]
Гексахлорид урана может быть синтезирован в результате реакции триоксида урана (UO 3 ) со смесью жидкого CCl 4 и горячего хлора (Cl 2 ). Выход может быть увеличен, если реакцию проводить в присутствии UCl 5 . [9] UO 3 превращается в UCl 5 , который, в свою очередь, реагирует с избытком Cl 2 с образованием UCl 6 . Для протекания реакции требуется значительное количество тепла ; диапазон температур от 65 ° C до 170 ° C в зависимости от количества реагента(идеальная температура 100 ° C - 125 ° C). Реакция проводится в закрытом газонепроницаемом сосуде (например, перчаточном ящике ), который может выдерживать создаваемое давление.
Шаг 1: 2 UO 3 + 5 Cl 2 → 2 UCl 5 + 3 O 2
Шаг 2: 2 UCl 5 + Cl 2 → 2 UCl 6
Общая реакция: 2 UO 3 + 6 Cl 2 → 2 UCl 6 + 3 O 2
Этот гексагалогенид металла также можно синтезировать продувкой газообразного Cl 2 над сублимированным UCl 4 при 350 ° C. [10]
Шаг 1: 2 UCl 4 + Cl 2 → 2 UCl 5
Шаг 2: 2 UCl 5 + Cl 2 → 2 UCl 6
Общая реакция: UCl 4 + Cl 2 → UCl 6
Ссылки [ править ]
- ^ Захариасен, WH (1948). «Кристаллохимические исследования элементов 5f-ряда. V. Кристаллическая структура гексахлорида урана». Acta Crystallographica . 1 (6): 285–287. DOI : 10.1107 / S0365110X48000788 .
- ^ Тейлор, JC; Уилсон, П. В. (1974). «Нейтронные и рентгеноструктурные исследования структуры гексахлорида урана». Acta Crystallographica Раздел B . 30 (6): 1481. DOI : 10,1107 / S0567740874005115 .
- ^ Ван Дайк, RE; Эверс, EC (1955). «Получение гексахлорида урана». Патенты Google : 2.
- ^ Батиста, ER; Мартин, Р.Л .; Хэй, П.Дж. (2004). "Функциональные исследования свойств и термодинамики UF n и UCl n (n = 1, ..., 6)" . J. Chem. Phys . 121 (22): 11104–11. DOI : 10.1063 / 1.1811607 . PMID 15634063 .
- ^ Липкин, Д .; Вессман, С. (1955). «Процесс и оборудование для защиты гексахлорида урана от разрушения и загрязнения». Патенты Google : 2.
- ^ Кац, JJ; Рабинович, Э. (1951). Химия урана . Анн-Арбор: Книжная компания McGraw-Hill.
- ^ Кац, JJ; Рабинович, Э. (1951). Химия урана . Анн-Арбор: Книжная компания McGraw-Hill.
- ^ Кац, JJ; Рабинович, Э. (1951). Химия урана . Анн-Арбор: Книжная компания McGraw-Hill.
- ^ Ван Дайк, RE; Эверс, EC (1955). «Получение гексахлорида урана». Патенты Google : 2.
- ^ Торнтон, G .; Эдельштейн, Н .; Rösch, N .; Woodwark, DR; Эджелл, Р.Г. (1979). «Электронная структура UCl 6 : фотоэлектронные спектры и расчеты рассеянной волны X α ». J. Chem. Phys . 70 (11): 6. Bibcode : 1979JChPh..70.5218T . DOI : 10.1063 / 1.437313 .