 | |
| Имена | |
|---|---|
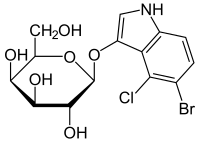
| Название ИЮПАК 5-бром-4-хлор-3-индолил-β-D-галактопиранозид | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.027.855 |
| MeSH | X-gal |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| С 14 Н 15 BrClNO 6 | |
| Молярная масса | 408,629 |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
X-gal (также сокращенно BCIG для 5-бром-4-хлор-3-индолил-β-D-галактопиранозида) представляет собой органическое соединение, состоящее из галактозы, связанной с замещенным индолом . Это соединение было синтезировано Джеромом Хорвицем и его сотрудниками в Детройте, штат Мичиган, в 1964 году. [1] Официальное химическое название часто сокращается до менее точных, но также менее громоздких фраз, таких как бромхлориндоксилгалактозид. X из индоксила может быть источником X в сокращении X-gal. X-gal часто используется в молекулярной биологии для проверки наличия фермента β-галактозидазы.. Он также используется для определения активности этого фермента в гистохимии и бактериологии . X-gal является одним из многих индоксилгликозидов и сложных эфиров, которые дают нерастворимые синие соединения, подобные красителю индиго, в результате гидролиза, катализируемого ферментами. [2]
Использует [ редактировать ]
X-Gal является аналогом из лактозы , и , следовательно , может быть гидролизован с помощью β-галактозидаза фермента , который расщепляет бета- гликозидной связи в D-лактозе. X-gal при расщеплении β-галактозидазой дает галактозу и 5-бром-4-хлор-3-гидроксииндол - 1 . Последний затем самопроизвольно димеризуется и окисляется до 5,5'-дибром-4,4'- дихлориндиго - 2 , сильно синего продукта, который нерастворим. Сама X-gal бесцветна, поэтому наличие продукта синего цвета можно использовать в качестве теста на наличие активной β-галактозидазы. Это также позволяет использовать бактериальную β-галактозидазу (так называемую lacZ ) в качестве репортера.в различных приложениях. [3]
Реакция [ править ]
Клонирование [ править ]
При клонировании генов X-gal используется в качестве визуального индикатора того, экспрессирует ли клетка функциональный фермент β-галактозидаза, с помощью метода, называемого скринингом синего / белого . Этот метод скрининга - удобный способ отличить успешный продукт клонирования от других неудачных.
Метод скрининга «синий / белый» основан на принципе α-комплементации гена β-галактозидазы, где фрагмент гена lacZ (lacZα) в плазмиде может дополнять другой мутантный ген lacZ (lacZΔM15) в клетке. Оба гена сами по себе продуцируют нефункциональные пептиды, однако при совместной экспрессии, например, когда плазмида, содержащая lacZα , трансформируется в lacZΔM15клетки они образуют функциональную β-галактозидазу. Присутствие активной β-галактозидазы может быть обнаружено, когда клетки выращивают в чашках, содержащих X-gal, продукт синего цвета, осажденный внутри клеток, дает характерные синие колонии. Однако сайт множественного клонирования, где представляющий интерес ген может быть лигирован в плазмидный вектор, находится внутри гена lacZα . Таким образом, успешное лигирование разрушает ген lacZα , следовательно , α-комплементация также нарушается, и функциональная β-галактозидаза не может образовываться, что приводит к образованию белых колоний. Клетки, содержащие успешно лигированную вставку, затем можно легко отличить по ее белой окраске от неудачных синих. Примером векторов клонирования, используемых для этого теста, являются pUC19 ,pBluescript , pGem-T Vectors, а также требует использования определенных штаммов-хозяев E. coli , таких как DH5α, который несет мутантный ген lacZΔM15. Часто чашки, содержащие X-Gal, также содержат IPTG (изопропил ß-D-1- тиогалактопиранозид). IPTG - аналог лактозы по химическому строению. [4] Однако IPTG не может гидролизоваться β-галактозидазой. IPTG используется в качестве индуктора, который связывается с lac-репрессором, высвобождая ДНК и обеспечивая транскрипцию. Таким образом, присутствие IPTG в чашке с агаром увеличивает синтез β-галактозидазы. [5]
Варианты [ править ]
X-gal имеет несколько вариантов, которые представляют собой похожие молекулы с небольшими различиями, служащие в основном для получения цветов, отличных от синего, в качестве сигнала.
| Короткое имя | Длинное имя | Цвет |
|---|---|---|
| Blue-Gal, Bluo-Gal | 5-бром-3-индолил β-D-галактопиранозид | Темно-синий [6] |
| Роуз-Гал, Лосось-Гал, И-Гал, Ред-Гал | 6-хлор-3-индолил-β-D-галактопиранозид | Розовый [7] |
| Фиолетовый-β-D-гал | 5-йод-3-индолил-β-D-галактопиранозид | Пурпурный [8] |
| Пурпурный глюкозид, Magenta-GLC, Magenta gal | 5-бром-6-хлор-3-индолил-β-D-глюкопиранозид | Пурпурный [9] |
| Зеленый-β-D-галлон | N-метилиндолил-β-D-галактопиранозид | Зеленый [10] |
| КРУЖКА, МУГА | 4-метилумбеллиферил β-D-галактопиранозид | Флуоресцентный [11] (λ ex = 365, λ em = 455) |
Белковые взаимодействия [ править ]
В двухгибридном анализе β-галактозидаза может использоваться в качестве репортера для идентификации белков, которые взаимодействуют друг с другом. В этом методе библиотеки генома могут быть проверены на взаимодействие с белками с использованием дрожжевой или бактериальной системы. В случае успешного взаимодействия между проверяемыми белками это приведет к связыванию домена активации с промотором. Если промотор связан с геном lacZ , продукция β-галактозидазы, которая приводит к образованию колоний с синим пигментом в присутствии X-gal, будет, следовательно, указывать на успешное взаимодействие между белками. [12] Этот метод может быть ограничен скринингом библиотек размером менее 10 6 . [12]Успешное расщепление X-gal также создает заметно неприятный запах из-за испарения индола .
См. Также [ править ]
- X-Gluc
Ссылки [ править ]
- ^ Horwitz JP и 7 других, 1964. Субстраты для цитохимической демонстрации активности ферментов. I. Некоторые замещенные 3-индолил-β-D-гликопиранозиды. Журнал медицинской химии 7: 574-575.
- ^ Kiernan JA 2007. Индигогенные субстраты для обнаружения и локализации ферментов. Биотехника и гистохимия 82 (2): 73-103.
- ^ Санда, Sardul Singh (2010). Технология рекомбинантной ДНК . ИК Международный издательский дом. п. 116. ISBN 978-9380578446.
- ^ «IPTG - Биолайн» . www.bioline.com . Проверено 15 мая 2018 .
- ^ http://www.edvotek.com/300.051205.pdf
- ^ «5-Бром-3-индолил β-D-галактопиранозид» . Проверено 4 февраля 2014 года .
- ^ "Лосось-Гал - PubChem" . Проверено 4 февраля 2014 года .
- ^ "Purple-beta-D-Gal - PubChem" . Проверено 4 февраля 2014 года .
- ^ «5-Бром-6-хлор-3-индолил-β-D-глюкопиранозид» . Проверено 4 февраля 2014 года .
- ^ "Green-β-D-Gal - Biotium, Inc" . Проверено 4 февраля 2014 года .
- ^ «4-Метилумбеллиферил β-D-галактопиранозид» . Проверено 4 февраля 2014 года .
- ^ Б Joung Дж, Рамм Е, Pabo С (2000). «Бактериальная двухгибридная селекционная система для изучения взаимодействий белок-ДНК и белок-белок» . Proc Natl Acad Sci USA . 97 (13): 7382–7. DOI : 10.1073 / pnas.110149297 . PMC 16554 . PMID 10852947 .