| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Ацетальдегид [3] | |||
| Систематическое название ИЮПАК Этанал [3] | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.761 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
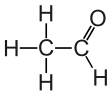
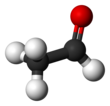
| С 2 Н 4 О | |||
| Молярная масса | 44,053 г · моль -1 | ||
| Внешность | Бесцветная жидкость | ||
| Запах | Эфирный | ||
| Плотность | 0,784 г · см −3 (20 ° C) [4] 0,7904–0,7928 г · см -3 (10 ° C) [4] | ||
| Температура плавления | -123,37 ° С (-190,07 ° F, 149,78 К) | ||
| Точка кипения | 20,2 ° С (68,4 ° F, 293,3 К) | ||
| смешивающийся | |||
| Растворимость | смешивается с этанолом , эфиром , бензолом , толуолом , ксилолом , скипидаром , ацетоном, слабо растворяется в хлороформе | ||
| журнал P | -0,34 | ||
| Давление газа | 740 мм рт. Ст. (20 ° C) [5] | ||
| Кислотность (p K a ) | 13,57 (25 ° C, H 2 O) [6] | ||
Магнитная восприимчивость (χ) | -5153 −6 см 3 / г | ||
Показатель преломления ( n D ) | 1,3316 | ||
| Вязкость | 0,21 мПа-с при 20 ° C (0,253 мПа-с при 9,5 ° C) [7] | ||
| Структура | |||
Молекулярная форма | тригонально плоский (sp²) в C 1 тетраэдрический (sp³) в C 2 | ||
Дипольный момент | 2,7 D | ||
| Термохимия | |||
Стандартная мольная энтропия ( S | 250 Дж · моль −1 · K −1 | ||
Std энтальпия формации (Δ F H ⦵ 298 ) | −166 кДж · моль −1 | ||
| Опасности | |||
| Основные опасности | потенциальный профессиональный канцероген [9] | ||
| Паспорт безопасности | См .: страницу данных HMDB | ||
| Пиктограммы GHS | [8] | ||
Формулировки опасности GHS | H224 , H319 , H335 , H351 [8] | ||
Меры предосторожности GHS | P210 , P261 , P281 , P305 + 351 + 338 [8] | ||
| NFPA 704 (огненный алмаз) |  4 3 3 | ||
| точка возгорания | -39,00 ° С; -38,20 ° F; 234,15 К | ||
самовоспламенения температуру | 175,00 ° С; 347,00 ° F; 448,15 К [5] | ||
| Пределы взрываемости | 4,0–60% | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD 50 ( средняя доза ) | 1930 мг / кг (крыса, перорально) | ||
ЛК 50 ( средняя концентрация ) | 13 000 частей на миллион (крыса), 17 000 частей на миллион (хомяк), 20 000 частей на миллион (крыса) [9] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | 200 частей на миллион (360 мг / м 3 ) [5] | ||
IDLH (Непосредственная опасность) | 2000 частей на миллион [5] [9] | ||
| Родственные соединения | |||
Родственные альдегиды | Формальдегид Пропионовый альдегид | ||
Родственные соединения | Окись этилена | ||
| Страница дополнительных данных | |||
Структура и свойства | Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | ||
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ | ||
Спектральные данные | УФ , ИК , ЯМР , МС | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Ацетальдегид (систематическое название этаналь ) представляет собой органическое химическое соединение с формулой CH 3 CHO , иногда сокращенно химиками как MeCHO (Me = метил ). Это один из наиболее важных альдегидов , широко встречающихся в природе и производимых в промышленных масштабах. Ацетальдегид естественным образом содержится в кофе, хлебе и спелых фруктах [10] и вырабатывается растениями. Он также вырабатывается частичным окислением этанола ферментом печени алкогольдегидрогеназой и является одной из причин похмелья после употребления алкоголя.потребление. Пути воздействия включают воздух, воду, землю или грунтовые воды, а также питье и дым. [11] Потребление дисульфирама подавляет ацетальдегиддегидрогеназу , фермент, отвечающий за метаболизм ацетальдегида, тем самым вызывая его накопление в организме.
Международное агентство по изучению рака (IARC) внесло ацетальдегид в список канцерогенов группы 1 . [12] Ацетальдегид - «один из наиболее часто встречающихся в воздухе токсинов с риском рака более одного на миллион». [13]
История [ править ]
Ацетальдегид впервые обнаружил шведский фармацевт / химик Карл Вильгельм Шееле (1774 г.); [14] это было затем исследовано французскими химиками Антуаном Франсуа, графом де Фуркрой и Луи Николя Вокленом (1800), [15] и немецкими химиками Иоганном Вольфгангом Доберейнером (1821, 1822, 1832) [16] и Юстусом фон Либихом ( 1835 г.). [17] [18] В 1835 году Либих назвал его «альдегидом»; [19] название было позже изменено на «ацетальдегид». [20]
Производство [ править ]
В 2003 году мировое производство составило около 1 миллиона тонн. До 1962 г. основными источниками ацетальдегида были этанол и ацетилен . С тех пор этилен является доминирующим сырьем . [21]
Основным методом производства является окисление этилена по процессу Wacker , который включает окисление этилена с использованием гомогенной системы палладий / медь:
- 2 СН 2 = СН 2 + О 2 → 2 СН 3 СНО
В 1970-е годы мировая мощность процесса прямого окисления Wacker-Hoechst превышала 2 миллиона тонн в год.
Меньшие количества можно получить путем частичного окисления этанола в экзотермической реакции. Этот процесс обычно проводится на серебряном катализаторе при температуре около 500–650 ° C. [21]
- СН 3 СН 2 ОН + 1 / 2 O 2 → CH 3 CHO + Н 2 О
Этот метод является одним из старейших способов промышленного получения ацетальдегида.
Другие методы [ править ]
Гидратация ацетилена [ править ]
До процесса Wacker и наличие дешевого этилена, ацетальдегид был произведен гидратацией из ацетилена . [22] Эта реакция катализируется солями ртути (II) :
- C 2 H 2 + Hg 2+ + H 2 O → CH 3 CHO + Hg
Механизм включает взаимодействие винилового спирта , который таутомеризуется до ацетальдегида. Реакцию проводят при 90–95 ° C, образовавшийся ацетальдегид отделяют от воды и ртути и охлаждают до 25–30 ° C. В мокром окислении процесса, железа (III) , сульфат используется для повторного окисления ртути обратно в ртуть (II) соли. Полученный сульфат железа (II) окисляют азотной кислотой в отдельном реакторе . [21]
Дегидрирование этанола [ править ]
Традиционно ацетальдегид получали частичным дегидрированием этанола:
- СН 3 СН 2 ОН → СН 3 СНО + Н 2
В этом эндотермическом процессе пары этанола пропускаются при температуре 260–290 ° C над катализатором на основе меди. Когда-то этот процесс был привлекательным из-за ценности побочного продукта водорода [21], но в наше время он экономически невыгоден.
Гидроформилирование метанола [ править ]
Гидроформилировании из метанола с катализаторами , такими как кобальт, никель, или соли железы также производит ацетальдегид, хотя этот процесс не имеет промышленного значения. Точно так же неконкурентоспособный ацетальдегид образуется из синтез-газа с умеренной селективностью. [21]
Реакции [ править ]
Таутомеризация ацетальдегида в виниловый спирт [ править ]
Как и многие другие карбонильные соединения , ацетальдегид таутомеризуется с образованием енола ( виниловый спирт ; название IUPAC: этенол):
- CH 3 CH = O ⇌ CH 2 = CHOH ∆ H 298, г = +42,7 кДж / моль
Константа равновесия составляет 6 × 10 -7 при комнатной температуре, поэтому относительное количество енольной формы в образце ацетальдегида очень мало. [23] При комнатной температуре ацетальдегид (CH 3 CH = O) более стабилен, чем виниловый спирт (CH 2 = CHOH), на 42,7 кДж / моль: [24] В целом таутомеризация кето-енола происходит медленно, но катализируется кислотами.
Фотоиндуцированная таутомеризация кето-енолов жизнеспособна в атмосферных или стратосферных условиях. Эта фото-таутомеризация имеет отношение к атмосфере Земли, потому что виниловый спирт считается предшественником карбоновых кислот в атмосфере. [25] [26]
Реакции конденсации [ править ]
Ацетальдегид - распространенный электрофил в органическом синтезе . [27] В реакциях конденсации ацетальдегид прохирален . Он используется в первую очередь как источник синтона «CH 3 C + H (OH)» в альдольных и родственных реакциях конденсации. [28] Реагенты Гриньяра и литийорганические соединения реагируют с MeCHO с образованием гидроксиэтильных производных. [29] В одной из наиболее впечатляющих реакций конденсации три эквивалента формальдегида добавляют к MeCHO с образованием пентаэритрита , C (CH 2 OH) 4. [30]
В реакции Штрекера , ацетальдегид конденсируется с цианидом и аммиаком с получением, после гидролиза , на аминокислоты аланина . [31] Ацетальдегид может конденсироваться с аминами с образованием иминов ; например, с циклогексиламином с получением N- этилиденциклогексиламина. Эти имины можно использовать для управления последующими реакциями, такими как альдольная конденсация. [32]
Это также строительный блок в синтезе гетероциклических соединений . В одном примере он превращается после обработки аммиаком в 5-этил-2-метилпиридин («альдегид-коллидин»). [33]
Производные ацетала [ править ]
Три молекулы ацетальдегида конденсируются с образованием « паральдегида », циклического тримера, содержащего одинарные связи CO. Аналогичным образом конденсация четырех молекул ацетальдегида дает циклическую молекулу метальдегида . Паральдегид может быть получен с хорошими выходами при использовании сернокислотного катализатора. Металдегид получается только с выходом в несколько процентов и при охлаждении, часто с использованием HBr, а не H 2 SO 4 в качестве катализатора. При -40 ° C в присутствии кислотных катализаторов образуется полиацетальдегид. [21]
Ацетальдегид образует стабильный ацеталь при реакции с этанолом в условиях, благоприятствующих дегидратации. Продукт, CH 3 CH (OCH 2 CH 3 ) 2 , формально называется 1,1-диэтоксиэтаном, но обычно его называют «ацеталем». [34] Это может вызвать путаницу, поскольку «ацеталь» чаще используется для описания соединений с функциональными группами RCH (OR ') 2 или RR'C (OR' ') 2, а не для обозначения этого конкретного соединения - фактически 1 , 1-диэтоксиэтан также описывается как диэтилацеталь ацетальдегида.
Прекурсор винилфосфоновой кислоты [ править ]
Ацетальдегид является предшественником винилфосфоновой кислоты , который используется для изготовления клеев и ионных проводящих мембран. Последовательность синтеза начинается с реакции с трихлоридом фосфора : [35]
- PCl 3 + CH 3 CHO → CH 3 CH (O - ) PCl 3 +
- CH 3 CH (O - ) PCl 3 + + 2 CH 3 CO 2 H → CH 3 CH (Cl) PO (OH) 2 + 2 CH 3 COCl
- CH 3 CH (Cl) PO (OH) 2 → CH 2 = CHPO (OH) 2 + HCl
Биохимия [ править ]
В печени , то фермент алкогольдегидрогеназы окисляет этанол в ацетальдегид, который затем окисл ют далее в безвредные уксусной кислоты путем ацетальдегид дегидрогеназы . Эти две реакции окисления сочетаются с восстановлением НАД + до НАДН . [36] В мозге фермент каталаза в первую очередь отвечает за окисление этанола до ацетальдегида, а алкогольдегидрогеназа играет второстепенную роль. [36] Последние стадии спиртового брожения бактерий, растений и дрожжей.вовлекают преобразование пирувата в ацетальдегид и диоксид углерода ферментом пируватдекарбоксилазой с последующим преобразованием ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, теперь действующей в противоположном направлении.
Использует [ редактировать ]
Традиционно ацетальдегид в основном использовался в качестве предшественника уксусной кислоты. Это применение было отклонено, потому что уксусная кислота более эффективно производится из метанола с помощью процессов Monsanto и Cativa . Ацетальдегид является важным предшественником производных пиридина , пентаэритрита и кротонового альдегида . Мочевина и ацетальдегид объединяются, чтобы получить полезную смолу . Уксусный ангидрид реагирует с ацетальдегидом с образованием этилидендиацетата , предшественника винилацетата , который используется для производства поливинилацетата . [21]
Мировой рынок ацетальдегида сокращается. На спрос повлияли изменения в производстве спиртов-пластификаторов, которые изменились, потому что н- бутиральдегид реже получают из ацетальдегида, а не получают путем гидроформилирования пропилена . Точно так же уксусная кислота , однажды полученная из ацетальдегида, производится преимущественно с помощью более дешевого процесса карбонилирования метанола. [37] Воздействие на спрос привело к росту цен и, следовательно, к замедлению роста рынка.
Потребление ацетальдегида (10 3 т) в 2003 г. [21]
(* Включено в прочие -глиоксаль / глиоксалевую кислоту, кротоновый альдегид, молочную кислоту, н- бутанол, 2-этилгексанол)
| Товар | Соединенные Штаты Америки | Мексика | Западная Европа | Япония | Общий |
|---|---|---|---|---|---|
| Уксусная кислота / уксусный ангидрид | - | 11 | 89 | 47 | 147 |
| Эфиры ацетата | 35 год | 8 | 54 | 224 | 321 |
| Пентаэритритол | 26 | - | 43 | 11 | 80 |
| Пиридиновые и пиридиновые основания | 73 | - | 10 | * | 83 |
| Надуксусная кислота | 23 | - | - | * | 23 |
| 1,3-бутиленгликоль | 14 | - | - | * | 14 |
| Другие | 5 | 3 | 10 | 80 | 98 |
| Общий | 176 | 22 | 206 | 362 | 766 |
Китай является крупнейшим потребителем ацетальдегида в мире, на него в 2012 году приходилась почти половина мирового потребления. Основным применением уксусной кислоты было производство. Ожидается, что другие применения, такие как пиридины и пентаэритрит, будут расти быстрее, чем уксусная кислота, но объемы недостаточны, чтобы компенсировать снижение содержания уксусной кислоты. Как следствие, общее потребление ацетальдегида в Китае может незначительно увеличиваться на 1,6% в год до 2018 года. Западная Европа является вторым по величине потребителем ацетальдегида в мире, на долю которого в 2012 году приходилось 20% мирового потребления. Как и в случае с Китаем, западноевропейский ацетальдегид ожидается, что рынок будет расти лишь незначительно - 1% в год в течение 2012–2018 годов. Однако Японияможет стать потенциальным потребителем ацетальдегида в следующие пять лет в связи с новым использованием бутадиена в коммерческом производстве . Предложение бутадиена в Японии и других странах Азии было нестабильным. Это должно обеспечить столь необходимый рост плоского рынка с 2013 года [38].
Безопасность [ править ]
Пределы воздействия [ править ]
Пороговый предел составляет 25 ppm (значение / потолок СТЭЛ) и МАК (максимальная концентрация на рабочем месте) составляет 50 частей на миллион. При концентрации ацетальдегида 50 ppm не наблюдается раздражения или местного повреждения тканей слизистой оболочки носа . Попадая в организм, ацетальдегид быстро метаболизируется в печени до уксусной кислоты. Лишь небольшая часть выдыхается без изменений. После внутривенной инъекции период полувыведения в крови составляет примерно 90 секунд. [21]
Опасности [ править ]
Токсичность [ править ]
Серьезных случаев острой интоксикации не зарегистрировано. [21] Ацетальдегид естественным образом распадается в организме человека [11], но было показано, что он выделяется с мочой крыс. [39]
Раздражение [ править ]
Ацетальдегид раздражает кожу, глаза, слизистые оболочки, горло и дыхательные пути. Это происходит при таких низких концентрациях, как 1000 ppm. Симптомы воздействия этого соединения включают тошноту , рвоту и головную боль . Эти симптомы могут проявиться не сразу. Восприятие порог ацетальдегида в воздухе находится в диапазоне между 0,07 и 0,25 частей на миллион. [21] При таких концентрациях очевиден фруктовый запах ацетальдегида. Раздражение конъюнктивы наблюдалось после 15-минутного воздействия концентраций 25 и 50 ppm, но преходящий конъюнктивит и раздражение дыхательных путей тракта после воздействия ацетальдегида 200 ppm в течение 15 минут.
Канцерогенность [ править ]
Ацетальдегид канцерогенен для человека. [40] [41] В 1988 году Международное агентство по изучению рака заявило: «Имеется достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) у экспериментальных животных ». [42] В октябре 2009 года Международное агентство по изучению рака обновило классификацию ацетальдегида, заявив, что ацетальдегид, входящий в состав алкогольных напитков и генерируемый эндогенно из алкогольных напитков, является канцерогеном для человека I группы. [43] Кроме того, ацетальдегид повреждает ДНК [44]и вызывает ненормальное развитие мышц, поскольку связывается с белками. [45]
Отягчающие факторы [ править ]
Болезнь Альцгеймера [ править ]
Люди с генетической недостаточностью фермента, ответственного за превращение ацетальдегида в уксусную кислоту, могут иметь больший риск болезни Альцгеймера . «Эти результаты показывают, что дефицит ALDH2 является фактором риска НАГРУЗКИ [болезнь Альцгеймера с поздним началом] ...» [46]
Генетические условия [ править ]
Исследование 818 алкоголиков показало, что те, кто подвергается воздействию большего количества ацетальдегида, чем обычно, из-за генетического варианта гена, кодирующего алкогольдегидрогеназу, подвергаются большему риску развития рака верхних отделов желудочно-кишечного тракта и печени. [47]
Дисульфирам [ править ]
Препарат дисульфирам (Антабус) предотвращает окисление ацетальдегида до уксусной кислоты. Антабус иногда используется как средство отпугивания алкоголиков, желающих оставаться трезвыми.
Источники воздействия [ править ]
Внутренний воздух [ править ]
Ацетальдегид является потенциальным загрязнителем на рабочем месте, в помещении и в окружающей среде. Более того, большинство людей проводят более 90% своего времени в помещениях, увеличивая любое воздействие и риск для здоровья человека. [48]
В исследовании, проведенном во Франции , средняя концентрация ацетальдегида в помещении, измеренная в 16 домах, была примерно в семь раз выше, чем концентрация ацетальдегида снаружи. В гостиной среднее значение составляло 18,1 ± 17,5 мкг м -3, а в спальне - 18,2 ± 16,9 мкг м -3 , тогда как в наружном воздухе средняя концентрация составляла 2,3 ± 2,6 мкг м -3 . [ необходима цитата ]
Был сделан вывод, что летучие органические соединения (ЛОС), такие как бензол, формальдегид, ацетальдегид, толуол и ксилолы , следует рассматривать в качестве приоритетных загрязнителей с точки зрения их воздействия на здоровье. Было отмечено, что в отремонтированных или полностью новых зданиях уровни концентрации ЛОС часто на несколько порядков выше. Основными источниками ацетальдегидов в домах являются строительные материалы, ламинат, линолеум, лакированная древесина и полы из пробки / сосны. Он также содержится в пластиковых красках на водной основе и в матовых эмульсионных красках, в деревянных потолках, а также в деревянной мебели, ДСП, фанере, сосне и ДСП. [49]
Наружный воздух [ править ]
Ацетальдегид широко используется в различных отраслях промышленности, и он может попадать в сточные воды или в воздух во время производства, использования, транспортировки и хранения. Источники ацетальдегида включают выбросы от сжигания топлива от стационарных двигателей внутреннего сгорания и электростанций, сжигающих ископаемое топливо, древесину или мусор, добычи нефти и газа, нефтеперерабатывающих заводов, цементных печей, лесопильных и деревообрабатывающих заводов и бумажных фабрик. Ацетальдегид также присутствует в выхлопных газах автомобилей и дизельных двигателей . [50] В результате ацетальдегид является «одним из наиболее часто встречающихся токсичных веществ в воздухе с риском рака более одного на миллион». [13]
Табачный дым [ править ]
Было показано, что природные полисахариды табака , включая целлюлозу , являются основными предшественниками, делающими ацетальдегид важным компонентом табачного дыма . [51] [52] Он показал синергетический эффект с никотином в исследованиях зависимости от грызунов . [53] [54] Ацетальдегид также является самым распространенным канцерогеном в табачном дыме; при курении растворяется в слюне .
Дым каннабиса [ править ]
Ацетальдегид был обнаружен в дыме каннабиса . Это открытие стало результатом использования новых химических методов, которые продемонстрировали, что присутствующий ацетальдегид вызывает повреждение ДНК в лабораторных условиях. [55]
Употребление алкоголя [ править ]
Многие микробы производят ацетальдегид из этанола, но они обладают меньшей способностью выводить ацетальдегид, что может привести к накоплению ацетальдегида в слюне, желудочной кислоте и содержимом кишечника. Ферментированные продукты и многие алкогольные напитки также могут содержать значительное количество ацетальдегида. Ацетальдегид, полученный в результате окисления этанола, табачного дыма и диеты через слизистую оболочку или микробами, по-видимому, действует как кумулятивный канцероген в верхних отделах пищеварительного тракта человека. [56] Согласно «Заключению об ацетальдегиде» (2012 г.) Научного комитета Европейской комиссии по безопасности потребителей (SCCS), особый предел риска косметических продуктов составляет 5 мг / л, а ацетальдегид не следует использовать для полоскания рта.товары. [57]
Пластмассы [ править ]
Ацетальдегид также образуется в результате термического разложения или ультрафиолетового фотодеградации некоторых термопластичных полимеров во время или после производства. Один из распространенных примеров - это когда бутылку воды оставляют в горячей машине на несколько часов в жаркий солнечный день, и вы замечаете ее странный сладкий вкус в воде из-за разрушения контейнера из полиэтилентерефталата (PETE). [58] В водном хозяйстве обычно считается пороговым значением вкуса / запаха ацетальдегида 20-40 частей на миллиард . Уровень, при котором средний потребитель может обнаружить ацетальдегид, все еще значительно ниже, чем любая токсичность. [59]
Candida Overgrowth [ править ]
Candida albicans у пациентов с потенциально канцерогенными заболеваниями полости рта вырабатывает ацетальдегид в количествах, достаточных для возникновения проблем. [60]
См. Также [ править ]
- Алкогольдегидрогеназа
- Дисульфирамоподобный препарат
- Формальдегид
- Паральдегид
- Вина вина
Ссылки [ править ]
- ^ SciFinderScholar (по состоянию на 4 ноября 2009 г.). Ацетальдегид (75-07-0) Подробности о веществе.
- ^ Молекулярная патология и диагностика рака с. 190
- ^ a b Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 908. DOI : 10.1039 / 9781849733069-00648 . ISBN 978-0-85404-182-4.
- ^ a b Stoffdaten Acetaldehyd bei Celanese Chemicals. Архивировано 17 мая 2008 года в Wayback Machine по состоянию на декабрь 1999 года.
- ^ a b c d Карманный справочник NIOSH по химической опасности. «# 0001» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Хейнс, Уильям М., изд. (2016). CRC Справочник по химии и физике (97-е изд.). CRC Press . С. 5–88. ISBN 9781498754293.
- ^ «Ацетальдегид» .
- ^ a b c Sigma-Aldrich Co. , Ацетальдегид . Проверено 20 июля 2013.
- ^ a b c «Уксусный альдегид» . NIOSH. 4 декабря 2014 . Проверено 12 февраля 2015 года .
- ^ Uebelacker, Майкл; Лахенмайер, Дирк (13 июня 2011 г.). «Количественное определение ацетальдегида в пищевых продуктах с использованием автоматизированного пищеварения с имитацией желудочного сока с последующей газовой хроматографией в свободном пространстве» . Журнал автоматизированных методов и управления в химии . 2011 : 907317. дои : 10,1155 / 2011/907317 . PMC 3124883 . PMID 21747735 .
- ^ a b «Химические вещества в окружающей среде: ацетальдегид (№ КАС 75-07-0)» . epa.gov . Управление по предотвращению загрязнения и токсичности, Агентство по охране окружающей среды США. Август 1994. Архивировано 17 августа 2002 года . Проверено 22 января 2011 года .
- ^ Список канцерогенов IARC Group 1
- ^ а б Чжоу, Инь; Ли, Чаоян; Huijbregts, Mark AJ; Мумтаз, М. Мойз (7 октября 2015 г.). «Воздействие канцерогенных токсичных веществ в воздухе и их влияние на здоровье, связанное с раком в Соединенных Штатах» . PLOS One . 10 (10): e0140013. Bibcode : 2015PLoSO..1040013Z . DOI : 10.1371 / journal.pone.0140013 . PMC 4596837 . PMID 26444872 .
- ^ Шил, CW (1774) «Ом Brunsten Эллер магнезия нигра оч дес egenskaper» (на коричнево-камень или черный оксид магния [то есть, марганцевая руда] и его свойства), Kungliga Svenska vetenskapsakademiens handlingar (Труды Королевской шведской академии наук) , 35 : 89–116; 177–194. На страницах 109–110 Шееле упоминает, что при кипячении («переваривании») этанола ( Alkohol vini ) с диоксидом марганца ( Brunsten ) и либо соляной кислотой ( Spirtus salis ), либо серной кислотой ( Spiritus Vitrioli ) возникает запах, похожий на «эфир нитри».(этанол, обработанный азотной кислотой). Позже исследователи выяснили, что Шееле произвел ацетальдегид.
- ^ Примечание:
- Даби, фармацевт из Нанта, Франция, провел серию экспериментов и пришел к выводу, что ацетальдегид образуется, когда водород в этаноле соединяется с кислородом в серной кислоте с образованием воды: Dabit (1800) «Extrait du mémoire du cit. Dabit sur l'éther. " (Отрывок из воспоминаний гражданина Даби об эфире), Annales de Chimie , 34 : 289–305.
- Фуркрой и Воклен заявили, что серная кислота не потреблялась при производстве ацетальдегида: Fourcroy and Vauquelin (1800), «Sur l'éther préparé à la manière du cit. Dabit» (Об эфире, приготовленном по образцу гражданина Даби), Annales de Chimie , 34 : 318-332.
- ^ См .:
- (Döbereiner) (1821) «Neue Aether» (Новый эфир), Journal für Chemie und Physik , 32 : 269–270. Дёберейнер назвал новый эфир « Sauerstoffäther» (кислород-эфир).
- (Döbereiner) (1822) «Döbereiner's Apparat zur Darstellung des Sauerstoffaethers» (аппарат Доберейнера для получения кислород-эфира), Journal für Chemie und Physik , 34 : 124–125.
- Döbereiner, JW (1832) "Bildung des Sauerstoff-Aethers durch atmosphärische Oxidation des Alkohols" (Образование оксиэфира путем атмосферного окисления спирта), Journal für Chemie und Physik , 64 : 466–468. В этой статье Дёберейнер получил ацетальдегид, подвергая пары этанола воздействию воздуха в присутствии платиновой сажи.
- ^ Либих, Юстус (1835) «Ueber die Producte der Oxydation des Alkohols» (О продуктах окисления спирта [т.е. этанола]), Annalen der Chemie , 14 : 133–167.
- ^ Брок, Уильям Х. (1997) Юстус фон Либих: Химический привратник . Кембридж, Англия: Издательство Кембриджского университета, стр. 83–84 .
- ^ Либих, Дж. (1835) "Sur les produits de l'oxidation de l'alcool" (О продуктах окисления спирта), Annales de Chimie et de Physique , 59 : 289–327. С п. 290: «Je le décrirai dans ce mémoire sous le nom d' aldehyde; ce nom est formé de alcool dehydrogenatus ». (В своих мемуарах я назову его альдегидом ; это название образовано от алкоголя dehydrogenatus .)
- ↑ Изменение названия произошло, по крайней мере, в 1868 году. См., Например: Eugen F. von Gorup-Besanez, ed., Lehrbuch der organischen Chemie für den Unterricht auf Universitäten ... [Учебник органической химии для обучения в университетах. ..], 3-е изд. (Брауншвейг, Германия: Friedrich Vieweg und Sohn, 1868), т. 2, стр. 88 .
- ^ a b c d e f g h i j k Eckert, Marc et al. (2007) «Ацетальдегид» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a01_031.pub2
- ^ Дмитрий А. Пономарев; Шевченко Сергей Михайлович (2007). «Гидратация ацетилена: 125 лет» (PDF) . J. Chem. Educ. 84 (10): 1725. Bibcode : 2007JChEd..84.1725P . DOI : 10.1021 / ed084p1725 .
- ^ Киф, младший; Кресдж, AJ; Schepp, NP (1990). «Константы кето-енольного равновесия простых монофункциональных альдегидов и кетонов в водном растворе». Журнал Американского химического общества . 112 (12): 4862–4868. DOI : 10.1021 / ja00168a035 .
- ^ Джонсон, RD III "Стандартная справочная база данных CCCBDB NIST". nist.gov
- ^ Хизлвуд, BR; MacCarone, AT; Эндрюс, ДУ; Осборн, DL; Harding, LB; Клиппенштейн, SJ; Иордания, MJT; Kable, SH (2011). «Около порогового H / D обмена в фотодиссоциации CD 3 CHO». Химия природы . 3 (6): 443–8. Bibcode : 2011NatCh ... 3..443H . DOI : 10.1038 / nchem.1052 . PMID 21602858 .
- ^ Эндрюс, ДН; Хизлвуд, BR; MacCarone, AT; Conroy, T .; Payne, RJ; Иордания, MJT; Kable, SH (2012). "Фото-таутомеризация ацетальдегида до винилового спирта: потенциальный путь к тропосферным кислотам". Наука . 337 (6099): 1203–6. Bibcode : 2012Sci ... 337.1203A . DOI : 10.1126 / science.1220712 . PMID 22903524 .
- ^ Совин, TJ; Мелчер, Л. М. (2004) «Ацетальдегид» в Энциклопедии реагентов для органического синтеза (Эд: Л. Пакетт ), J. Wiley & Sons, Нью-Йорк. DOI : 10.1002 / 047084289X
- ^ Behrens, C .; Пакетт, Л.А. (1998). « N- Бензил-2,3-Азетидиндион (2,3-Азетидиндион, 1- (фенилметил) -)» . Органический синтез . 75 : 106. DOI : 10,15227 / orgsyn.075.0106 .; Сборник , 10 , стр. 41 год.
- Перейти ↑ Walter, LA (1943). «1- (α-Пиридил) -2-пропанол (2- (β-гидроксипропил) пиридин)» . Органический синтез . 23 : 83. DOI : 10,15227 / orgsyn.023.0083 .; Сборник , 3 , с. 757
- ^ Schurink, HBJ (1925). «Пентаэритритол» . Органический синтез . 4 : 53. DOI : 10,15227 / orgsyn.004.0053 .; Сборник , 1 , стр. 425
- ^ Кендалл, ЕС ; Маккензи, Б.Ф. (1929). « дл- Аланин» . Органический синтез . 9 : 4. DOI : 10,15227 / orgsyn.009.0004 .; Сборник , 1 , стр. 21 год
- ^ Виттиг, Г .; Гессе, А. (1970). «Направленная альдольная конденсация: β-фенилциннамальдегид (2-пропенал, 3,3-дифенил-)» . Органический синтез . 50 : 66. DOI : 10,15227 / orgsyn.050.0066 .; Коллективный том , 6 , с. 901
- ^ Франк, RL; Pilgrim, FJ; Ринер, EF (1950). «5-Этил-2-Метилпиридин (2-Пиколин, 5-этил-)» . Органический синтез . 30 : 41. DOI : 10,15227 / orgsyn.030.0041 .; Сборник , 4 , с. 451
- ^ Адкинс, Х .; Ниссен, BH (1923). «Ацеталь» . Органический синтез . 3 : 1. DOI : 10,15227 / orgsyn.003.0001 .; Сборник , 1 , стр. 1
- ^ Лавиния, М .; Георге, И. (2010). «Поли (винилфосфоновая кислота) и ее производные». Прогресс в науке о полимерах . 35 (8): 1078–1092. DOI : 10.1016 / j.progpolymsci.2010.04.001 .
- ^ a b Hipolito, L .; Санчес, MJ; Polache, A .; Гранеро, Л. (2007). «Мозговый метаболизм этанола и алкоголизм: обновление». Curr. Drug Metab . 8 (7): 716–727. DOI : 10.2174 / 138920007782109797 . PMID 17979660 .
- ^ «Ацетальдегид» . ihs.com.
- ^ Research and Markets ltd. «Ацетальдегид - Стратегический отчет глобального бизнеса» .
- ^ Цукамото, S; Муто, Т; Нагоя, Т; Шимамура, М; Сайто, М; Тайнака, H (1989). «Определение этанола, ацетальдегида и ацетата в крови и моче при окислении алкоголя у человека». Алкоголь и алкоголизм . 24 (2): 101–8. DOI : 10.1093 / oxfordjournals.alcalc.a044872 . PMID 2719768 .
- ^ Химическое резюме для ацетальдегида , Агентство по охране окружающей среды США
- ^ Научный комитет по косметическим и непродовольственным товарам (25 мая 2004 г.). «Заключение Научного комитета по косметическим продуктам и непродовольственным товарам, предназначенным для потребителей, относительно ацетальдегида» (PDF) . п. 11 . Проверено 28 сентября 2011 года .
- ^ Международное агентство по исследованию рака, Всемирная организация здравоохранения. (1988). Распитие алкоголя . Лион: Всемирная организация здравоохранения , Международное агентство по изучению рака . ISBN 978-92-832-1244-7. p3
- ^ Рабочая группа по монографии Международного агентства по исследованию рака, Специальный отчет: Политика Обзор канцерогенов для человека - Часть E: табак, орех арека, алкоголь, угольный дым и соленая рыба. Ланцет 2009 10, 1033–1034.
- ^ Ламберт, B; Он, С.М. (1988). «Повреждение ДНК и хромосом, вызванное ацетальдегидом в лимфоцитах человека in vitro». Летопись Нью-Йоркской академии наук . 534 (1): 369–76. Bibcode : 1988NYASA.534..369L . DOI : 10.1111 / j.1749-6632.1988.tb30124.x . PMID 3389666 .
- ^ Aberle, NS; Бурд, L; Zhao, BH; Рен, Дж (2004). «Вызванная ацетальдегидом сердечная сократительная дисфункция может быть облегчена витамином B1, но не витаминами B6 или B12» . Алкоголь и алкоголизм . 39 (5): 450–4. DOI : 10,1093 / alcalc / agh085 . PMID 15304379 .
- ^ Охта, S; Осава I; Камино К; И из; Симоката Х. (апрель 2004 г.). «Митохондриальный дефицит ALDH2 как окислительный стресс». Летопись Нью-Йоркской академии наук . 1011 (1): 36–44. Bibcode : 2004NYASA1011 ... 36о . DOI : 10.1196 / annals.1293.004 . PMID 15126281 .
- ^ Homann, N .; Stickel, F .; König, IR; Джейкобс, А .; Junghanns, K .; Бенесова, М .; Schuppan, D .; Himsel, S .; Zuber-Jerger, I .; Hellerbrand, C .; Ludwig, D .; Казельманн, WH; Зейтц, Гонконг (2006). «Аллель алкогольдегидрогеназы 1C * 1 является генетическим маркером связанного с алкоголем рака у сильно пьющих». Международный журнал рака . 118 (8): 1998–2002. DOI : 10.1002 / ijc.21583 . PMID 16287084 .
- ^ Спенглер, Джон Д .; Маккарти, Джон Ф .; Самет, Джонатан М. (2000). Справочник по качеству воздуха в помещении . Нью-Йорк, штат Нью-Йорк, США: McGraw-Hill Professional Publishing. п. 761 . ISBN 978-0074455494.
- ^ Дафни А. Миссия; Э. Деметриу; Н. Майкл; Е.И. Толис; Дж. Г. Барцис (2010). «Воздействие в помещении из строительных материалов: полевое исследование». Атмосферная среда . 44 (35): 4388–4395. Bibcode : 2010AtmEn..44.4388M . DOI : 10.1016 / j.atmosenv.2010.07.049 .
- ^ Клементс, AL; Jia, Y .; Денблейкер, А .; McDonald-Buller, E .; Фрейзер, депутат; Allen, DT; Коллинз, Д.Р .; Michel, E .; Pudota, J .; Sullivan, D .; Чжу, Ю. (2009). «Концентрации загрязнителей воздуха около трех автомагистралей Техаса, часть II: Химические характеристики и преобразование загрязнителей». Атмосферная среда . 43 (30): 4523–4534. Bibcode : 2009AtmEn..43.4523C . DOI : 10.1016 / j.atmosenv.2009.06.044 .
- ^ Talhout, R; Opperhuizen, A; ван Амстердам, JG (октябрь 2007 г.). «Роль ацетальдегида в зависимости от табачного дыма». Eur Neuropsychopharmacol . 17 (10): 627–36. DOI : 10.1016 / j.euroneuro.2007.02.013 . PMID 17382522 .
- ^ Talhout, Reinskje; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхёйзен, Антун (2011). «Опасные соединения в табачном дыме» . Международный журнал исследований окружающей среды и общественного здравоохранения . 8 (12): 613–628. DOI : 10.3390 / ijerph8020613 . ISSN 1660-4601 . PMC 3084482 . PMID 21556207 .
- ↑ «NIDA - Publications - NIDA Notes - Vol. 20, No. 3». Архивировано 25 августа 2009 г. в Wayback Machine . drugabuse.gov.
- ^ Исследование UCI показало, что никотин вызывает привыкание в сочетании с другими химическими веществами табачного дыма . Калифорнийский университет. 2004-10-28
- Перейти ↑ Singh, R (2009). «Оценка потенциала повреждения ДНК сигаретного дыма каннабиса путем определения аддуктов N2-этил-2'-дезоксигуанозина, производных ацетальдегида». Chem. Res. Toxicol . 22 (6): 1181–1188. DOI : 10.1021 / tx900106y . PMID 19449825 .
- ^ Salaspuro, М. (2009). «Ацетальдегид как общий знаменатель и кумулятивный канцероген при раке пищеварительного тракта». Скандинавский журнал гастроэнтерологии . 44 (8): 912–925. DOI : 10.1080 / 00365520902912563 . PMID 19396661 .
- ^ МНЕНИЕ Научного комитета по безопасности потребителей SCCS ПО Ацетальдегиду . Европейская комиссия. 18 сентября 2012 г.
- ^ Дорнат, Пол Джон (2010). "Анализ химического выщелачивания из обычных потребительских пластиковых бутылок в условиях высоких напряжений" (PDF) . п. 32. Архивировано из оригинального (PDF) 26 февраля 2015 года . Проверено 26 февраля 2015 года .
- ^ «Приводят ли ацетальдегид и формальдегид из бутылок для домашних животных к неприемлемому привкусу или аромату воды в бутылках?» (PDF) . Ассоциация смол ПЭТ . Проверено 26 февраля 2015 года .
- ^ Gainza-Cirauqui, ML; Nieminen, MT; Novak Frazer, L .; Aguirre-Urizar, JM; Мораг, доктор медицины; Раутемаа Р. (март 2013 г.). «Производство канцерогенного ацетальдегида Candida albicans у пациентов с потенциально злокачественными поражениями слизистой оболочки полости рта». Журнал оральной патологии и медицины . 42 (3): 243–249. DOI : 10.1111 / j.1600-0714.2012.01203.x . PMID 22909057 .
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме ацетальдегида . |
- Международная карта химической безопасности 0009
- Карманный справочник NIOSH по химической опасности
- Методы отбора проб и анализа
- Монография МАИР: «Ацетальдегид»
- Хэл Кибби, Генетическое влияние на употребление алкоголя и алкоголизм , Исследования и творческая деятельность Университета Индианы, Vol. 17 нет. 3.
- Информация Управления по контролю за продуктами и лекарствами США (FDA) для ацетальдегида
- Технологическая схема производства ацетальдегида методом окисления этилена