| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Ацетонитрил [2] | |||
| Систематическое название ИЮПАК Этаннитрил [2] | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель ( JSmol ) | |||
| 741857 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.760 | ||
| Номер ЕС |
| ||
| 895 | |||
| MeSH | ацетонитрил | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1648 | ||
CompTox Dashboard ( EPA ) | |||
| |||
| |||
| Характеристики | |||
| C 2 H 3 N | |||
| Молярная масса | 41,053 г · моль -1 | ||
| Внешность | Бесцветная жидкость | ||
| Запах | Слабый, отчетливый, фруктовый | ||
| Плотность | 0,776 г / см 3 при 25 ° C | ||
| Температура плавления | От -46 до -44 ° С; От -51 до -47 ° F; От 227 до 229 К | ||
| Точка кипения | От 81,3 до 82,1 ° С; От 178,2 до 179,7 ° F; От 354,4 до 355,2 К | ||
Растворимость в воде | Смешиваемый | ||
| журнал P | -0,334 | ||
| Давление газа | 9,71 кПа (при 20,0 ° C) | ||
Константа закона Генри ( k H ) | 530 мкмоль / (Па · кг) | ||
| Кислотность (p K a ) | 25 | ||
| УФ-видимый (λ макс. ) | 195 нм | ||
| Абсорбция | ≤0,10 | ||
Магнитная восприимчивость (χ) | −28,0 × 10 −6 см 3 / моль | ||
Показатель преломления ( n D ) | 1,344 | ||
| Термохимия | |||
Теплоемкость ( C ) | 91,69 Дж / (К · моль) | ||
Стандартная мольная энтропия ( S | 149,62 Дж / (К · моль) | ||
Std энтальпия формации (Δ F H ⦵ 298 ) | 40,16–40,96 кДж / моль | ||
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | −1256,03 - −1256,63 кДж / моль | ||
| Опасности | |||
| Паспорт безопасности | См .: страницу данных | ||
| Пиктограммы GHS | |||
| Сигнальное слово GHS | Опасность | ||
Формулировки опасности GHS | H225 , H302 , H312 , H319 , H332 | ||
Меры предосторожности GHS | P210 , P280 , P305 + 351 + 338 | ||
| NFPA 704 (огненный алмаз) |  3 2 0 | ||
| точка возгорания | 2,0 ° С (35,6 ° F, 275,1 К) | ||
самовоспламенения температуру | 523,0 ° С (973,4 ° F, 796,1 К) | ||
| Пределы взрываемости | 4,4–16,0% | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD 50 ( средняя доза ) |
| ||
ЛК 50 ( средняя концентрация ) | 5655 частей на миллион (морская свинка, 4 часа) 2828 частей на миллион (кролик, 4 часа) 53000 частей на миллион (крыса, 30 минут) 7500 частей на миллион (крыса, 8 часов) 2693 частей на миллион (мышь, 1 час) [4] | ||
LC Lo ( самый низкий опубликованный ) | 16 000 частей на миллион (собака, 4 часа) [4] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 40 частей на миллион (70 мг / м 3 ) [3] | ||
REL (рекомендуется) | TWA 20 частей на миллион (34 мг / м 3 ) [3] | ||
IDLH (Непосредственная опасность) | 500 частей на миллион [3] | ||
| Родственные соединения | |||
Родственные алканнитрилы |
| ||
Родственные соединения | DBNPA | ||
| Страница дополнительных данных | |||
Структура и свойства | Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. | ||
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ | ||
Спектральные данные | УФ , ИК , ЯМР , МС | ||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
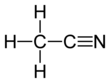
Ацетонитрил , часто сокращенно MeCN ( метилцианид ), представляет собой химическое соединение с формулой CH
3CN . Эта бесцветная жидкость представляет собой простейший органический нитрил ( цианистый водород - более простой нитрил, но цианид- анион не классифицируется как органический ). Он производится в основном как побочный продукт производства акрилонитрила . Он используется как полярный апротонный растворитель в органическом синтезе и при очистке бутадиена . [5] Каркас N≡C-C является линейным с коротким расстоянием C≡N 1,16 Å . [6]
Впервые ацетонитрил был получен в 1847 году французским химиком Жаном-Батистом Дюма . [7]
Приложения [ править ]
Ацетонитрил используется в основном в качестве растворителя при очистке бутадиена на нефтеперерабатывающих заводах. В частности, ацетонитрил подается в верхнюю часть дистилляционной колонны, заполненной углеводородами, включая бутадиен, и когда ацетонитрил падает через колонну, он поглощает бутадиен, который затем направляется из нижней части колонны во вторую разделительную башню. Затем в разделительной башне используется тепло для отделения бутадиена.
В лаборатории он используется в качестве растворителя средней полярности, который смешивается с водой и рядом органических растворителей, но не с насыщенными углеводородами. Он имеет удобный диапазон жидкостей и высокую диэлектрическую проницаемость 38,8. С дипольного момента от 3,92 D , [8] ацетонитрил растворяется в широком диапазоне ионных и неполярных соединений и является полезным в качестве подвижной фазы в ВЭЖХ и ЖХ-МС .
Он широко используется в аккумуляторных батареях из-за своей относительно высокой диэлектрической проницаемости и способности растворять электролиты . По тем же причинам это популярный растворитель в циклической вольтамперометрии .
Его ультрафиолетовая прозрачность Защита от ультрафиолетового излучения , низкая вязкость и низкая химическая реактивность делают его популярным выбором для высокоэффективной жидкостной хроматографии (ВЭЖХ).
Ацетонитрил играет важную роль в качестве основного растворителя, используемого при производстве олигонуклеотидов ДНК из мономеров .
В промышленности он используется в качестве растворителя для производства фармацевтических препаратов и фотопленки . [9]
Органический синтез [ править ]
Ацетонитрил является обычным двухуглеродным строительным блоком в органическом синтезе [10] многих полезных химических веществ, включая гидрохлорид ацетамидина, тиамин и α-нафталинуксусную кислоту. [11] Его реакция с хлоридом цианогена дает малононитрил . [5]
Как донор электронной пары [ править ]
Ацетонитрил имеет свободную электронную пару у атома азота, которая может образовывать многие нитрильные комплексы переходных металлов . Являясь слабоосновным, это легко замещаемый лиганд . Например, дихлорид бис (ацетонитрил) палладия получают нагреванием суспензии хлорида палладия в ацетонитриле: [12]
- PdCl
2+ 2 канала
3CN → PdCl
2(CH
3CN)
2
Родственный комплекс - [Cu (CH 3 CN) 4 ] + . СН
3Группы CN в этих комплексах быстро замещаются многими другими лигандами.
Он также образует аддукты Льюиса с кислотами Льюиса 13 группы , такими как трифторид бора . [13] В суперкислотах можно протонировать ацетонитрил. [14]
Производство [ править ]
Ацетонитрил - это побочный продукт при производстве акрилонитрила . Большая часть сжигается для поддержки запланированного процесса, но, по оценкам, для вышеупомянутых применений остается несколько тысяч тонн. [15] Таким образом, тенденции производства ацетонитрила в целом соответствуют тенденциям производства акрилонитрила . Ацетонитрил также можно получить многими другими способами, но они не имеют коммерческого значения по состоянию на 2002 год. Иллюстративные способы - дегидратация ацетамида или гидрирование смесей монооксида углерода и аммиака . [16] В 1992 [Обновить]году в США было произведено 14 700 тонн (32 400 000 фунтов) ацетонитрила.
Каталитический аммокисление из этилена также исследовали. [17]
Дефицит ацетонитрила в 2008–2009 гг. [ Править ]
Начиная с октября 2008 года мировые поставки ацетонитрила были низкими, поскольку китайское производство было остановлено в связи с Олимпийскими играми . Кроме того, во время урагана Айк в Техасе был поврежден завод в США . [18] Из-за глобального экономического спада производство акрилонитрила, который используется в акриловых волокнах и акрилонитрилбутадиенстирольных (АБС) смолах, сократилось. Ацетонитрил является побочным продуктом при производстве акрилонитрила, и его производство также снизилось, что еще больше усугубляет нехватку ацетонитрила. [19] Глобальный дефицит ацетонитрила сохранялся до начала 2009 года. [ Требуется обновление ]
Безопасность [ править ]
Токсичность [ править ]
Ацетонитрил имеет умеренную токсичность в малых дозах. [11] [20] Он может метаболизироваться с образованием цианистого водорода , который является источником наблюдаемых токсических эффектов. [9] [21] [22] Как правило, токсические эффекты проявляются с задержкой из-за времени, необходимого организму для превращения ацетонитрила в цианид (обычно около 2–12 часов). [11]
Случаи отравления человека ацетонитрилом (или, если быть более конкретным, отравления цианидом после воздействия ацетонитрила) редки, но не известны, в результате вдыхания, проглатывания и (возможно) через кожное проникновение. [21] Симптомы, которые обычно не проявляются в течение нескольких часов после воздействия, включают затрудненное дыхание, медленный пульс , тошноту и рвоту. В серьезных случаях могут возникнуть судороги и кома , за которыми следует смерть от дыхательной недостаточности . Лечение за отравления цианидом , с кислородом , нитрита натрия и тиосульфата натриясреди наиболее часто используемых средств неотложной помощи. [21]
Он использовался в составах для жидкости для снятия лака , несмотря на его токсичность. Сообщалось как минимум о двух случаях случайного отравления маленьких детей жидкостью для снятия лака на основе ацетонитрила, один из которых закончился летальным исходом. [23] Ацетон и этилацетат часто являются более безопасными для домашнего использования, а ацетонитрил был запрещен в косметических продуктах в Европейской экономической зоне с марта 2000 года. [24]
Метаболизм и выведение [ править ]
| Сложный | Цианид, концентрация в головном мозге (мкг / кг) | Пероральный LD 50 (мг / кг) |
|---|---|---|
| Цианистый калий | 748 ± 200 | 10 |
| Пропионитрил | 508 ± 84 | 40 |
| Бутиронитрил | 437 ± 106 | 50 |
| Малононитрил | 649 ± 209 | 60 |
| Акрилонитрил | 395 ± 106 | 90 |
| Ацетонитрил | 28 ± 5 | 2460 |
| Поваренная соль (NaCl) | Нет данных | 3000 |
| Концентрации ионного цианида, измеренные в мозге крыс Sprague-Dawley через один час после перорального введения LD 50 различных нитрилов. [25] | ||
Как и другие нитрилы , ацетонитрил может метаболизироваться в микросомах , особенно в печени, с образованием цианистого водорода , как впервые было показано Pozzani et al. в 1959 г. [26] Первый шаг в этом пути является окисление ацетонитрило до гликонитрил А. Н. НАДФН -зависимый цитохром Р450 монооксигеназного . Затем гликолонитрил самопроизвольно разлагается с образованием цианистого водорода и формальдегида . [20] [21] Формальдегид, сам по себе токсин и канцероген, дополнительно окисляется до муравьиной кислоты., что является еще одним источником токсичности.
Метаболизм ацетонитрила намного медленнее, чем у других нитрилов, что объясняет его относительно низкую токсичность. Следовательно, через один час после введения потенциально смертельной дозы, концентрация цианида в головном мозге крыс была 1 / 20 , что для пропионитрили дозу в 60 раз ниже (смотрите таблицу). [25]
Относительно медленный метаболизм ацетонитрила в цианистый водород позволяет большему количеству производимого цианида детоксифицировать в организме до тиоцианата ( путь роданезы ). Это также позволяет вывести больше ацетонитрила в неизмененном виде до того, как он метаболизируется. Основные пути выведения - через выдох и с мочой. [20] [21] [22]
См. Также [ править ]
- Трихлорацетонитрил - производное ацетонитрила, используемое для защиты спиртовых групп , а также используемое в качестве реагента в перегруппировке Овермана.
Ссылки [ править ]
- ^ a b c d "Паспорт безопасности материала" (PDF) .
- ^ a b Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 902. DOI : 10.1039 / 9781849733069-FP001 . ISBN 978-0-85404-182-4.
- ^ a b c Карманный справочник NIOSH по химической опасности. «# 0006» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b «Ацетонитрил» . Немедленно опасные для жизни или здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b «Архивная копия» (PDF) . Словарь промышленных химикатов Эшфорда, третье издание . п. 76. Архивировано из оригинального (PDF) 16 мая 2011 года . Проверено 31 марта 2011 . CS1 maint: заархивированная копия как заголовок ( ссылка )
- ^ Karakida, Ken'ichi; Фукуяма, Цутому; Кучицу, Козо (1974). "Молекулярные структуры цианида водорода и ацетонитрила по данным газовой электронной дифракции" . Бюллетень химического общества Японии . 47 (2): 299–304. DOI : 10.1246 / bcsj.47.299 .
- ^ Дюма, Ж.-Б. (1847). «Действие безводной фосфорной кислоты на солях аммония». Comptes rendus . 25 : 383–384.
- ^ Штайнер, П. А .; Горди, В. (1966). «Журнал молекулярной спектроскопии» . 21 : 291. Цитировать журнал требует
|journal=( помощь ) - ^ a b Министерство здравоохранения Испании (2002 г.), Ацетонитрил. Сводный отчет об оценке рисков (PDF) , Ispra (VA), Италия : Европейское химическое бюро , специальная публикация I.01.65, заархивировано из оригинала (PDF) 17 декабря 2008 г.
- ^ DiBiase, S. A .; Beadle, J. R .; Гокель, Г. В. "Синтез α, β-ненасыщенных нитрилов из ацетонитрила: циклогексилиденацетонитрила и циннамонитрила" . Органический синтез .; Сборник , 7 , с. 108
- ^ a b c Филип Векслер, изд. (2005), Энциклопедия токсикологии , Vol. 1 (2-е изд.), Elsevier, стр. 28–30, ISBN 0-12-745354-7
- ^ Jürgen-Хайнрих., Fuhrhop (2003). Органический синтез: понятия и методы . Ли, Гуантао, доктор (3-е, полностью перераб. И дополн. Ред.). Вайнхайм: Wiley-VCH. п. 26. ISBN 9783527302727. OCLC 51068223 .
- ^ B. Swanson, DF Shriver, JA Ibers, "Природа донорно-акцепторной связи в тригалогенидах ацетонитрил-бор. Структуры комплексов трифторида бора и трихлорида бора ацетонитрила", Inorg. Chem., 2969., volume 8, pp. 2182-2189, {{doi: 10.1021 / ic50080a032}}
- ^ Хейгес, Ральф; Бакстер, Аманда Ф .; Goetz, Nadine R .; Axhausen, Joachim A .; Солтнер, Тереза; Корнат, Андреас; Кристе, Калр О. (2016). «Протонирование нитрилов: выделение и характеристика алкил- и арилнитрилиевых ионов». Сделки Далтона . 45 (20): 8494–8499. DOI : 10.1039 / C6DT01301E . PMID 27116374 .
- ^ Поллак, Питер; Ромедер, Жерар; Хагедорн, Фердинанд; Гелбке, Хайнц-Петер. «Нитрилы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a17_363 .
- ^ США 4179462 , оливковое, G. & Olive, S., "Способ получения ацетонитрила", опубликованной 1979-12-18, присвоен компании Monsanto
- ^ Rhimi, B .; Mhamdi, M .; Ghorbel, A .; Narayana Kalevaru, V .; Мартин, А .; Perez-Cadenas, M .; Герреро-Руис, А. (15 мая 2016 г.). «Аммоксидирование этилена до ацетонитрила над цеолитными катализаторами, нанесенными на ванадий и молибден, полученные твердотельным ионным обменом». Журнал молекулярного катализа A: Химический . 416 : 127–139. DOI : 10.1016 / j.molcata.2016.02.028 .
- ^ Лоу, Дерек (2009). «Великая нехватка ацетонитрила» . Трансляционная медицина науки .
- ^ А. Tullo (2008). «Высыхает растворитель». Новости химии и техники . 86 (47): 27. DOI : 10.1021 / Сеп-v086n047.p027 .
- ^ a b c Национальный институт исследований и безопасности (INRS) (2004 г.), Fichexicologique no. 104: Ацетонитрил (PDF) , Париж: INRS , ISBN 2-7389-1278-8, заархивировано из оригинального (PDF) 28 июля 2011 г. , получено 19 августа 2008 г.
- ^ a b c d e Международная программа по химической безопасности (1993), Критерии гигиены окружающей среды 154. Ацетонитрил , Женева: Всемирная организация здравоохранения
- ^ a b Гринберг, Марк (1999), Токсикологический обзор ацетонитрила (PDF) , Вашингтон, округ Колумбия: Агентство по охране окружающей среды США
- ^ Caravati, EM; Литовиц, Т. (1988). «Отравление цианидом у детей и смерть от ацетонитрилсодержащего косметического средства». Варенье. Med. Доц. 260 (23): 3470–73. DOI : 10,1001 / jama.260.23.3470 . PMID 3062198 .
- ^ «Двадцать пятая Директива Комиссии 2000/11 / EC от 10 марта 2000 г., адаптирующая к техническому прогрессу Приложение II к Директиве Совета 76/768 / EEC о сближении законов государств-членов, касающихся косметических продуктов» . Официальный журнал Европейских сообществ . L65 : 22–25. 2000-03-14.
- ^ а б Ахмед, А. Э .; Фаруки, М. Ю. Х. (1982), "Сравнительная токсичность алифатических нитрилов", Toxicol. Lett. , 12 (2-3): 157-64, DOI : 10,1016 / 0378-4274 (82) 90179-5 , PMID 6287676
- ^ Поццани, U. C .; Carpenter, C.P .; Palm, P.E .; Weil, C. S .; Наир, Дж. Х. (1959), "Исследование токсичности ацетонитрила для млекопитающих", J. Occup. Med. , 1 (12): 634-642, DOI : 10,1097 / 00043764-195912000-00003 , PMID 14434606
Внешние ссылки [ править ]
- Страница веб-книги для C 2 H 3 N
- Международная карта химической безопасности 0088
- Национальный реестр загрязнителей - информационный бюллетень по ацетонитрилу
- Карманный справочник NIOSH по химической опасности
- Резюме по химическому составу ацетонитрила (CAS № 75-05-8) , Управление по предотвращению загрязнения и токсичности, Агентство по охране окружающей среды США
- Моделирование ацетонитрила
- Как органическое вещество попало на Землю? Космические детективы отслеживают происхождение сложных органических молекул , на: SciTechDaily. 10 сентября 2020 г. Источник: Токийский университет науки: ацетонитрил обнаружен в молекулярном облаке Sgr B2 (M) в центре нашей галактики .