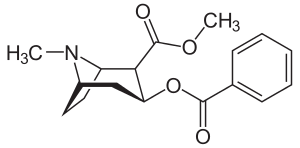
Биосинтез кокаина уже давно привлекает к себе внимание биохимиков и органической химии. Этот интерес частично мотивирован сильными физиологическими эффектами кокаина, но еще одним стимулом была необычная бициклическая структура молекулы. Биосинтез можно рассматривать как протекающий в две фазы, одна фаза приводит к N-метилпирролиниевому кольцу, которое сохраняется в конечном продукте. Вторая фаза включает блок С4 с образованием бициклического тропанового ядра. [1]
Биосинтез катиона N -метил-пирролиния [ править ]
Биосинтез начинается с L - глутамин , который является производным от L - орнитин в растениях. Эдвард Лите подтвердил роль L-орнитина и L- аргинина . [2] Орнитин затем подвергается PLP- зависимому декарбоксилированию с образованием путресцина . У животных, однако, цикл мочевины образует путресцин из орнитина. L-орнитин превращается в L-аргинин [3], который затем декарбоксилируется через PLP с образованием агматина . Гидролиз из имина вытекает N-карбамоилпутресцин с последующим гидролизом мочевины с образованием путресцина. Раздельные пути превращения орнитина в путресцин у растений и животных сошлись воедино. САМ -зависимой Н -methylation путресцина дает N -methylputrescine, который затем подвергается окислительное дезаминирование под действием диаминоксидазы с получением аминоальдегида, который спонтанно циклизации до N - метил-Δ 1 -pyrrolinium катиона.

Помимо роли в кокаине, катион N- метил-пирролиния является предшественником никотина , гигрина , кускогигрина и других природных продуктов. [1]
Превращение катиона N- метил-пирролиния в тропан [ править ]
Дополнительные атомы углерода, необходимые для синтеза кокаина, получают из ацетил-КоА путем добавления двух звеньев ацетил-КоА к катиону N- метил-Δ 1- пирролиния. [4] Первое присоединение представляет собой реакцию типа Манниха с енолят-анионом из ацетил-КоА, действующим как нуклеофил по отношению к катиону пирролиния. Второе добавление происходит за счет конденсации Клайзена. Это дает рацемическую смесь 2-замещенного пирролидина с сохранением тиоэфира от конденсации Клайзена. При образовании тропинона из рацемического этил [2,3-13С2] 4 (N-метил-2-пирролидинил) -3-оксобутаноата предпочтение ни одному из стереоизомеров не отдается.[5] Однако при биосинтезе кокаина только (S) -энантиомер может циклизоваться с образованием тропановой кольцевой системы кокаина. Стереоселективность этой реакции дополнительно исследовали путем изучения прохиральной дискриминации метиленового водорода. [6] Это связано с дополнительным хиральным центром в C-2. [7] Этот процесс происходит в результате окисления, которое регенерирует катион пирролиния и образования енолят-аниона, а также внутримолекулярной реакции Манниха. Система тропановых колец подвергается гидролизу , SAM-зависимому метилированию и восстановлению с помощью НАДФН с образованием метилэкгонина. Бензоил фрагмент необходим для формирования диэфира кокаина синтезируют изфенилаланин через коричную кислоту . [8] Бензоил-КоА затем объединяет две единицы с образованием кокаина.
Химический синтез [ править ]
О синтезе и выяснении структуры кокаина сообщил Ричард Вильштеттер в 1898 году. [9] Синтез Вильштеттера получил кокаин из тропинона . Роберт Робинсон и Эдвард Лите также внесли значительный вклад. [10]
Ссылки [ править ]
- ^ a b Leete, Эдвард (1990). «Последние разработки в области биосинтеза тропановых алкалоидов1» . Planta Medica . 56 (4): 339–352. DOI : 10,1055 / с-2006-960979 . PMID 2236285 .
- ^ Лит Е, Marion L, Sspenser ID (октябрь 1954). «Биогенез гиосциамина». Природа . 174 (4431): 650–1. Bibcode : 1954Natur.174..650L . DOI : 10.1038 / 174650a0 . PMID 13203600 .
- ^ Робинс, Ричард; Уолтонс, Николас; Хэмилл, Джон; Парр, Адриан; Родос, Майкл (1991). «Стратегии генетической манипуляции с путями продуцирования алкалоидов в растениях». Planta Medica . 57 (7 приложение): S27 – S35. DOI : 10,1055 / с-2006-960226 . PMID 17226220 .
- ^ Dewick, PM (2009). Лекарственные натуральные продукты . Честер: Вили-Блэквелл. ISBN 978-0-470-74276-1.
- ^ RJ Робинс; Т.В. Авраам; AJ Parr; Дж. Иглз; Н. Дж. Уолтон (1997). «Биосинтез тропановых алкалоидов в Datura stramonium: идентичность промежуточных соединений между солью N- метилпирролиния и тропиноном». Варенье. Chem. Soc . 119 (45): 10929. DOI : 10.1021 / ja964461p .
- ^ Хойя TR, Бьорклунд JA, Колтун DO, Реннер MK (январь 2000). « Окисление N- метилпутресцина при биосинтезе кокаина: исследование прохиральной дискриминации метиленового водорода с использованием метода удаленных изотопов». Орг. Lett . 2 (1): 3–5. DOI : 10.1021 / ol990940s . PMID 10814231 .
- ^ Э. Лите; JA Bjorklund; MM Couladis и SH Kim (1991). «Поздние промежуточные продукты в биосинтезе кокаина: 4- (1-метил-2-пирролидинил) -3-оксобутаноат и метилэкгонин». Варенье. Chem. Soc . 113 (24): 9286. DOI : 10.1021 / ja00024a039 .
- ^ Э. Лите; JA Bjorklund и SH Kim (1988). «Биосинтез бензоильной части кокаина». Фитохимия . 27 (8): 2553. DOI : 10,1016 / 0031-9422 (88) 87026-2 .
- ^ Хамфри AJ, О'Хаган D (октябрь 2001). «Биосинтез тропановых алкалоидов. Нерешенная вековая проблема». Nat Prod Rep . 18 (5): 494–502. DOI : 10.1039 / b001713m . PMID 11699882 .
- ^ Т. Хемшайдт; Ведерас, Джон К. (2000). Липер, Финиан Дж .; Ведерас, Джон К. (ред.). «Тропан и родственные алкалоиды». Верхний. Curr. Chem . Темы современной химии. 209 : 175. DOI : 10.1007 / 3-540-48146-X . ISBN 978-3-540-66573-1.