 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гидрат ацетата хрома (II) | |
| Другие названия ацетат хрома, диацетат хрома, этаноат хрома (II) | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.224.848 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 8 H 16 Cr 2 O 10 | |
| Молярная масса | 376,198 г · моль -1 |
| Появление | кирпично-красный массив |
| Плотность | 1,79 г / см 3 |
| Температура плавления | обезвоживает |
| растворим в горячей воде, MeOH | |
| -5104,0 · 10 −6 см 3 / моль | |
| Состав | |
| моноклинический | |
| октаэдрической с учетом связи Cr – Cr | |
| четырехкратная связь Cr – Cr | |
| 0 Д | |
| Опасности | |
| Основные опасности | может экзотермически реагировать на воздухе |
| Родственные соединения | |
Родственные соединения | Rh 2 (OAc) 4 (H 2 O) 2 Cu 2 (OAc) 4 (H 2 O) 2 , ацетат молибдена (II) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
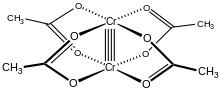
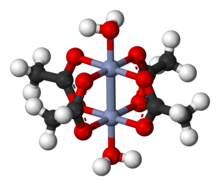
Гидрат ацетата хрома (II) , также известный как ацетат хрома , является координационным соединением с формулой Cr 2 (CH 3 CO 2 ) 4 (H 2 O) 2 . Эта формула обычно обозначается сокращением Cr 2 (OAc) 4 (H 2 O) 2 . Это соединение красного цвета имеет четверную связь . Приготовление ацетата хрома когда-то было стандартным тестом синтетических навыков студентов из-за его чувствительности к воздуху и резких изменений цвета, сопровождающих его окисление. Он существует какдигидрат и безводные формы.
Cr 2 (OAc) 4 (H 2 O) 2 представляет собой красноватый диамагнитный порошок, хотя можно выращивать таблитчатые кристаллы в форме ромба . В соответствии с тем фактом, что Cr 2 (OAc) 4 (H 2 O) 2 не является ионным , он плохо растворим в воде и метаноле .
Структура [ править ]
Молекула Cr 2 (OAc) 4 (H 2 O) 2 содержит два атома хрома , две лигированные молекулы воды и четыре мостиковых ацетатных лиганда . Координационная среда вокруг каждого атома хрома состоит из четырех атомов кислорода (по одному от каждого ацетатного лиганда) в квадрате, одной молекулы воды (в осевом положении) и другого атома хрома (напротив молекулы воды), что дает каждому центру хрома октаэдрическая геометрия . Атомы хрома соединены четверной связью, и молекула имеет D 4hсимметрия (без учета положения атомов водорода). Такую же базовую структуру имеют Rh 2 (OAc) 4 (H 2 O) 2 и Cu 2 (OAc) 4 (H 2 O) 2 , хотя эти частицы не имеют таких коротких контактов M – M. [1]
Четверная связь между двумя атомами хрома возникает из-за перекрытия четырех d-орбиталей на каждом металле с теми же орбиталями на другом металле: орбитали d z 2 перекрываются, образуя компонент сигма-связи , орбитали d xz и d yz перекрываются. чтобы дать два компонента связи пи , а орбитали d xy образуют дельта-связь . Эта четверная связь подтверждается также низким магнитным моментом и коротким межмолекулярным расстоянием между двумя атомами 236,2 ± 0,1 пм.. Расстояния Cr – Cr еще меньше - 184 пм - это рекорд, когда аксиальный лиганд отсутствует или карбоксилат заменен изоэлектронными азотистыми лигандами. [2]
История [ править ]
Эжен-Мельхиор Пелиго впервые сообщил об ацетате хрома (II) в 1844 году. Его материалом, по-видимому, был димерный Cr 2 (OAc) 4 (H 2 O) 2 . [3] [4] Необычная структура, как и у ацетата меди (II) , была открыта в 1951 году. [5]
Подготовка [ править ]
Приготовление обычно начинается с восстановления водного раствора соединения Cr (III) с использованием цинка . [6] Полученный синий раствор обрабатывают ацетатом натрия , что приводит к быстрому осаждению ацетата хрома в виде ярко-красного порошка.
- 2 Cr 3+ + Zn → 2 Cr 2+ + Zn 2+
- 2 Cr 2+ + 4 OAc - + 2 H 2 O → Cr 2 (OAc) 4 (H 2 O) 2
Синтез Cr 2 (OAc) 4 (H 2 O) 2 традиционно использовался для проверки синтетических навыков и терпения студентов, изучающих неорганические лаборатории в университетах, поскольку случайное попадание небольшого количества воздуха в устройство легко указывается на обесцвечивание продукта ярко-красного цвета. [7] Безводная форма ацетата хрома (II), а также родственные карбоксилаты хрома (II) могут быть получены из хромоцена :
- 4 RCO 2 H + 2 Cr (C 5 H 5 ) 2 → Cr 2 (O 2 CR) 4 + 4 C 5 H 6
Этот метод позволяет легко получить безводные производные. [8]
Поскольку Cr 2 (OAc) 4 (H 2 O) 2 очень легко приготовить, он является исходным материалом для других соединений хрома (II). Кроме того, многие аналоги были получены с использованием других карбоновых кислот вместо ацетата и с использованием других оснований вместо воды.
Приложения [ править ]
Ацетат хрома (II) имеет несколько практических применений. Он использовался для дегалогенирования органических соединений, таких как α-бромкетоны и хлоргидрины . [9] Реакции, по-видимому, проходят через 1e - стадии, и иногда наблюдаются продукты перегруппировки.
Поскольку соединение является хорошим восстановителем, оно снижает содержание O 2 в воздухе и может использоваться в качестве скруббера для кислорода.
См. Также [ править ]
- Хром (III) ацетат
- Гидроксид хрома ацетата
Ссылки [ править ]
- ^ Хлопок, FA ; Уолтон, РА (1993). Множественные связи между атомами металлов . Оксфорд: Издательство Оксфордского университета. ISBN 0-19-855649-7. CS1 maint: обескураженный параметр ( ссылка )
- ^ Хлопок, FA ; Хиллард, EA; Мурильо, Калифорния; Чжоу, Х.-К. (2000). "Спустя 155 лет кристаллический карбоксилат хрома со сверхкороткой связью Cr – Cr". Варенье. Chem. Soc. 122 (2): 416–417. DOI : 10.1021 / ja993755i . CS1 maint: обескураженный параметр ( ссылка )
- ^ Пелиго, Э.-М. (1844 г.). «Sur un nouvelxide de chrome» [О новом оксиде хрома]. CR Acad. Sci. (На французском). 19 : 609–618. CS1 maint: обескураженный параметр ( ссылка )
- ^ Пелиго, Э.-М. (1844 г.). "Recherches sur le chrome" [Исследования хрома]. Аня. Чим. Phys. (На французском). 12 : 527–548. CS1 maint: обескураженный параметр ( ссылка )
- ^ Ван Никерк, JN; Шенинг, FRL (1953). «Рентгеновские доказательства связи металл-металл в ацетате меди и хрома». Природа . 171 (4340): 36–37. DOI : 10.1038 / 171036a0 .
- ^ Ocone, LR; Блок, Б.П. (1966). «Безводный ацетат хрома (II), 1-гидрат ацетата хрома (II) и бис (2,4-пентандионато) хром (II)». Неорг. Synth. 8 : 125–129. DOI : 10.1002 / 9780470132395.ch33 . ISBN 978-0-470-13239-5.
- Перейти ↑ Jolly, WL (1970). Синтез и характеристика неорганических соединений . Прентис Холл. С. 442–445 .
- ^ Beneš, L .; Kalousová, J .; Вотинский, J. (1985). «Реакция хромоцена с карбоновыми кислотами и некоторыми производными уксусной кислоты». J. Organomet. Chem. 290 : 147–151. DOI : 10.1016 / 0022-328X (85) 87428-3 .
- ^ Рэй, Т. (2004). «Ацетат хрома (II)». В пакете, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк, штат Нью-Йорк: J. Wiley & Sons. DOI : 10.1002 / 047084289X . ЛВП : 10261/236866 .
Дальнейшее чтение [ править ]
- Райс, Стивен Ф .; Уилсон, Рэндалл Б.; Соломон, Эдвард I. (1980). «Электронный спектр поглощения хромового дигидрата ацетата и родственных биядерных хромовых карбоксилатов». Неорг. Chem. 19 (11): 3425–3431. DOI : 10.1021 / ic50213a042 . CS1 maint: обескураженный параметр ( ссылка )
Внешние ссылки [ править ]
| Викискладе есть медиафайлы, связанные с ацетатом хрома (II) . |
- http://www.molecules.org/coordcpds.html#Cr2OAc4H2O
- http://alpha.chem.umb.edu/chemistry/ch370/documents/CH371chromiumacetate06.pdf [ постоянная мертвая ссылка ] (устарело)
- http://wwwchem.uwimona.edu.jm/courses/chromium.pdf
| AcOH | Он | |||||||||||||||||||
| LiOAc | Be (OAc) 2 BeAcOH | B (OAc) 3 | AcOAc ROAc | NH 4 OAc | AcOOH | FAc | Ne | |||||||||||||
| NaOAc | Mg (OAc) 2 | Al (OAc) 3 АЛСОЛ Al (OAc) 2 OH Al 2 SO 4 (OAc) 4 | Si | п | S | ClAc | Ar | |||||||||||||
| KOAc | Ca (OAc) 2 | Sc (OAc) 3 | Ti (OAc) 4 | VO (OAc) 3 | Cr (OAc) 2 Cr (OAc) 3 | Mn (OAc) 2 Mn (OAc) 3 | Fe (OAc) 2 Fe (OAc) 3 | Co (OAc) 2 | Ni (OAc) 2 | Cu (OAc) 2 | Zn (OAc) 2 | Ga (OAc) 3 | Ge | As (OAc) 3 | Se | BrAc | Kr | |||
| RbOAc | Sr (OAc) 2 | Y (OAc) 3 | Zr (OAc) 4 | Nb | Мо (OAc) 2 | Tc | Ru 2 (OAc) 4 Cl Ru (OAc) 3 | Rh 2 (OAc) 4 | Pd (OAc) 2 | AgOAc | Cd (OAc) 2 | В | Sn (OAc) 2 Sn (OAc) 4 | Sb (OAc) 3 | Te | IAc | Xe | |||
| CsOAc | Ba (OAc) 2 | * | Лу (OAc) 3 | Hf | Та | W | Re | Операционные системы | Ir | Pt (OAc) 2 | Au | Hg 2 (OAc) 2 , Hg (OAc) 2 | TlOAc Tl (OAc) 3 | Pb (OAc) 2 Pb (OAc) 4 | Bi (OAc) 3 | По | В | Rn | ||
| Пт | Ра | ** | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Ур. | Ц | Og | ||
| * | La (OAc) 3 | Ce (OAc) x | Pr | Nd | Вечера | Sm (OAc) 3 | Eu (OAc) 3 | Gd (OAc) 3 | Tb | Dy (OAc) 3 | Хо (OAc) 3 | Э | Тм | Yb (OAc) 3 | ||||||
| ** | Ac | Чт | Па | UO 2 (OAc) 2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | ||||||