| Клейзеновская конденсация | |
|---|---|
| Названный в честь | Райнер Людвиг Клайзен |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | клайзен-конденсация |
| Идентификатор онтологии RSC | RXNO: 0000043 |
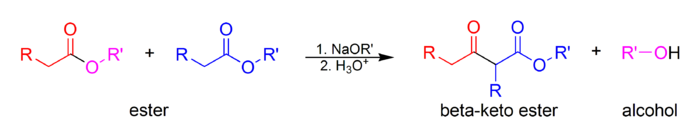
Клайзена конденсации представляет собой углерод-углеродную связь , образуя реакцию , что происходит между двумя сложными эфирами или одного эфира и другого карбонильного соединения в присутствии сильного основания , в результате чего в β-кето сложный эфир или & beta ; дикетона . [1] Он назван в честь Райнера Людвига Клайзена , который впервые опубликовал свою работу о реакции в 1887 году. [2] [3] [4]
Требования [ править ]
По крайней мере, один из реагентов должен быть енолизируемым (иметь α-протон и быть способным подвергаться депротонированию с образованием енолят-аниона ). Существует ряд различных комбинаций енолизируемых и неэнолизируемых карбонильных соединений, которые образуют несколько различных типов Клейзена.
Используемое основание не должно мешать реакции, подвергаясь нуклеофильному замещению или присоединению карбонильным углеродом. По этой причине часто используется конъюгат алкоксида натрия с основанием образовавшегося спирта (например, этоксид натрия, если образуется этанол ), поскольку алкоксид регенерируется. В смешанных конденсациях Клайзена можно использовать ненуклеофильное основание, такое как диизопропиламид лития или LDA, поскольку только одно соединение является енолизируемым. LDA обычно не используется в классической конденсации Клайзена или Дикмана из-за енолизации электрофильного эфира.
Алкоксильная часть сложного эфира должна быть относительно хорошей уходящей группой . Обычно используются метиловый и этиловый эфиры, которые дают метоксид и этоксид соответственно.
Типы [ править ]
- Классическая конденсация Клайзена, самоконденсация между двумя молекулами соединения, содержащего енолизируемый сложный эфир.
- Смешанная (или «перекрестная») конденсация Клайзена, где используются один енолизируемый сложный эфир или кетон и один ненолизируемый сложный эфир.
- Дикман конденсации , где молекула с двумя сложноэфирными группами реагирует внутримолекулярно , образуя циклическую β-кето сложный эфир. В этом случае образующееся кольцо не должно деформироваться , обычно это 5- или 6-членная цепь или кольцо.
Механизм [ править ]
На первом этапе механизма α-протон удаляется сильным основанием, что приводит к образованию енолят-аниона, который становится относительно стабильным за счет делокализации электронов. Затем карбонильный углерод (другого) сложного эфира подвергается нуклеофильной атаке енолят-анионом. Затем алкоксигруппа удаляется (что приводит к (повторному) образованию алкоксида), а алкоксид удаляет вновь образованный двойной α-протон с образованием нового енолятного аниона с высокой резонансной стабилизацией. Водная кислота (например, серная кислота или фосфорная кислота ) добавляется на последней стадии для нейтрализацииенолят и какое-либо основание все еще присутствуют. Затем выделяют вновь образованный β-кетоэфир или β-дикетон. Обратите внимание, что для реакции требуется стехиометрическое количество основания, поскольку удаление двойного α-протона термодинамически стимулирует протекающую в остальном эндергоническую реакцию. То есть конденсация Клайзена не работает с субстратами, содержащими только один α-водород, из-за эффекта движущей силы депротонирования β-кетоэфира на последней стадии.
| анимация |
Конденсация Стоббе [ править ]
Stobbe конденсация [5] представляет собой модификацию специфична для диэтилового эфира из нтарной кислоты , требующей менее сильные основания. [6] Примером является его реакция с бензофеноном : [7]
Механизм реакции, который объясняет образование как сложноэфирной группы, так и группы карбоновой кислоты, основан на промежуточном лактоне ( 5 ):
Конденсация Стоббе была использована на первой стадии синтеза таметралина Райнхардом Сарджесом [8], а также ее можно использовать в синтезе димефадана . [ необходима цитата ]
См. Также [ править ]
- Альдольная конденсация
- Синтез жирных кислот
- Поликетидсинтаза
- Конденсация Дикмана
Ссылки [ править ]
- Перейти ↑ Carey, FA (2006). Органическая химия (6-е изд.). Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл. ISBN 0-07-111562-5.
- ^ Claisen, L .; Клапаред, А. (1881). "Condensationen von Ketonen mit Aldehyden" . Berichte der Deutschen Chemischen Gesellschaft . 14 (2): 2460–2468. DOI : 10.1002 / cber.188101402192 .
- ^ Клайзена, Л. (1887). «Ueber die Einführung von Säureradicalen in Ketone» . Berichte der Deutschen Chemischen Gesellschaft . 20 (1): 655–657. DOI : 10.1002 / cber.188702001150 .
- ^ Хаузер, CR; Хадсон, Б. Э. младший (1942). «Конденсация эфира ацетоуксусной кислоты и некоторые связанные реакции» . Органические реакции . 1 : 266–302. DOI : 10.1002 / 0471264180.or001.09 . ISBN 0471264180.
- ^ Стоббе, Х. (1899). "Конденсация бензофенонов mit Bernsteinsäureester" . Юстус Либигс Аннален дер Хеми . 308 (1–2): 89–114. DOI : 10.1002 / jlac.18993080106 .
- ^ Марш, Джерри (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3 ed.), New York: Wiley, ISBN. 0-471-85472-7
- ^ Джонсон, WS; Шнайдер, WP (1950). «β-КАРБЕТОКСИ-γ, γ-ДИФЕНИЛВИНИЛЕТИНОВАЯ КИСЛОТА» (PDF) . Органический синтез . 30 : 18. ; Сборник , 4 , с. 132
- ^ Sarges R (1975). «Синтез фенилзамещенных 1-аминотетралинов». Журнал органической химии . 40 (9): 1216–1224. DOI : 10.1021 / jo00897a008 .
Внешние ссылки [ править ]
- «Клэйзен Конденсация» . Портал органической химии.