 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Лития диизопропиламид | |
| Другие имена LDA | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| ECHA InfoCard | 100.021.721 |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 6 H 14 LiN или LiN (C 3 H 7 ) 2 | |
| Молярная масса | 107,1233 г / моль |
| Внешность | бесцветное твердое вещество |
| Плотность | 0,79 г / см 3 |
| Реагирует с водой | |
| Кислотность (p K a ) | 36 (THF) [1] |
| Опасности | |
| Основные опасности | разъедающий |
| Родственные соединения | |
Родственные соединения | Супербазы |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
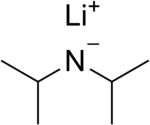
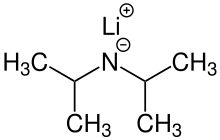
Диизопропиламид лития (обычно сокращенно LDA ) представляет собой химическое соединение с молекулярной формулой [(CH 3 ) 2 CH] 2 NLi. Он используется как сильное основание и получил широкое распространение из-за его хорошей растворимости в неполярных органических растворителях и ненуклеофильной природы. Это бесцветное твердое вещество, но обычно образуется и наблюдается только в растворе. Он был впервые получен Хэмеллом и Левином в 1950 году вместе с несколькими другими затрудненными диорганиламидами лития для осуществления депротонирования сложных эфиров в α-положении без атаки карбонильной группы. [2]
Подготовка и структура [ править ]
ЛДА обычно формируется путем обработки охлажденному ( от 0 до -78 ° С) смеси тетрагидрофурана и диизопропиламина с н - бутиллитием . [3]
При диссоциации анион диизопропиламида может стать протонированным с образованием диизопропиламина. Диизопропиламин имеет значение pKa 36. Следовательно, его сопряженное основание подходит для депротонирования соединений с более высокой кислотностью, что особенно важно, таких слабокислых соединений (углеродных кислот) типа R 2 C H Z, где Z = C (O) R ', CO 2 R' или CN. Обычные протонные функциональные группы, такие как спирты и карбоновые кислоты, легко депротонируются.
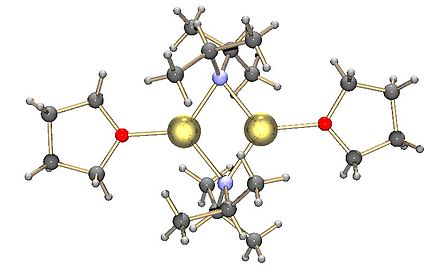
Как и большинство литийорганических реагентов , LDA не является солью, но имеет высокую полярность. Он образует агрегаты в растворе, причем степень агрегации зависит от природы растворителя. В ТГФ его структура в основном представляет собой сольватированный димер . [4] [5] В неполярных растворителях, таких как толуол , он образует зависящее от температуры олигомерное равновесие. При комнатной температуре наиболее вероятными структурами являются тримеры и тетрамеры. При понижении температуры агрегация распространяется на пентамерные и высшие олигомерные структуры. [6]
Твердое ЛДА является пирофорным , [7] , но его растворы , как правило , нет. Как таковой, он коммерчески доступен в виде раствора в полярных апротонных растворителях, таких как ТГФ и эфир; однако для мелкомасштабного использования (менее 50 ммоль) обычно и более рентабельно готовить LDA in situ .
Кинетические и термодинамические основы [ править ]
Депротонирование углеродных кислот может происходить либо под кинетическим, либо под термодинамическим контролем реакции . Кинетическое контролируемое депротонирование требует стерически затрудненного основания и достаточно прочного для необратимого удаления протона. Например, в случае фенилацетона при депротонировании могут образоваться два разных енолата.. Было показано, что LDA депротонирует метильную группу, что является кинетическим ходом депротонирования. Для получения кинетического продукта используют небольшой избыток (1,1 экв.) Диизопропиламида лития, а кетон добавляют к основанию при –78 ° C. Поскольку кетон быстро и количественно превращается в енолят, а основание постоянно присутствует в избытке, кетон не может действовать как протонный челнок, катализируя постепенное образование термодинамического продукта. Более слабое основание, такое как алкоксид , которое обратимо депротонирует субстрат, дает более термодинамически стабильный бензильный енолят. Альтернативой более слабому основанию является использование сильного основания, которое присутствует в более низкой концентрации, чем кетон. Так , например, с суспензией изгидрид натрия в ТГФ или диметилформамиде (ДМФ), основание реагирует только на границе раздела раствор-твердое вещество. Молекула кетона может быть депротонирована на кинетическом сайте. Этот енолят может затем встретиться с другими кетонами, и термодинамический енолят будет образовываться за счет обмена протонами даже в апротонном растворителе, который не содержит ионов гидроксония.
Однако LDA может действовать как нуклеофил при определенных условиях.
См. Также [ править ]
- Лития амид
- Бис (триметилсилил) амид лития (LiHMDS)
- Тетраметилпиперидид лития (LiTMP)
Ссылки [ править ]
- ^ Таблица Evans pKa
- ^ Хэмелл, Мэтью; Левин, Роберт (1950). «Конденсации под действием амидов щелочных металлов. IV. Реакции сложных эфиров с амидом лития и некоторыми замещенными амидами лития1». Журнал органической химии . 15 : 162–168. DOI : 10.1021 / jo01147a026 .
- ^ Смит, AP; Ламба, JJS; Фрейзер, CL (2004). «Эффективный синтез галометил-2,2'-бипиридинов: 4,4'-бис (хлорметил) -2,2'-бипиридин» . Органический синтез .; Сборник , 10 , стр. 107
- ^ Уильямс, PG; Сальвино, JM (1993). «Синтез, выделение и структура комплекса LDA-THF». Журнал органической химии . 58 (1): 1–3. DOI : 10.1021 / jo00053a001 .
- ^ NDR Barnett; RE Mulvey; В. Клегг; П.А. О'Нил (1991). «Кристаллическая структура диизопропиламида лития (LDA): бесконечное спиральное расположение, состоящее из почти линейных азот-литий-азотных единиц с четырьмя единицами на виток спирали». Журнал Американского химического общества . 113 (21): 8187. DOI : 10.1021 / ja00021a066 .
- ^ Neufeld, R .; Джон М. и Сталке Д. (2015). «Агрегация диизопропиламида лития в углеводородах, не содержащая донорских оснований, выявленная методом DOSY». Angewandte Chemie International Edition . 54 (24): 6994–6998. DOI : 10.1002 / anie.201502576 . PMID 26014367 .
- ^ MSDS в Sigma-Aldrich
- ^ Цзяньше Конг; Тао Мэн; Полин Тинг и Джесси Вонг (2010). «Получение этил-1-бензил-4-фторпиперидин-4-карбоксилата» . Органический синтез . 87 : 137. DOI : 10,15227 / orgsyn.087.0137 .