| Глоссарий стыковки |
|---|
|
| редактировать |
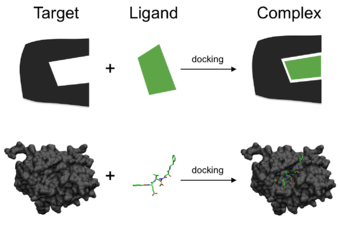
В области молекулярного моделирования , док представляет собой метод , который предсказывает преимущественную ориентацию одной молекулы ко второй , когда связаны друг с другом с образованием стабильного комплекса . [1] Знание предпочтительной ориентации, в свою очередь, может быть использовано для прогнозирования силы ассоциации или аффинности связывания между двумя молекулами, используя, например, оценочные функции .
Связи между биологически значимыми молекулами, такими как белки , пептиды , нуклеиновые кислоты , углеводы и липиды, играют центральную роль в передаче сигнала . Кроме того, относительная ориентация двух взаимодействующих партнеров может влиять на тип производимого сигнала (например, агонизм против антагонизма ). Следовательно, стыковка полезна для прогнозирования мощности и типа создаваемого сигнала.
Молекулярный докинг - один из наиболее часто используемых методов в разработке лекарств на основе структуры из-за его способности предсказывать конформацию связывания низкомолекулярных лигандов с соответствующим сайтом связывания- мишени . Характеристика поведения связывания играет важную роль в рациональном дизайне лекарств, а также для выяснения фундаментальных биохимических процессов. [2] [3]
Определение проблемы [ править ]
Можно думать о молекулярном стыковке как о проблеме «замка и ключа» , в которой нужно найти правильную относительную ориентацию «ключа», которая откроет «замок» (где на поверхности замка находится отверстие для ключа, направление поворота ключа после его вставки и т. д.). Здесь белок можно рассматривать как «замок», а лиганд - как «ключ». Молекулярный докинг можно определить как проблему оптимизации, которая описывает «наилучшую» ориентацию лиганда, который связывается с конкретным представляющим интерес белком. Однако, поскольку и лиганд, и белок являются гибкими, аналогия «рука в перчатке» более уместна, чем «замок и ключ» . [4] В ходе процесса стыковки лиганд и белок корректируют свою конформацию для достижения общего «наилучшего соответствия», и такой вид конформационного регулирования, приводящий к общему связыванию, называется «индуцированным соответствием» . [5]
Исследования молекулярного докинга сосредоточены на компьютерном моделировании процесса молекулярного распознавания . Он направлен на достижение оптимальной конформации как для белка, так и для лиганда и относительной ориентации между белком и лигандом, чтобы свести к минимуму свободную энергию всей системы.
Подходы к стыковке [ править ]
Два подхода особенно популярны в сообществе молекулярного докинга. Один подход использует метод сопоставления, который описывает белок и лиганд как комплементарные поверхности. [6] [7] [8] Второй подход моделирует фактический процесс стыковки, в котором рассчитываются энергии парного взаимодействия лиганд-белок. [9] Оба подхода имеют как значительные преимущества, так и некоторые ограничения. Они описаны ниже.
Комплементарность формы [ править ]
Методы геометрического соответствия / комплементарности формы описывают белок и лиганд как набор функций, которые делают их стыкованными. [10] Эти особенности могут включать в себя дескрипторы молекулярной поверхности / комплементарной поверхности . В этом случае молекулярная поверхность рецептора описывается с точки зрения его доступной для растворителя площади поверхности.и молекулярная поверхность лиганда описана в терминах его совпадающего описания поверхности. Комплементарность между двумя поверхностями составляет описание соответствия формы, которое может помочь найти комплементарную позу стыковки мишени и молекул лиганда. Другой подход состоит в описании гидрофобных свойств белка с использованием поворотов в атомах основной цепи. Еще один подход - использовать технику дескриптора формы Фурье. [11] [12] [13]В то время как подходы, основанные на комплементарности формы, обычно бывают быстрыми и надежными, они обычно не могут точно моделировать движения или динамические изменения конформаций лиганд / белок, хотя недавние разработки позволяют этим методам исследовать гибкость лиганда. Методы комплементарности формы могут быстро сканировать несколько тысяч лигандов за считанные секунды и фактически определять, могут ли они связываться с активным сайтом белка, и обычно масштабируются даже для белок-белковых взаимодействий. Они также гораздо более поддаются подходам на основе фармакофора, поскольку они используют геометрические описания лигандов для поиска оптимального связывания.
Моделирование [ править ]
Моделировать процесс стыковки намного сложнее. В этом подходе белок и лиганд разделены некоторым физическим расстоянием, и лиганд находит свое положение в активном центре белка после определенного количества «перемещений» в его конформационном пространстве. Движения включают в себя преобразования твердого тела, такие как перемещения и вращения, а также внутренние изменения в структуре лиганда, включая повороты под углом кручения. Каждое из этих перемещений в конформационном пространстве лиганда вызывает общую энергетическую стоимость системы. Следовательно, полная энергия системы вычисляется после каждого движения.
Очевидным преимуществом моделирования стыковки является то, что гибкость лиганда легко вводится, тогда как методы комплементарности формы должны использовать оригинальные методы для включения гибкости лигандов. Кроме того, он более точно моделирует реальность, в то время как дополнительные методы форм являются скорее абстракцией.
Ясно, что моделирование требует больших вычислительных ресурсов и требует изучения большого энергетического ландшафта. Сеточные методы, методы оптимизации и увеличенная скорость компьютера сделали моделирование стыковки более реалистичным.
Механика стыковки [ править ]
Для выполнения скрининга стыковки первое требование - это структура интересующего белка. Обычно структура определяется с использованием биофизических методов, таких как рентгеновская кристаллография , ЯМР-спектроскопия или криоэлектронная микроскопия (крио-ЭМ) , но также может быть получена из конструкции моделирования гомологии . Эта структура белка и база данных потенциальных лигандов служат входными данными для программы стыковки. Успех программы стыковки зависит от двух компонентов: алгоритма поиска и функции подсчета очков .
Алгоритм поиска [ править ]
Пространство поиска в теории состоит из всех возможных ориентаций и конформации белка , спаренный с лигандом. Однако на практике с текущими вычислительными ресурсами невозможно исчерпывающе исследовать пространство поиска - это потребует перечисления всех возможных искажений каждой молекулы (молекулы динамичны и существуют в ансамбле конформационных состояний) и всех возможных вращательных и поступательных ориентаций лиганд относительно белка на данном уровне гранулярности . Большинство используемых программ стыковки учитывают все конформационное пространство лиганда (гибкий лиганд), а некоторые пытаются моделировать гибкий рецептор белка. Каждый «снимок» пары называетсяпоза .
К лиганду и рецептору применялись различные стратегии конформационного поиска. К ним относятся:
- систематический или стохастический крутильный поиск вращающихся связей
- моделирование молекулярной динамики
- генетические алгоритмы для «развития» новых низкоэнергетических конформаций, и где оценка каждой позы действует как функция приспособленности, используемая для выбора людей для следующей итерации.
Гибкость лиганда [ править ]
Конформации лиганда могут быть созданы в отсутствие рецептора и впоследствии состыкованы [14], или конформации могут быть созданы «на лету» в присутствии полости для связывания рецептора [15] или с полной гибкостью вращения каждого двугранного угла. с использованием стыковки на основе фрагментов. [16] Оценка энергии силового поля чаще всего используется для выбора энергетически разумных конформаций, [17] но также используются методы, основанные на знаниях. [18]
Пептиды являются одновременно очень гибкими и относительно крупными молекулами, что делает моделирование их гибкости сложной задачей. Был разработан ряд методов, позволяющих эффективно моделировать гибкость пептидов во время стыковки белок-пептид. [19]
Гибкость рецептора [ править ]
Вычислительные возможности резко возросли за последнее десятилетие, что сделало возможным использование более сложных и требовательных к вычислительным ресурсам методов в компьютерной разработке лекарств. Тем не менее, проблема гибкости рецепторов в методологиях стыковки все еще остается сложной. [20] Основная причина этой трудности - большое количество степеней свободы, которые необходимо учитывать при такого рода расчетах. Однако пренебрежение им в некоторых случаях может привести к плохим результатам стыковки с точки зрения предсказания позы привязки. [21]
Множественные статические структуры, экспериментально определенные для одного и того же белка в разных конформациях, часто используются для имитации гибкости рецептора. [22] В качестве альтернативы можно провести поиск ротамерных библиотек боковых цепей аминокислот, которые окружают связывающую полость, для создания альтернативных, но энергетически приемлемых конформаций белка. [23] [24]
Функция подсчета очков [ править ]
Программы стыковки генерируют большое количество потенциальных поз лиганда, некоторые из которых могут быть немедленно отклонены из-за конфликтов с белком. Остальные оцениваются с использованием некоторой функции подсчета очков, которая принимает позу в качестве входных данных и возвращает число, указывающее вероятность того, что поза представляет собой благоприятное связывающее взаимодействие, и ранжирует один лиганд относительно другого.
Большинство оценочных функций - это силовые поля молекулярной механики, основанные на физике, которые оценивают энергию позы в месте связывания. Различные вклады в связывание можно записать в виде аддитивного уравнения:
Компоненты состоят из эффектов растворителя, конформационных изменений в белке и лиганде, свободной энергии из-за взаимодействий белок-лиганд, внутренних вращений, энергии ассоциации лиганда и рецептора для образования единого комплекса и свободной энергии из-за изменений в колебательных режимах. [25] Низкая (отрицательная) энергия указывает на стабильную систему и, следовательно, на вероятное связывающее взаимодействие.
Альтернативный подход состоит в том, чтобы получить основанный на знаниях статистический потенциал для взаимодействий из большой базы данных комплексов белок-лиганд, такой как банк данных по белкам , и оценить соответствие позы в соответствии с этим предполагаемым потенциалом.
Рентгеновская кристаллография дает большое количество структур для комплексов между белками и лигандами с высоким сродством, но сравнительно меньше структур для лигандов с низким сродством, поскольку более поздние комплексы имеют тенденцию быть менее стабильными и, следовательно, более трудно кристаллизоваться. Функции подсчета, обученные с этими данными, могут правильно стыковать лиганды с высокой аффинностью, но они также дадут правдоподобные стыкованные конформации для лигандов, которые не связываются. Это дает большое количество ложноположительных совпадений, т. Е. Лиганды, согласно прогнозам, связываются с белком, которые на самом деле не связываются при помещении вместе в пробирку.
Один из способов уменьшить количество ложных срабатываний - это пересчитать энергию поз, получивших наибольшее количество очков, используя (потенциально) более точные, но более требовательные в вычислительном отношении техники, такие как методы Обобщенного Борна или Пуассона-Больцмана . [9]
Оценка стыковки [ править ]
Взаимозависимость между отбором проб и функцией подсчета очков влияет на способность стыковки при прогнозировании правдоподобных поз или сродства связывания для новых соединений. Таким образом, обычно требуется оценка протокола стыковки (при наличии экспериментальных данных) для определения его прогностической способности. Оценка стыковки может выполняться с использованием различных стратегий, таких как:
- расчет точности стыковки (ТД);
- корреляция между оценкой стыковки и экспериментальным ответом или определением фактора обогащения (EF); [26]
- расстояние между ион-связывающим фрагментом и ионом в активном центре;
- наличие индуцированных моделей.
Точность стыковки [ править ]
Точность стыковки [27] [28] представляет собой одну меру для количественной оценки пригодности программы стыковки за счет рационализации способности предсказывать правильную позу лиганда по сравнению с экспериментально наблюдаемой. [29]
Фактор обогащения [ править ]
Скрины стыковки также могут быть оценены путем обогащения аннотированных лигандов известных связывающих веществ из большой базы данных предполагаемых несвязывающих, « ложных » молекул. [26] Таким образом, успешность стыковочного скрининга оценивается по его способности обогатить небольшое количество известных активных соединений в верхних рядах скрининга среди гораздо большего числа молекул-ловушек в базе данных. Площадь под кривой рабочей характеристики приемника (ROC) широко используется для оценки его характеристик.
Перспективный [ править ]
Полученные результаты от стыковочных экранов подвергаются фармакологической проверке (например, IC 50 , измерения сродства или активности ). Только проспективные исследования представляют собой убедительное доказательство пригодности техники для конкретной цели. [30]
Бенчмаркинг [ править ]
Потенциал стыковочных программ для воспроизведения режимов связывания, определенных с помощью рентгеновской кристаллографии, можно оценить с помощью ряда наборов стыковочных тестов.
Для малых молекул существует несколько наборов эталонных данных для стыковки и виртуального скрининга, например Astex Diverse Set, состоящий из высококачественных структур кристаллов белок-лиганд в рентгеновских лучах [31] или Справочник полезных ловушек ( DUD ) для оценки эффективности виртуального скрининга. [26]
Оценка док-программ на предмет их способности воспроизводить режимы связывания пептидов может быть оценена с помощью Уроки для оценки эффективности стыковки и подсчета очков (LEADS-PEP). [32]
Приложения [ править ]
Связывающее взаимодействие между низкомолекулярным лигандом и белком фермента может привести к активации или ингибированию фермента. Если белок является рецептором, связывание лиганда может привести к агонизму или антагонизму . Докинг чаще всего используется в области разработки лекарств - большинство лекарств представляют собой небольшие органические молекулы, и стыковка может применяться к:
- идентификация попаданий - стыковка в сочетании с функцией подсчета очков может использоваться для быстрого скрининга больших баз данных потенциальных лекарств in silico для выявления молекул, которые могут связываться с интересующей белковой мишенью (см. виртуальный скрининг ).
- Оптимизация отведения - стыковка может использоваться для прогнозирования того, где и в какой относительной ориентации лиганд связывается с белком (также называемый режимом связывания или позой). Эта информация, в свою очередь, может быть использована для разработки более эффективных и селективных аналогов.
- Биовосстановление - стыковка белковых лигандов также может быть использована для прогнозирования загрязнителей, которые могут разлагаться ферментами. [33] [34]
См. Также [ править ]
- Дизайн лекарств
- Алгоритм Катчальского-Кацира
- Список систем молекулярной графики
- Макромолекулярная стыковка
- Молекулярная механика
- Белковая структура
- Белковый дизайн
- Программное обеспечение для моделирования молекулярной механики
- Список программ стыковки белок-лиганд
- Программное обеспечение для молекулярного дизайна
- Док-станция @ Home
- Иберцивис
- База данных ZINC
- Ведущий поиск
- Виртуальный просмотр
- Функции подсчета очков для стыковки
Ссылки [ править ]
- ^ Lengauer Т, М Rarey июня (1996). «Вычислительные методы биомолекулярного докинга». Текущее мнение в структурной биологии . 6 (3): 402–6. DOI : 10.1016 / S0959-440X (96) 80061-3 . PMID 8804827 .
- ^ Кухня DB, Decornez H, Furr JR, Bajorath J (ноябрь 2004 г.). «Стыковка и оценка в виртуальном скрининге для открытия лекарств: методы и приложения». Обзоры природы. Открытие наркотиков . 3 (11): 935–49. DOI : 10.1038 / nrd1549 . PMID 15520816 . S2CID 1069493 .
- ^ Мосташари-Рад, Т; Ариан, Р. Мехридехнави, А; Фассихи, А; Гасеми, Ф (13 июня 2019 г.). «Исследование ингибиторов рецептора хемокина CXCR4 с использованием QSPR и методик молекулярного докинга». Журнал теоретической и вычислительной химии . 178 (4). DOI : 10.1142 / S0219633619500184 .
- ↑ Jorgensen WL (ноябрь 1991 г.). «Ржавчина модели замка и ключа для связывания белок-лиганд». Наука . 254 (5034): 954–5. Bibcode : 1991Sci ... 254..954J . DOI : 10.1126 / science.1719636 . PMID 1719636 .
- ↑ Wei BQ, Weaver LH, Ferrari AM, Matthews BW, Shoichet BK (апрель 2004 г.). «Тестирование алгоритма стыковки гибких рецепторов на модельном сайте связывания». Журнал молекулярной биологии . 337 (5): 1161–82. DOI : 10.1016 / j.jmb.2004.02.015 . PMID 15046985 .
- ^ Goldman BB, Wipke WT (2000). «Дескрипторы квадратичной формы QSD. 2. Молекулярное стыкование с использованием дескрипторов квадратичной формы (QSDock)» . Белки . 38 (1): 79–94. DOI : 10.1002 / (SICI) 1097-0134 (20000101) 38: 1 <79 :: AID-PROT9> 3.0.CO; 2-U . PMID 10651041 .
- ^ Мэн EC, Shoichet BK, Кунц ID (1992). «Автоматическая стыковка с оценкой энергопотребления по сети». Журнал вычислительной химии . 13 (4): 505–524. DOI : 10.1002 / jcc.540130412 . S2CID 97778840 .
- ^ Моррис GM, Goodsell DS, Холлидое RS, Huey R, Hart WE, Бель RK, Olson AJ (1998). «Автоматическая стыковка с использованием генетического алгоритма Ламарка и эмпирической функции связывания свободной энергии». Журнал вычислительной химии . 19 (14): 1639–1662. CiteSeerX 10.1.1.471.5900 . DOI : 10.1002 / (SICI) 1096-987X (19981115) 19:14 <1639 :: AID-JCC10> 3.0.CO; 2-B .
- ^ a b Фейг М., Онуфриев А., Ли М.С., Им В., Дело DA, Брукс С.Л. (январь 2004 г.). «Сравнение производительности обобщенных методов Борна и Пуассона при расчете энергий электростатической сольватации для белковых структур». Журнал вычислительной химии . 25 (2): 265–84. DOI : 10.1002 / jcc.10378 . PMID 14648625 . S2CID 3191066 .
- ^ Shoichet Б.К., Кунтц ID, Бодиан DL (2004). «Молекулярная стыковка с использованием дескрипторов формы». Журнал вычислительной химии . 13 (3): 380–397. DOI : 10.1002 / jcc.540130311 . S2CID 42749294 .
- ↑ Cai W, Shao X, Maigret B (январь 2002 г.). «Распознавание белок-лиганд с использованием сферических гармонических молекулярных поверхностей: на пути к быстрому и эффективному фильтру для большого виртуального скрининга». Журнал молекулярной графики и моделирования . 20 (4): 313–28. DOI : 10.1016 / S1093-3263 (01) 00134-6 . PMID 11858640 .
- ^ Моррис RJ, Najmanovich RJ, Kahraman A, Thornton JM (май 2005). «Реальные коэффициенты расширения сферических гармоник как дескрипторы трехмерной формы для сравнения карманов связывания белков и лигандов» . Биоинформатика . 21 (10): 2347–55. DOI : 10.1093 / биоинформатики / bti337 . PMID 15728116 .
- Перейти ↑ Kahraman A, Morris RJ, Laskowski RA, Thornton JM (апрель 2007 г.). «Изменение формы карманов связывания белков и их лигандов». Журнал молекулярной биологии . 368 (1): 283–301. DOI : 10.1016 / j.jmb.2007.01.086 . PMID 17337005 .
- ^ Kearsley SK, Underwood DJ, Sheridan RP, Miller MD (октябрь 1994). «Flexibases: способ расширить использование методов молекулярного стыковки». Журнал компьютерного молекулярного дизайна . 8 (5): 565–82. Bibcode : 1994JCAMD ... 8..565K . DOI : 10.1007 / BF00123666 . PMID 7876901 . S2CID 8834526 .
- ^ Friesner Р.А., Банки JL, Murphy РБ, Halgren Т.А., Klicic JJ, Mainz DT, Repasky MP, Knoll EH, Shelley M, Перри JK, Шоу DE, Фрэнсис P, Shenkin PS (март 2004). «Glide: новый подход к быстрой и точной стыковке и подсчету очков. 1. Метод и оценка точности стыковки». Журнал медицинской химии . 47 (7): 1739–49. DOI : 10.1021 / jm0306430 . PMID 15027865 .
- ^ Zsoldos Z, Reid D, Simon A, Sadjad SB, Джонсон AP (июль 2007). «eHiTS: новая быстрая и гибкая система стыковки лигандов». Журнал молекулярной графики и моделирования . 26 (1): 198–212. DOI : 10.1016 / j.jmgm.2006.06.002 . PMID 16860582 .
- Перейти ↑ Wang Q, Pang YP (сентябрь 2007 г.). Ромесберг Ф (ред.). «Предпочтение малых молекул локальным минимальным конформациям при связывании с белками» . PLOS ONE . 2 (9): e820. Bibcode : 2007PLoSO ... 2..820W . DOI : 10.1371 / journal.pone.0000820 . PMC 1959 г. 118 . PMID 17786192 .
- ^ Клебе G, Mietzner T (октябрь 1994). «Быстрый и эффективный метод создания биологически значимых конформаций». Журнал компьютерного молекулярного дизайна . 8 (5): 583–606. Bibcode : 1994JCAMD ... 8..583K . DOI : 10.1007 / BF00123667 . PMID 7876902 . S2CID 206768542 .
- ^ Ciemny М, Kurcinski М, Камель К, Kolinski А, Н Алам, Шулер-Фурман О, Kmiecik S (Май 2018). «Белок-пептидный докинг: возможности и проблемы» . Открытие наркотиков сегодня . 23 (8): 1530–1537. DOI : 10.1016 / j.drudis.2018.05.006 . PMID 29733895 .
- ^ Antunes DA, Devaurs D, Kavraki LE (декабрь 2015). «Понимание проблем гибкости белков при разработке лекарств» (PDF) . Мнение эксперта об открытии лекарств . 10 (12): 1301–13. DOI : 10.1517 / 17460441.2015.1094458 . hdl : 1911/88215 . PMID 26414598 . S2CID 6589810 .
- ^ Cerqueira Н.М., бюстгальтеры NF, Fernandes PA, Рамос MJ (январь 2009). «MADAMM: многоступенчатая стыковка с протоколом автоматизированного молекулярного моделирования». Белки . 74 (1): 192–206. DOI : 10.1002 / prot.22146 . PMID 18618708 . S2CID 36656063 .
- ^ Тотров M, Абагян R (апрель 2008). «Стыковка гибкого лиганда к множеству конформаций рецептора: практическая альтернатива» . Текущее мнение в структурной биологии . 18 (2): 178–84. DOI : 10.1016 / j.sbi.2008.01.004 . PMC 2396190 . PMID 18302984 .
- ↑ Хартманн C, Антеш I, Ленгауэр T (февраль 2009 г.). «Стыковка и оценка с альтернативными конформациями боковой цепи». Белки . 74 (3): 712–26. DOI : 10.1002 / prot.22189 . PMID 18704939 . S2CID 36088213 .
- ^ Taylor RD, Jewsbury PJ, Essex JW (октябрь 2003). «FDS: стыковка гибких лигандов и рецепторов с моделью континуального растворителя и энергетической функцией мягкого ядра». Журнал вычислительной химии . 24 (13): 1637–56. CiteSeerX 10.1.1.147.1131 . DOI : 10.1002 / jcc.10295 . PMID 12926007 . S2CID 15814316 .
- ^ Murcko MA (декабрь 1995). "Вычислительные методы для прогнозирования свободной энергии связывания в комплексах лиганд-рецептор". Журнал медицинской химии . 38 (26): 4953–67. DOI : 10.1021 / jm00026a001 . PMID 8544170 .
- ^ a b c Хуанг Н., Шойхет Б.К., Ирвин Дж. Дж. (ноябрь 2006 г.). «Тестовые наборы для молекулярного докинга» . Журнал медицинской химии . 49 (23): 6789–801. DOI : 10.1021 / jm0608356 . PMC 3383317 . PMID 17154509 .
- ^ Ballante F, Marshall GR (январь 2016). «Автоматизированная стратегия для выбора позы привязки и оценки стыковки при разработке лекарств на основе структуры». Журнал химической информации и моделирования . 56 (1): 54–72. DOI : 10.1021 / acs.jcim.5b00603 . PMID 26682916 .
- ^ Bursulaya BD, Тотры M, Абагян R, Брукс CL (ноябрь 2003). «Сравнительное исследование нескольких алгоритмов стыковки гибких лигандов». Журнал компьютерного молекулярного дизайна . 17 (11): 755–63. Bibcode : 2003JCAMD..17..755B . DOI : 10,1023 / Б: JCAM.0000017496.76572.6f . PMID 15072435 . S2CID 12569345 .
- ^ Балланте, Флавио (2018). «Докинг белок-лиганд в дизайне лекарств: оценка эффективности и выбор позы связывания». Рациональный дизайн лекарств . Методы молекулярной биологии. 1824 . С. 67–88. DOI : 10.1007 / 978-1-4939-8630-9_5 . ISBN 978-1-4939-8629-3. ISSN 1940-6029 . PMID 30039402 .
- ^ Ирвин JJ (2008-02-14). «Тесты сообщества для виртуального просмотра». Журнал компьютерного молекулярного дизайна . 22 (3–4): 193–9. Bibcode : 2008JCAMD..22..193I . DOI : 10.1007 / s10822-008-9189-4 . PMID 18273555 . S2CID 26260725 .
- ^ Hartshorn MJ, Вердонк ML, Chessari G, Brewerton SC, Mooij WT, Мортенсон PN, Мюррей CW (февраль 2007). «Разнообразный высококачественный набор для проверки эффективности стыковки белок-лиганд». Журнал медицинской химии . 50 (4): 726–41. DOI : 10.1021 / jm061277y . PMID 17300160 .
- ^ Хаузер А.С., Windshügel Б (Декабрь 2015). «Набор контрольных данных для оценки эффективности стыковки пептидов». Журнал химической информации и моделирования . 56 (1): 188–200. DOI : 10.1021 / acs.jcim.5b00234 . PMID 26651532 .
- ^ Суреш П.С., Кумар А., Кумар Р., Сингх В.П. (январь 2008 г.). «Подход in silico [коррекция инсилико] к биоремедиации: лакказа как тематическое исследование». Журнал молекулярной графики и моделирования . 26 (5): 845–9. DOI : 10.1016 / j.jmgm.2007.05.005 . PMID 17606396 .
- ^ Башарат Z, Ясмин А, Биби М (2020). «Влияние молекулярного докинга для биоремедиации». Аналитика данных в медицине: концепции, методологии, инструменты и приложения . IGI Global. С. 1556–1577. ISBN 978-1799812043.
Внешние ссылки [ править ]
- Бикади З., Ковач С., Демко Л., Хазай Э. «Молекулярный стыковочный сервер - стыковка лигандного белка и молекулярное моделирование» . Virtua Ltd Drug . Проверено 15 июля 2008 .
Интернет-сервис, рассчитывающий местоположение, геометрию и энергию малых молекул, взаимодействующих с белками.
- Малинаускас Т. «Пошаговая установка MGLTools 1.5.2 (AutoDockTools, Python Molecular Viewer и среда визуального программирования) на Ubuntu Linux 8.04» . Архивировано из оригинала на 2009-02-26 . Проверено 15 июля 2008 .
- Docking @ GRID Project of Conformational Sampling and Docking on Grids: одна из целей - развернуть некоторые встроенные распределенные алгоритмы стыковки в вычислительных Grids, загрузить версию Docking @ GRID для Linux с открытым исходным кодом
- Click2Drug.org - Справочник вычислительных средств разработки лекарств.
- Лиганд: стыковка рецептора с MOE (молекулярная рабочая среда)