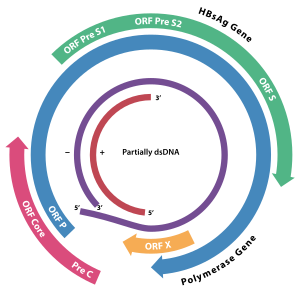
HBX является гепатита вирусного белка . [1] [2] Он состоит из 154 аминокислот и препятствует транскрипции, передаче сигнала, развитию клеточного цикла , деградации белка, апоптозу и стабильности хромосом в организме хозяина. Он образует гетеродимерный комплекс со своим клеточным белком-мишенью (взаимодействующий с HBX белок: HBXIP ), и это взаимодействие нарушает регуляцию динамики центросом и формирование митотического веретена . [3] Он взаимодействует с DDB1 (поврежденный ДНК-связывающий белок 1), перенаправляя активность убиквитинлигазыКомплексы CUL4 -DDB1 E3 , которые непосредственно участвуют во внутриклеточной регуляции репликации и репарации ДНК , транскрипции и передачи сигнала. [4]
Хотя протеин X обычно отсутствует в Avihepadnavirus , его рудиментарная версия была обнаружена в геноме вируса гепатита уток. [5]
Хотя у него нет значительной идентичности последовательности с какими-либо известными белками позвоночных, кажется вероятным, что он произошел от ДНК-гликозилазы . [6]
У трансгенных мышей, экспрессирующих белок Х в печени, более вероятно, чем у дикого типа, развивается гепатоцеллюлярная карцинома. Это связано с тем, что белок X способствует развитию клеточного цикла, связываясь с белком-супрессором опухоли р53 и подавляя его выполнение своей роли. Экспериментальные наблюдения также предполагают, что белок HBx увеличивает активность TERT и теломеразы , продлевая продолжительность жизни гепатоцитов и способствуя злокачественной трансформации. [7]
Молекулярные эффекты HBx [ править ]
HBx вызывает множество клеточных изменений. Эти изменения происходят из-за прямого действия HBx и косвенного действия из-за большого увеличения внутриклеточных активных форм кислорода (ROS), частично индуцированного HBx. HBx, по-видимому, нарушает регуляцию ряда клеточных путей. HBx вызывает нарушение регуляции путем связывания с геномной ДНК, изменения паттернов экспрессии miRNA, воздействия на гистоновые метилтрансферазы, связывания с белком SIRT1 для активации транскрипции и взаимодействия с гистоновыми метилазами и деметилазами для изменения паттернов клеточной экспрессии. [8]
HBx частично ответственен за примерно 10 000-кратное увеличение внутриклеточных АФК при хронической инфекции HBV. [9] [10] HBx может локализоваться в митохондриях, где HBx снижает потенциал митохондриальной мембраны и вызывает повышенное высвобождение ROS. [11] Кроме того, другие белки HBV, HBsAg [11] и HBcAg , [10] также увеличивают АФК за счет взаимодействия с эндоплазматическим ретикулумом . АФК вызывают более 20 типов повреждений ДНК. [12] Окислительное повреждение ДНК является мутагенным. [13]
HBx оказывает большое влияние на уровни транскрипции многих генов. В модели трансгенных мышей, экспрессирующих ген HBx вируса гепатита B (но не другие гены HBV), у большинства мышей развились опухоли печени. [14] У этих трансгенных мышей HBx было 10 553 дифференциально метилированных участков ДНК (6668 гиперметилированных и 3885 гипометилированных участков). В клетках млекопитающих большие кластеры динуклеотидов CpG, известные как CpG-острова (CGI), по-видимому, действуют как ключевые эпигенетические элементы, регулирующие экспрессию генов. Hyper-метилирование из CGIs в промоторах может заглушить гены, в то время как гие-метилирование CGIs в пределах дистальных экзонов генов могут также репрессировать транскрипцию генов. [14] Большая часть изменений метилирования у трансгенных мышей HBx была на CGI. HBx особенно индуцировал гипометилирование дистальных внутригенных CGI, необходимых для активной экспрессии. Было обнаружено 647 генов, содержащих внутригенные CGI, которые были гипометилированы в печени трансгенных мышей HBx. [14]
HBx также напрямую взаимодействует со многими генами. Несколько тысяч генов, кодирующих белок, по-видимому, имеют сайты связывания HBx. [8] [15] Помимо связывания с генами, кодирующими белок, HBx связывается с промоторами, контролирующими 15 микроРНК и 16 длинных некодирующих РНК . [15] Для 15 miRNAs с промоторами, связанными HBx, уровни экспрессии увеличились для восьми, снизились для 5 и не изменились существенно для двух. Каждая микроРНК с измененным уровнем экспрессии может влиять на экспрессию нескольких сотен информационных РНК (см. МикроРНК ).
Помимо воздействия на уровни транскрипции генов-хозяев, HBx влияет на синтез пгРНК in vivo в реплицирующихся клетках HBV. Поскольку HBx рекрутируется на кзкДНК , он снижает уровни ацетилирования гистонов за счет уменьшения рекрутирования ацетилаз p300 и увеличения рекрутирования деацетилаз hSirt1 и HDAC1 . [16] Это, в свою очередь, снижает гетерохроматинизацию минихромосомы HBV и увеличивает продукцию пгРНК. В клетках, инфицированных мутантами с дефектом HBx, уровни cccDNA остаются неизменными, в то время как транскрипция pgRNA снижается. Введение локализованных в ядре белковых швов HBx для восстановления репликации вируса в клетки, инфицированные HBx-дефицитным вирусом. [17]
Отношение к PRMT1 [ править ]
В исследовании очистки раковых клеток печени, инфицированных HBV, было обнаружено, что уровень экспрессии протеина аргининметилтрансферазы 1 ( PRMT1 ) связан с изменениями транскрипции из-за функции метилтрансферазы PRMT1. Сверхэкспрессия вызывает уменьшение количества транскрибируемых генов HBV, а недостаточная экспрессия, наоборот, увеличивает. Было также обнаружено, что PRMT1 рекрутируется ДНК HBV во время процесса репликации, чтобы регулировать процесс транскрипции. Повышенная экспрессия HBx, в свою очередь, приводит к ингибированию метилирования белка, опосредованного PRMT1 , что способствует репликации вируса. [18]
Ссылки [ править ]
- ↑ McClain SL, Clippinger AJ, Lizzano R, Bouchard MJ (ноябрь 2007 г.). «Репликация вируса гепатита B связана с HBx-зависимым митохондриями-регулируемым увеличением уровней цитозольного кальция» . Журнал вирусологии . 81 (21): 12061–5. DOI : 10,1128 / JVI.00740-07 . PMC 2168786 . PMID 17699583 .
- ^ Бушар MJ, Puro RJ, Wang L, Schneider RJ (июль 2003). «Активация и ингибирование клеточных путей передачи сигналов кальция и тирозинкиназы позволяет идентифицировать мишени белка HBx, участвующего в репликации вируса гепатита B» . Журнал вирусологии . 77 (14): 7713–9. DOI : 10,1128 / JVI.77.14.7713-7719.2003 . PMC 161925 . PMID 12829810 .
- Перейти ↑ Wen Y, Голубков VS, Strongin AY, Jiang W, Reed JC (февраль 2008 г.). «Взаимодействие вирусного онкопротеина гепатита В с клеточной мишенью HBXIP нарушает регуляцию динамики центросом и образования митотического веретена» . Журнал биологической химии . 283 (5): 2793–803. DOI : 10.1074 / jbc.M708419200 . PMID 18032378 .
- ^ Li T, Роберт Е. ван Breugel PC, Strubin M, Чжэн N (январь 2010). «Беспорядочный альфа-спиральный мотив привязывает вирусных захватчиков и субстратные рецепторы к аппарату убиквитинлигазы CUL4-DDB1» . Структурная и молекулярная биология природы . 17 (1): 105–11. DOI : 10.1038 / nsmb.1719 . PMC 2823288 . PMID 19966799 .
- Перейти ↑ Lin B, Anderson DA (2000). «Рудиментарная открытая рамка считывания X в вирусе гепатита В уток» . Интервирология . 43 (3): 185–90. DOI : 10.1159 / 000025037 . PMID 11044813 .
- ↑ van Hemert FJ, van de Klundert MA, Lukashov VV, Kootstra NA, Berkhout B, Zaaijer HL (2011). «Белок X вируса гепатита B: происхождение и сходство структуры с центральным доменом ДНК-гликозилазы» . PLOS ONE . 6 (8): e23392. Bibcode : 2011PLoSO ... 623392V . DOI : 10.1371 / journal.pone.0023392 . PMC 3153941 . PMID 21850270 .
- Перейти ↑ Kew MC (январь 2011 г.). «Белок вируса гепатита B x в патогенезе гепатоцеллюлярной карциномы, вызванной вирусом гепатита B». Журнал гастроэнтерологии и гепатологии . 26 Дополнение 1 (Дополнение 1): 144–52. DOI : 10.1111 / j.1440-1746.2010.06546.x . PMID 21199526 .
- ^ a b Балакришнан Л., Милавец Б. (ноябрь 2017 г.). «Эпигенетическая регуляция вирусных биологических процессов» . Вирусы . 9 (11): 346. DOI : 10,3390 / v9110346 . PMC 5707553 . PMID 29149060 .
- ^ Valgimigli M, L Valgimigli, D данный момент услугу, Gaiani S, Pedulli GF, Gramantieri L, L Bolondi (сентябрь 2002). «Измерение EPR окислительного стресса в печени человека методом радикального зонда. Корреляция с этиологией, гистологией и пролиферацией клеток». Свободно-радикальные исследования . 36 (9): 939–48. DOI : 10.1080 / 107156021000006653 . PMID 12448819 .
- ^ a b Иванов А.В., Валуев-Эллистон В.Т., Тюрина Д.А., Иванова О.Н., Кочетков С.Н., Бартош Б., Исагулянц М.Г. (январь 2017 г.). «Окислительный стресс, триггер канцерогенеза печени, вызванного вирусами гепатита C и B» . Oncotarget . 8 (3): 3895–3932. DOI : 10.18632 / oncotarget.13904 . PMC 5354803 . PMID 27965466 .
- ^ a b Хиггс MR, Chouteau P, Lerat H (май 2014 г.). « « Печень дает умереть »: окислительное повреждение ДНК и гепатотропные вирусы» (PDF) . Журнал общей вирусологии . 95 (Pt 5): 991–1004. DOI : 10.1099 / vir.0.059485-0 . PMID 24496828 .
- ↑ Yu Y, Cui Y, Niedernhofer LJ, Wang Y (декабрь 2016 г.). «Возникновение, биологические последствия и значимость для здоровья человека повреждения ДНК, вызванного окислительным стрессом» . Химические исследования в токсикологии . 29 (12): 2008–2039. DOI : 10.1021 / acs.chemrestox.6b00265 . PMC 5614522 . PMID 27989142 .
- ^ Dizdaroglu M (декабрь 2012). «Окислительное повреждение ДНК: механизмы, восстановление и болезнь». Письма о раке . 327 (1–2): 26–47. DOI : 10.1016 / j.canlet.2012.01.016 . PMID 22293091 .
- ^ a b c Ли С.М., Ли Ю.Г., Бэ Дж. Б., Чой Дж. К., Таяма С., Хата К. и др. (Июль 2014 г.). «HBx индуцирует гипометилирование дистальных внутригенных CpG-островков, необходимых для активной экспрессии регуляторов развития» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (26): 9555–60. Bibcode : 2014PNAS..111.9555L . DOI : 10.1073 / pnas.1400604111 . PMC 4084425 . PMID 24941955 .
- ^ a b Guerrieri F, Belloni L, D'Andrea D, Pediconi N, Le Pera L, Testoni B и др. (Февраль 2017 г.). «Полногеномная идентификация прямых геномных мишеней HBx» . BMC Genomics . 18 (1): 184. DOI : 10,1186 / s12864-017-3561-5 . PMC 5316204 . PMID 28212627 .
- ^ Belloni L, Pollicino T, De Nicola F, Guerrieri F, Raffa G, Fanciulli M и др. (Ноябрь 2009 г.). «Ядерный HBx связывает минихромосому HBV и изменяет эпигенетическую регуляцию функции cccDNA» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (47): 19975–9. Bibcode : 2009PNAS..10619975B . DOI : 10.1073 / pnas.0908365106 . PMC 2775998 . PMID 19906987 .
- ^ Keasler В.В., Ходжсон AJ, Madden CR, Slagle BL (июль 2009). «Белок HBx вируса гепатита B, локализованный в ядре, восстанавливает HBx-дефицитную репликацию вируса в клетках HepG2 и in vivo у мышей, которым вводили гидродинамику» . Вирусология . 390 (1): 122–9. DOI : 10.1016 / j.virol.2009.05.001 . PMC 2749295 . PMID 19464721 .
- ^ Benhenda S, Ducroux A, Rivière L, Sobhian B, Ward MD, Dion S и др. (Апрель 2013). «Метилтрансфераза PRMT1 является партнером связывания HBx и негативным регулятором транскрипции вируса гепатита B» . Журнал вирусологии . 87 (8): 4360–71. DOI : 10,1128 / JVI.02574-12 . PMC 3624337 . PMID 23388725 .