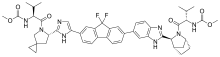
 Ледипасвир | |
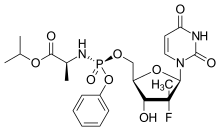 Состав софосбувира | |
| Комбинация | |
|---|---|
| Ледипасвир | Ингибитор NS5A |
| Софосбувир | Ингибитор NS5B ( РНК-полимеразы ) |
| Клинические данные | |
| Торговые наименования | Harvoni, Hepcinat-LP, другие |
| AHFS / Drugs.com | Монография |
| MedlinePlus | a614051 |
| Данные лицензии | |
| Категория беременности |
|
| Пути администрирования | Устно |
| Код УВД | |
| Правовой статус | |
| Правовой статус | |
| Идентификаторы | |
| PubChem CID | |
| КЕГГ | |
| Химические и физические данные | |
| Формула | C 71 H 83 F 3 N 11 O 15 P |
| Молярная масса | 1 418 0,476 г · моль -1 |
| 3D модель ( JSmol ) | |
| |
| |
Ledipasvir / софосбувир , продаваемый под торговым названием Harvoni среди других, это лекарство используется для лечения гепатита С . [7] Это сочетание фиксированной дозы из ledipasvir и софосбувира . [7] Показатели излечения составляют от 94% до 99% у людей, инфицированных вирусом гепатита С (ВГС) генотипа 1. [8] Некоторые данные также подтверждают использование вируса гепатита С генотипа 3 и 4. [8] Его принимают ежедневно в течение 8 дней. –24 недели. [7]
Обычно хорошо переносится. [9] Общие побочные эффекты включают мышечные боли, головную боль, тошноту, сыпь и кашель. [7] Неясно, безопасно ли использование во время беременности для ребенка. [7] Ледипасвир снижает активность NS5A, а софосбувир снижает активность полимеразы NS5B . [7]
Ледипасвир / софосбувир был одобрен для медицинского применения в США, Европейском союзе и Канаде в 2014 году. [7] [10] [6] [11] [12] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения. . [13]
Медицинское использование [ править ]
Показатели излечения составляют от 94% до 99% у людей, инфицированных генотипом 1 (46% случаев ВГС). [14] Он также был оценен для лечения инфекции с другими генотипами гепатита С и показал многообещающие результаты в генотипах 3 и 4 (что составляет 30% и менее 22% случаев HCV соответственно). [8] [5] [15] [14]
Сопротивление [ править ]
Мутации NS5A [ править ]
Множественные мутации репликонов ВГС необходимы, чтобы вызвать значительный эффект устойчивости из-за множества механизмов действия. [16] В целом, генотип 1a HCV менее устойчив к мутации, чем генотип 1b. [17]
Для генотипа 1b замена одной аминокислоты (например, L31V) в репликоне приводила к менее чем 100-кратному увеличению устойчивости к ледипасвиру в Харвони, в то время как замена двух аминокислот приводила к увеличению устойчивости более чем в 1000 раз. [17] [18] Генотип 1a имел аналогичное, но более существенное увеличение устойчивости с каждым соответствующим увеличением аминокислотных замен с заменами, связанными с устойчивостью, в K24R, M28T / V, Q30R / H / K / L, L31M или Y93H / Н. [5]
Полиморфизм NS5A также влияет на вирусную резистентность с наиболее распространенными аминокислотными заменами, связанными с резистентностью, обнаруженными в Q30R, Y93H или N и L31M у пациентов с быстрым вирусологическим ответом (RVR). [5] Специфические исходные полиморфизмы, связанные с устойчивостью к NS5A, наблюдаемые в клинических испытаниях, были M28T / V, Q30H, Q30R, L31M, H58P, Y93H и Y93N в генотипе 1a и L28M, A92T и Y93H в генотипе 1b. [5] Пациенты с множественными исходными полиморфизмами NS5A, как правило, имеют более высокую частоту рецидивов при использовании ледипасвира / софосбувира. [5]Разница в частоте рецидивов между группами, ранее не получавшими лечение, и группами, получавшими опыт лечения с исходным полиморфизмом NS5A, колеблется от 1% после 12-недельного режима и 0% после 24-недельного режима соответственно. [17] [5]
Мутации NS5B [ править ]
Одна аминокислотная замена S282T способствует устойчивости к вирусу и снижает активность софосбувира в ледипасвире / софосбувире примерно в 2-18 раз. [17] [19]
Перекрестное сопротивление [ править ]
Перекрестная резистентность не наблюдалась в комбинации ледипасвира и софосбувира в ION фазах 1,2 и 3 клинических испытаний, поскольку ледипасвир был полностью активен против замен, связанных с устойчивостью к софосбувиру, и наоборот. [5] [20]
Побочные эффекты [ править ]
Более 10% людей, принимающих ледипасвир / софосбувир, испытывают головные боли или утомляемость; сыпь, тошнота, диарея и бессонница встречаются от 1% до 10% людей, принимающих его. [5] [4]
Более тяжелые реакции связаны с аллергическими реакциями на лекарства и сердечно-сосудистыми заболеваниями. [ требуется медицинская ссылка ] Побочные эффекты Харвони считаются относительно легкими по сравнению с более старым лечением на основе интерферона.
Ледипасвир / софосбувир может вызвать реактивацию гепатита B у людей, коинфицированных вирусами гепатита B и C. Европейское агентство по лекарственным средствам рекомендуется скрининг всех людей на гепатит В перед началом ledipasvir / софосбувир гепатита С для того , чтобы свести к минимуму риск гепатита реактивации. [21]
Взаимодействие с лекарствами [ править ]
Ледипасвир / софосбувир является субстратом для переносчиков лекарств P-гликопротеина (P-gp) и белка устойчивости к раку груди (BCRP). [17] Кишечная абсорбция этих субстратов-переносчиков лекарств может быть уменьшена индукторами, такими как рифампицин и зверобой . [22]
Пациентам также рекомендуется держаться подальше от антагонистов рецепторов H2 (H2RA) и ингибиторов протонной помпы (PPI), поскольку они снижают концентрацию ледипасвира (его растворимость зависит от pH и выше в кислых условиях). Поэтому рекомендуется принимать ИПП по крайней мере через два часа после ледипасвира / софосбувира в дозе менее или равной 20 мг в день и Н2РА в дозе меньше или равной 40 мг два раза в день. [17] [23]
Ледипасвир / софосбувир следует избегать при приеме амиодарона или других препаратов, снижающих частоту сердечных сокращений; существует серьезный риск замедления или остановки сердца при использовании ледипасвира / софосбувира с такими препаратами. [5] [4]
Механизмы действия [ править ]
Наиболее часто связанный с ними механизмом , связанный с ledipasvir / софосбувиром является гиперфосфорилированием из NS5A , вирусной полимеразы важной в надлежащей вирусной сборке и препятствует надлежащему метаболизму печени. [24] Ледипасвир / софосбувир ингибирует правильную сборку вируса, изменяя субклеточную локализацию NS5A. [17]
NS5B , вирусная полимераза, которая может инициировать синтез РНК de novo , также аллостерически ингибируется ледипасвиром / софосбувиром. [25]
Комбинация ингибиторов NS5A и NS5B оказывает синергетический эффект. [26]
Фармакокинетика [ править ]
Софосбувир быстро всасывается в плазме с максимальной концентрацией (Cmax) через 0,8–1 час после введенной дозы и подвергается внепеченочному метаболизму, при этом от 61 до 65% связывается с белками плазмы человека . [27] [17] Затем он преимущественно превращается в неактивный, свободный от фосфатов циркулирующий метаболит GS-331007 (удаляется на 76% через почечную пассивную фильтрацию), который имеет среднюю пиковую концентрацию в плазме через 3,5–4 часа после приема лекарства. [5] На софосбувир, по-видимому, не влияют разные уровни макроэлементов по сравнению с голоданием . [28]
Ледипасвир имеет максимальную концентрацию через 4–4,5 часа после приема внутрь и не зависит от макроэлементов. [17] [5] Он более чем на 98% связан с белками и преимущественно выводится фекально, с минимальным метаболизмом в печени. [5]
Устранение [ править ]
Медианный полужизни после дозировки ledipasvir / софосбувир 90 мг [14С] -Ledipasvir составляет 47 часов; для 400 мг [14C] -софосбувира это 0,5 часа (после первоначального распределения лекарства в тканях тела) и 27 часов (возможное выведение лекарства). [5] [29]
| Вещество | нг / мл |
|---|---|
| Ледипасвир | 323 |
| Софосбувир | 618 |
| GS-331007 | 707 |
Примечание. Максимальная концентрация на 32% выше у здоровых людей, чем у инфицированных гепатитом С. [5]
| Вещество | нг * час / мл |
|---|---|
| Ледипасвир | 7290 |
| Софосбувир | 1320 |
| GS-33107 | 12 000 |
Примечание: максимальная концентрация на 24% выше у здоровых людей, чем у инфицированных гепатитом С. [5]
Обнаружение крови [ править ]
Для одновременной экстракции и определения ледипасвира / софосбувира в плазме крови человека с использованием противовирусного даклатасвира в качестве внутреннего стандарта был разработан аналитический метод, основанный на тандемной ЖХ-МС. Среднее извлечение софосбувира и ледипасвира составило 91,61% и 88,93% соответственно. [30]
Общество и культура [ править ]
Один производитель - Gilead Sciences . [7]
Ссылки [ править ]
- ^ a b «Использование ледипасвира / софосбувира (Харвони) во время беременности» . Drugs.com . 28 октября 2019 . Дата обращения 17 марта 2020 .
- ^ «AusPAR: Ледипасвир / Софосбувир» . Управление терапевтических товаров (TGA) . 29 октября 2015 . Проверено 29 августа 2020 .
- ^ «AusPAR: Софосбувир / Ледипасвир» . Управление терапевтических товаров (TGA) . 16 ноября 2017 . Проверено 29 августа 2020 .
- ^ a b c «Таблетки, покрытые оболочкой Harvoni 90 мг / 400 мг - Краткое описание характеристик продукта» . Сборник электронных лекарств Великобритании. Декабрь 2016. Архивировано 27 октября 2016 года . Проверено 4 февраля 2017 года . CS1 maint: обескураженный параметр ( ссылка )
- ^ a b c d e f g h i j k l m n o p «Харвониледипасвир и софосбувир в таблетках, Харвониледипасвир и софосбувир в пленочной оболочке, Харвониледипасвир в пленочной оболочке и софосбувир в гранулах» . DailyMed . 16 марта 2020 . Проверено 29 августа 2020 .
- ^ а б "Harvoni EPAR" . Европейское агентство по лекарственным средствам (EMA) . Проверено 29 августа 2020 .
- ^ a b c d e f g h «Ледипасвир и Софосбувир» . Американское общество фармацевтов систем здравоохранения. Архивировано 25 декабря 2016 года . Проверено 8 декабря +2016 . CS1 maint: обескураженный параметр ( ссылка )
- ^ а б в Китинг GM (2015). «Ледипасвир / Софосбувир: обзор его использования при хроническом гепатите С». Наркотики . 75 (6): 675–85. DOI : 10.1007 / s40265-015-0381-2 . PMID 25837989 . S2CID 31943736 .
- ^ Всемирная организация здравоохранения (2015). Выбор и использование основных лекарственных средств. Двадцатый доклад Комитета экспертов ВОЗ 2015 г. (включая 19-й Примерный перечень основных лекарственных средств ВОЗ и 5-й Примерный перечень основных лекарственных средств для детей ВОЗ) . Женева: Всемирная организация здравоохранения. С. 69–70. hdl : 10665/189763 . ISBN 9789241209946. ISSN 0512-3054 . Серия технических отчетов ВОЗ; 994.
- ^ «Пакет одобрения лекарств: Harvoni (ледипасвир и софосбувир) Таблетки NDA 205834» . США пищевых продуктов и медикаментов (FDA) . 3 ноября 2014 . Проверено 29 августа 2020 . Текстовое резюме (PDF) .
- ^ https://health-products.canada.ca/noc-ac/info.do?lang=en&no=16181
- ^ «Министерство здравоохранения Канады выпускает уведомление о соответствии для Gilead's Harvoni (Ledipasvir / Sofosbuvir), первой схемы приема однократных таблеток один раз в день для лечения хронического гепатита C генотипа 1» (пресс-релиз). Gilead Sciences, Inc. 16 октября 2014 . Проверено 29 августа 2020 г. - через Business Wire.
- ^ Всемирная организация здравоохранения (2019). Примерный перечень Всемирной организации здравоохранения основных лекарственных средств: список двадцать первых 2019 . Женева: Всемирная организация здравоохранения. ЛВП : 10665/325771 . WHO / MVP / EMP / IAU / 2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ а б Мессина, Джейн П .; Хамфрис, Исла; Флаксман, Авраам; Браун, Энтони; Кук, Грэм С .; Pybus, Оливер G .; Барнс, Элеонора (январь 2015). «Глобальное распространение и распространенность генотипов вируса гепатита С» . Гепатология . 61 (1): 77–87. DOI : 10.1002 / hep.27259 . ISSN 1527-3350 . PMC 4303918 . PMID 25069599 .
- ↑ Канадское агентство по лекарствам и технологиям в области здравоохранения (16 января 2015 г.). «Холкира (Омбитасвир / Паритапревир / Ритонавир с Дасабувиром) и Харвони (Ледипасвир / Софосбувир) для лечения хронического гепатита С: обзор клинических данных» . Служба быстрого реагирования . Канадское агентство по лекарствам и технологиям в области здравоохранения. PMID 25674658 . Архивировано 5 ноября 2017 года.
- ^ Иссур, Мохешварнатх; Гётте, Маттиас (06.11.2014). «Паттерны устойчивости, связанные с ингибиторами NS5A HCV, дают ограниченное представление о связывании лекарств» . Вирусы . 6 (11): 4227–4241. DOI : 10,3390 / v6114227 . ISSN 1999-4915 . PMC 4246218 . PMID 25384189 .
- ^ a b c d e f g h i Гриценко Диана; Хьюз, Грегори (апрель 2015 г.). «Ледипасвир / софосбувир (Харвони): улучшение возможностей для лечения вирусной инфекции гепатита С» . Аптека и терапия . 40 (4): 256–276. ISSN 1052-1372 . PMC 4378517 . PMID 25859119 .
- ↑ Гао, Мин (октябрь 2013 г.). «Противовирусная активность и резистентность ингибиторов комплекса репликации NS5A HCV». Текущее мнение в вирусологии . 3 (5): 514–520. DOI : 10.1016 / j.coviro.2013.06.014 . ISSN 1879-6265 . PMID 23896281 .
- ^ Вермерен, Йоханнес; Сарразин, Кристоф (август 2012 г.). «Роль резистентности в лечении ВГС». Лучшие практики и исследования. Клиническая гастроэнтерология . 26 (4): 487–503. DOI : 10.1016 / j.bpg.2012.09.011 . ISSN 1532-1916 . PMID 23199507 .
- ^ "harvoni_pi.pdf" (PDF) . Проверено 21 февраля 2018 .
- ^ «Противовирусные препараты прямого действия, указанные для лечения гепатита С (без интерферона)» . Европейское агентство по лекарственным средствам (EMA) . 17 сентября 2018 . Проверено 4 февраля 2020 года .
- ^ «Лекарственное взаимодействие между антивирусными препаратами прямого действия Софосбувир и Ледипасвир и антиретровирусными препаратами ВИЧ» . www.natap.org . Проверено 22 февраля 2018 .
- ^ «Влияние пищи и антацидов на уровни ледипасвира и софосбувира» . www.natap.org . Проверено 22 февраля 2018 .
- ^ Гун, Гочжун; Варис, Гулам; Танвир, Рашида; Сиддики, Алим (14 августа 2001 г.). «Белок NS5A вируса гепатита С человека изменяет уровни внутриклеточного кальция, вызывает окислительный стресс и активирует STAT-3 и NF-κB» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (17): 9599–9604. Bibcode : 2001PNAS ... 98.9599G . DOI : 10.1073 / pnas.171311298 . ISSN 0027-8424 . PMC 55498 . PMID 11481452 .
- ^ Лин, М. Валери; Чанг, Раймонд (2014). «Недавнее одобрение FDA софосбувира и симепревира. Значение для текущего лечения ВГС» . Клиническая болезнь печени . 3 (3): 65–68. DOI : 10.1002 / cld.332 . PMC 6448702 . PMID 30992888 .
- ^ Павлоцкий, Жан-Мишель (август 2013). «Ингибиторы NS5A в лечении гепатита С» . Журнал гепатологии . 59 (2): 375–382. DOI : 10.1016 / j.jhep.2013.03.030 . ISSN 1600-0641 . PMID 23567084 .
- ^ "Софосбувир" . www.drugbank.ca . Проверено 23 марта 2018 .
- ^ Cada, Деннис Дж .; Бейкер, Дэниал Э .; Биндлер, Росс Джейсон (март 2015 г.). «Ледипасвир / Софосбувир» . Больничная аптека . 50 (3): 224–234. DOI : 10.1310 / hpj5003-224 . ISSN 0018-5787 . PMC 4567193 . PMID 26405313 .
- ^ «Фармакология: базовая фармакология, ВНС, эндокринная система» . www.kumc.edu . Проверено 23 марта 2018 .
- ^ Elkady, Ehab F .; Абоэльвафа, Ахмед А. (01.09.2016). «Быстрый и оптимизированный метод ЖХ-МС / МС для одновременной экстракции и определения софосбувира и ледипасвира в плазме человека». Журнал AOAC International . 99 (5): 1252–1259. DOI : 10,5740 / jaoacint.16-0021 . PMID 27480956 .
Внешние ссылки [ править ]
- «Смесь ледипасвира с софосбувиром» . Информационный портал о наркотиках . Национальная медицинская библиотека США.