 | |
| Имена | |
|---|---|
| Название ИЮПАК диэтоксифосфорил [диэтоксифосфорилокси (этокси) фосфорил] этилфосфат | |
| Другие имена HETP; этилтетрафосфат; База Бладан | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.010.961 |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 12 H 30 P 4 O 13 | |
| Молярная масса | 506,25 г / моль |
| Внешность | жидкость от желтого до коричневого цвета |
| Плотность | 1,331 г / см 3 |
| Температура плавления | -40 ° С (-40 ° F, 233 К) |
| Точка кипения | 467,01 ° С (872,62 ° F, 740,16 К) |
| умеренный | |
| Растворимость | большинство органических растворителей |
Показатель преломления ( n D ) | 1,443 |
| Опасности | |
| Основные опасности | впитывание кожей; вдыхание |
| точка возгорания | 120,82 ° С (249,48 ° F, 393,97 К) |
| Родственные соединения | |
Родственные соединения | тетраэтилпирофосфат пентаэтилтрифосфат |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
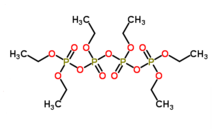
Гексаэтилтетрафосфат (также известный как HET ) представляет собой фосфорорганическое соединение с химической формулой [(C 2 H 5 O) 3 P 2 O 3 ] 2 O. Соединение не было выделено в чистом виде, но, по-видимому, представляет собой бесцветную жидкость при комнатная температура. Коммерческие образцы выглядят коричневыми из-за примесей. [1] [2] Он входит в состав инсектицида Bladan . [3] В 1940-х годах это был такой же важный инсектицид, как ДДТ, и в книге 1948 года он был назван «еще одним соперником ДДТ за славу».[4]
Подготовка, структура и свойства [ править ]
Смеси, содержащие гексаэтилтетрафосфат, получают путем нагревания диэтилового эфира и пятиокиси фосфора . Реакция влечет за собой разрыв связи СО эфира. [5] Молекула содержит три пирофосфатные связи, которые являются центрами высокой реакционной способности. Соединение существует в виде двух диастереомеров, мезо- и dl-изомеров.
Гексаэтилтетрафосфат плохо горит. Это смешивается и растворим в воде. [6] Он также растворим в большом количестве органических растворителей, но не в простых углеводородах. [1] Гидридные восстановители превращают его в фосфин , токсичный газ. [6] Гексаэтилтетрафосфат легко гидролизуется до нетоксичных продуктов. [1]
Поскольку материал не был получен в чистом виде, свойства остаются непроверенными. [3]
Гексаэтилтетрафосфат не вызывает заметной коррозии металлов, таких как латунь и железо . Однако, когда к химическому веществу добавляется небольшое количество воды, он образует сильную кислоту и быстро разъедает гальваническое железо и медленнее разъедает чистое железо. Гексаэтилтетрафосфат, разбавленный 0,1% воды, имеет pH 2,5. [3]
Меры предосторожности и токсичность [ править ]
Гексаэтилтетрафосфат при нагревании может выделять токсичные или едкие пары . Сточные воды, содержащие химическое вещество, также могут привести к загрязнению водных путей. Емкости с ним также могут взорваться при высоких температурах. При вдыхании, проглатывании или попадании через кожу он может вызвать смерть. [6] Клещи , тли , трипсы , цикадки и некоторые виды гусениц очень восприимчивы к отравлению гексаэтилтетрафосфатом. [1] [7] Токсичность химического вещества для насекомых не зависит от того, произведено ли оно с помощью процесса скрейдера или процесса Вудстока. [8]Он также очень токсичен для человека. [3]
Из 133 видов растений, которые были протестированы на реакцию на гексаэтилтетрафосфат, только два типа растений пострадали. Это были хризантемы и помидоры . [3]
ЛД50 из hexaethyl тетрафосфата для трипсов составляет 0,01%. 99% тлей можно убить концентрацией от 1 до 2,5 граммов 10% раствора химического вещества на площади в 1000 кубических футов . В одном эксперименте 100% бахчевых тлей погибло после воздействия водного раствора, содержащего 0,025% гексаэтилтетрафосфата и 0,025% лаурилсульфата натрия . 99% тлей можно убить 0,3 граммами 10% раствора химического вещества в метилхлориде на 1000 кубических футов, а 100% тлей можно убить вдвое большим количеством раствора. 96% яблочной тлиможет быть убит воздействием водного раствора 0,1% гексаэтилтетрафосфата и 0,05% лаурилсульфата натрия. Пыль, содержащая 3% гексаэтилтетрафосфата в концентрации 40 фунтов на акр, может убить некоторых бобовых тлей . [8] 100% капустной тли можно убить водным раствором 0,1% химического вещества и 0,05% лаурилсульфата натрия. Капустную тлю можно быстро убить с помощью спрея, содержащего одну пинту химического вещества на 100 галлонов воды. [9]
100% тлей хризантем можно убить водным раствором 0,1% гексаэтилтетрафосфата и 0,05% лаурилсульфата натрия. 97% тлей хризантем можно убить 3 граммами 10% раствора химического вещества на 1000 кубических футов. 100% подсолнечника можно убить водным раствором, содержащим по 0,05% гексаэтилтетрафосфата и лаурилсульфата натрия. 94% гороховой тли можно убить путем воздействия в течение 24 часов эмульсии, содержащей 2,4% химического вещества. 90% картофельной тли можно убить путем воздействия в течение 42 часов одной пинты 50% раствора химического вещества в 100 галлонах воды. [9]
Эффекты hexaethyl тетрафосфата на холинэстеразы из крыс и тараканов ткани были протестированы. [10]
Производство [ править ]
Гексаэтилтетрафосфат был впервые синтезирован немецким химиком Герхардом Шрадером , который прореагировал оксихлорид фосфора и триэтил ортофосфат примерно при 150 ° C. Эта реакция известна как процесс Шредера. Немцы также производили гексаэтилтетрафосфат из оксихлорида фосфора и этилового спирта . Эта реакция требует немного более низкого давления, чем процесс Шредера. [1] Реакция взаимодействия представляет собой химическое уравнение POCl 3 + 3 (C 2 H 5 ) 3 PO 4 → (C 2 H 5 ) 6 P 4.O 13 + 3C 2 H 5 Cl. [7]
К 1947 году гексаэтилтетрафосфат производился в промышленных масштабах. Это стоило 1,10 доллара США за фунт в форме барабанов и 2 доллара США за фунт в форме бутылок . [7] В 1940-х годах химическое вещество производилось в промышленных масштабах при концентрации 50%. [8]
Отгрузочный номер гексаэтилтетрафосфата в ООН - 1611. [11]
Приложения [ править ]
Гексаэтилтетрафосфат используется как инсектицид , в частности инсектицид Бладан. [1] Немцы обычно использовали это химическое вещество в качестве инсектицида во время Второй мировой войны, когда инсектициды на основе никотина не были доступны. [1]
История [ править ]
Гексаэтилтетрафосфат был впервые описан Шредером в 1938 году. [1] [7] Он был обнаружен во время исследований боевых отравляющих веществ. [1] Впервые американцы услышали об этом химическом веществе после 1945 года от двух человек по имени Холл и Килгор. Соединенные Штаты начали производить это химическое вещество в 1946 году. [7]
Ссылки [ править ]
- ^ Б с д е е г ч я S.A. Hall, Martin Jacobson (апрель 1948 г.), "Hexaethyl тетрафосфата и Тетраэтилсвинец пирофосфат", Промышленные & Engineering Chemistry , 40 (4): 694-699, DOI : 10.1021 / ie50460a024
- ^ Роберт Ли Меткалф (1948), Способ действия органических инсектицидов, вопросы 1-5
- ^ a b c d e Дайджест информации о гексаэтилтетрафосфате , Вашингтон, округ Колумбия: Министерство сельского хозяйства США, Управление сельскохозяйственных исследований, Бюро энтомологии и карантина растений, 1947 г. , получено в 2013 г. Проверить значения даты в:
|access-date=( помощь ) - ^ Ежегодник медицинских инструкций 1948 , 1948, ISBN 9780804704830, получено в июле 2013 г. Проверить значения даты в:
|access-date=( помощь ) - ^ Буркхардт, Готфрид; Klein, Melvin P .; Кальвин, Мелвин (1965). «Структура так называемого« этилметафосфата »(эфира Лангельда)» (PDF) . Журнал Американского химического общества . 87 (3): 591–6. DOI : 10.1021 / ja01081a035 . CS1 maint: использует параметр авторов ( ссылка )
- ^ a b c Гексаэтилтрифосфат , получен в 2013 г. Проверить значения даты в:
|access-date=( помощь ) - ^ a b c d e Дайджест информации о гексаэтилтетрафосфате , Вашингтон, округ Колумбия: Министерство сельского хозяйства США, Управление сельскохозяйственных исследований, Бюро энтомологии и карантина растений, 1947 г.
- ^ a b c Дайджест информации о гексаэтилтетрафосфате , Вашингтон, округ Колумбия: Министерство сельского хозяйства США, Управление сельскохозяйственных исследований, Бюро энтомологии и карантина растений, 1947 г.
- ^ a b Дайджест информации о гексаэтилтетрафосфате , Вашингтон, округ Колумбия: Министерство сельского хозяйства США, Управление сельскохозяйственных исследований, Бюро энтомологии и карантина растений, 1947 г.
- ^ Труды Общества экспериментальной биологии и медицины , 1947 г.
- ↑ Николас П. Черемисинов (1 января 1999 г.), Справочник по промышленной токсикологии и опасным материалам , ISBN 9780824719357