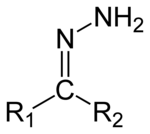
Гидразоны - это класс органических соединений со структурой R
1р
2C = NNH
2. [1] Они связаны с кетонами и альдегидами заменой кислорода на NNH.
2 функциональная группа . Обычно они образуются при действии гидразина на кетоны или альдегиды. [2] [3]
Синтез [ править ]
Гидразин, органогидразины и 1,1-диорганогидразины реагируют с альдегидами и кетонами с образованием гидразонов.
Фенилгидразин реагирует с редуцирующими сахарами с образованием гидразонов, известных как осазоны , которые были разработаны немецким химиком Эмилем Фишером в качестве теста для дифференциации моносахаридов. [4] [5]
Использует [ редактировать ]
H-гидразоны являются основой для различных анализов кетонов и альдегидов. Например, динитрофенилгидразин, нанесенный на кремнеземный сорбент, является основой адсорбционного картриджа. Затем гидразоны элюируют и анализируют с помощью ВЭЖХ с использованием УФ- детектора.
Соединение карбонила cyanide- р -trifluoromethoxyphenylhydrazone (сокращенно FCCP) используется для расцепить АТФ синтеза и снижения из кислорода в окислительное фосфорилирование в молекулярной биологии .
Гидразоны - основа стратегий биоконъюгации. [6] [7] Методы связывания на основе гидразона используются в медицинской биотехнологии для связывания лекарств с целевыми антителами (см. ADC ), например антителами против определенного типа раковых клеток. Связь на основе гидразона устойчива при нейтральном pH (в крови), но быстро разрушается в кислой среде лизосом клетки. Таким образом, лекарство попадает в клетку и выполняет свою функцию. [8]
Реакции [ править ]
Гидразоны подвержены гидролизу:
- R 2 C = N-NR ' 2 + H 2 O → R 2 C = O + H 2 N-NR' 2
Алкильные гидразонов составляют 10 2 - 10 3 -кратно более чувствителен к гидролизу , чем аналогичные оксимы. [9]
При образовании самого гидразина гидразоны конденсируются со вторым эквивалентом карбонила с образованием азинов : [10]
- R 2 C = N-NH ' 2 + R 2 C = O → R 2 C = NN = CR 2 + H 2 O
Гидразоны являются промежуточными продуктами восстановления Вольфа – Кишнера .
Гидразоны являются реагентами в гидразоне йодирования , в реакции Шапиро , и реакцию Бэмфорда-Stevens к виниловым соединениям. Гидразоны также могут быть синтезированы по реакции Яппа -Клингеманна через β-кетокислоты или β-кетоэфиры и соли арилдиазония. Гидразоны преобразуются в азины при использовании в получении 3,5-дизамещенные 1 H - пиразолы , [11] реакция также хорошо известно использованием гидразингидрата . [12] [13] С катализатором на основе переходного металла гидразоны могут служить в качестве суррогатов металлоорганических реагентов для взаимодействия с различными электрофилами.[14]
N , N -диалкилгидразоны [ править ]
В N , N -диалкилгидразонах [15] связь C = N может быть гидролизована, окислена и восстановлена, связь NN может быть восстановлена до свободного амина. Атом углерода связи C = N может реагировать с металлоорганическими нуклеофилами. Альфа-атом водорода на 10 порядков более кислый по сравнению с кетоном и, следовательно, более нуклеофильный. Депротонирование, например, LDA дает азаенолят, который можно алкилировать алкилгалогенидами. [16] Гидразины SAMP и RAMP действуют как вспомогательные хиральные соединения . [17] [18]
Галерея [ править ]
- Гидразоны
Бензофенон гидразон, иллюстративный гидразон
Карбонил цианид м-хлорфенилгидразон
Гиромитрин (метилформилгидразон ацетальдегида), токсин
Дигидралазин , антигипертензивный препарат
Рентгеновская структура гидразона бензофенона, производного ДНП . Выбранные параметры: C = N, 128 pm; NN, 1.38 пм, NNC (Ar), 119 [19]
См. Также [ править ]
- Азо соединение
- Я добываю
- Нитрозамин
- Гидрирование двойных связей углерод – азот
Ссылки [ править ]
- ^ Марч, Джерри (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3 ed.), New York: Wiley, ISBN 0-471-85472-7
- ^ Аист, G .; Бенаим, Дж. (1977). «Моноалкилирование α, β-ненасыщенных кетонов через металлоенамины: 1-бутил-10-метил-Δ 1 (9) -2-окталон» . Органический синтез . 57 : 69.; Коллективный том , 6 , с. 242
- ^ День, AC; Whiting, MC (1970). «Ацетон гидразон» . Органический синтез . 50 : 3.; Коллективный том , 6 , с. 10
- ^ Фишер, Эмиль (1908). "Schmelzpunkt des Phenylhydrazins und einiger Osazone" . Berichte der Deutschen Chemischen Gesellschaft . 41 : 73–77. DOI : 10.1002 / cber.19080410120 .
- ^ Фишер, Эмиль (1894). "Ueber einige Osazone und Hydrazone der Zuckergruppe" . Berichte der Deutschen Chemischen Gesellschaft . 27 (2): 2486–2492. DOI : 10.1002 / cber.189402702249 .
- ^ Kölmel, Dominik K .; Кул, Эрик Т. (2017). «Оксимы и гидразоны в биоконъюгации: механизм и катализ» . Химические обзоры . 117 (15): 10358–10376. DOI : 10.1021 / acs.chemrev.7b00090 . PMC 5580355 . PMID 28640998 .
- ^ Алгар, В. Расс; Prasuhn, Duane E .; Стюарт, Майкл Х .; Дженнингс, Трэвис Л .; Blanco-Canosa, Juan B .; Доусон, Филип Э .; Мединц, Игорь Л. (2011). «Контролируемое отображение биомолекул на наночастицах: задача, подходящая для биоортогональной химии». Биоконъюгатная химия . 22 (5): 825–858. DOI : 10.1021 / bc200065z . PMID 21585205 .
- ^ Ву, Анна М .; Сентер, Питер Д. (7 сентября 2005 г.). «Вооружение антител: перспективы и проблемы для иммуноконъюгатов». Природа Биотехнологии . 23 (9): 1137–46. DOI : 10.1038 / nbt1141 . PMID 16151407 . S2CID 27226728 .
- ^ Kalia, J .; Рейнс, RT (2008). «Гидролитическая стабильность гидразонов и оксимов» . Энгью. Chem. Int. Эд . 47 (39): 7523–6. DOI : 10.1002 / anie.200802651 . PMC 2743602 . PMID 18712739 .
- ^ День, AC; Whiting, MC (1970). «Ацетон гидразон». Органический синтез . 50 : 3. DOI : 10,15227 / orgsyn.050.0003 .
- ^ Ласри, Джамал; Исмаил, Али И. (2018). "Безметалловый и катализируемый FeCl 3 синтез азинов и 3,5-дифенил- 1H- пиразола из гидразонов и / или кетонов под контролем ESI + -MS высокого разрешения " . Индийский журнал по химии, раздел B . 57B (3): 362–373.
- ^ Outirite, Моха; Лебрини, Муним; Лагрене, Мишель; Бентисс, Фуад (2008). «Новый одностадийный синтез 3,5-дизамещенных пиразолов при микроволновом облучении и классическом нагревании». Журнал химии гетероциклов . 45 (2): 503–505. DOI : 10.1002 / jhet.5570450231 .
- ^ Чжан, Цзэ; Тан, Я-Джун; Ван, Чунь-Шань; У, Хао-Хао (2014). «Однореакторный синтез 3,5-дифенил-1 H- пиразолов из халконов и гидразина при механохимической шаровой мельнице». Гетероциклы . 89 (1): 103–112. DOI : 10.3987 / COM-13-12867 .
- ^ Ван, H; Дай, X.-J .; Ли, К.-Дж. (2017). «Альдегиды как эквиваленты алкилкарбанионов для добавок к карбонильным соединениям». Химия природы . 9 (4): 374–378. DOI : 10.1038 / nchem.2677 . S2CID 11653420 .
- ^ Lazny, R .; Нодзевска, А. (2010). «N, N-диалкилгидразоны в органическом синтезе. От простых N, N-диметилгидразонов до хиральных вспомогательных веществ на носителе». Химические обзоры . 110 (3): 1386–1434. DOI : 10.1021 / cr900067y . PMID 20000672 .
- ^ Эндерс, Дитер; Райнхольд, Ульрих (1997). «Асимметричный синтез аминов путем нуклеофильного 1,2-присоединения металлоорганических реагентов к CN-двойной связи». Тетраэдр: асимметрия . 8 (12): 1895–1946. DOI : 10.1016 / S0957-4166 (97) 00208-5 .
- ^ Эндерс, Дитер; Фей, Питер; Киппхардт, Гельмут (1987). «( S ) - (-) - 1-амино-2-метоксиметилпирролидин (SAMP) и ( R ) - (+) - 1-амино-2-метоксиметилпирролидин (RAMP), универсальные хиральные вспомогательные вещества». Органический синтез . 65 : 173. DOI : 10,15227 / orgsyn.065.0173 .
- ^ Эндерс, Дитер; Киппхардт, Гельмут; Фей, Питер (1987). «Асимметричный синтез с использованием метода SAMP- / RAMP-гидразона: ( S ) - (+) - 4-метил-3-гептанон». Органический синтез . 65 : 183. DOI : 10,15227 / orgsyn.065.0183 .
- ^ Тамим, Abdassalam Abdelhafiz; Салхин, Абдуссалам; Саад, Бахруддин; Рахман, Исмаил Аб .; Салех, Мухаммад Идирис; Нг, Ши-Лин; Забавно, Хунг-Кун (2006). «Бензофенон-2,4-динитрофенилгидразон». Acta Crystallographica Раздел E . 62 (12): o5686 – o5688. DOI : 10.1107 / S1600536806048112 .