 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Дисульфид дигидрогена | |
| Другие имена Сероводород; Персульфид водорода; Сероводород; Тиосульфеновая кислота | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| H 2 S 2 | |
| Молярная масса | 66,14 г · моль -1 |
| Внешность | желтая жидкость |
| Плотность | 1,334 г см −3 |
| Температура плавления | -89,6 ° С (-129,3 ° F, 183,6 К) |
| Точка кипения | 70,7 ° С (159,3 ° F, 343,8 К) |
| Основание конъюгата | Дисульфанид HS- 2 |
| Опасности | |
| точка возгорания | легковоспламеняющийся |
| Родственные соединения | |
Родственные соединения | Сероводород Перекись водорода Диселенид водорода Дителлурид водорода Дихлорид дисеры |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дисульфид водорода представляет собой неорганическое соединение с формулой H 2 S 2 . Этот халькогенид водорода представляет собой бледно-желтую летучую жидкость с запахом камфары. Он легко разлагается до сероводорода (H 2 S) и элементарной серы . [1]
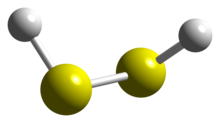
Структура [ править ]
Структура сероводорода аналогична структуре перекиси водорода с точечной симметрией C 2 . Обе молекулы явно неплоские. Двугранный угол составляет 90,6 ° по сравнению с 111,5 ° в H 2 O 2 . Валентный угол H-S-S составляет 92 °, что близко к 90 ° для негибридизированной двухвалентной серы. [1]
Синтез и реакции [ править ]
Дисульфид водорода можно синтезировать растворением полисульфидов щелочных или щелочноземельных металлов в воде. Когда раствор смешивают с концентрированной соляной кислотой при -15 ° C, желтое масло, состоящее из смеси полисульфанов (H 2 S n ), будет скапливаться под водным слоем. Фракционная перегонка этого масла дает сероводород отдельно от любых других полисульфидов (в основном трисульфида). [2] [3] [4] [1]
Дисульфид водорода легко разлагается в условиях окружающей среды до сероводорода и серы. [3] В химии сероорганических соединений сероводород присоединяется к алкенам с образованием дисульфидов и тиолов . [5]
Квантовое туннелирование и его подавление в дисульфиде дейтерия [ править ]
Дейтерированная форма дисульфид водорода БДССА, имеет аналогичную геометрию HSSH, но его время туннелирования медленнее, что делает его удобным тест для квантового эффекта Зенона , в котором часто наблюдение квантовой системы подавляет ее нормальное развитие. Трост и Хорнбергер [6] рассчитали, что, хотя изолированная молекула DSSD будет спонтанно колебаться между левой и правой хиральными формами с периодом 5,6 миллисекунды, присутствие небольшого количества инертного газообразного гелия должно стабилизировать хиральные состояния, столкновения молекул атомы гелия, по сути, «наблюдают» за мгновенной хиральностью молекулы и, таким образом, подавляют спонтанную эволюцию в другое хиральное состояние. [7]
Воздействие на здоровье [ править ]
Дисульфид водорода описывается как «имеющий сильный и раздражающий запах», который похож на камфору или SCl.2, вызывая «слезы и жжение в ноздрях». [3] Если он присутствует в высоких концентрациях, он может вызвать головокружение, дезориентацию и, в конечном итоге, потерю сознания. [8]
Ссылки [ править ]
- ^ a b c Р. Штейдель «Неорганические полисульфаны H 2 S n с n > 1» в элементарной сере и соединениях с высоким содержанием серы II (Topics in Current Chemistry) 2003, Volume 231, pp 99–125. DOI : 10.1007 / b13182
- ^ De, AK (2001-01-15). Учебник неорганической химии . ISBN 978-81-224-1384-7.
- ^ a b c Уолтон и Парсон; Парсонс, Ллевеллин Б. (1921). «Получение и свойства персульфидов водорода» . Варенье. Chem. Soc . 43 (12): 2539–48. DOI : 10.1021 / ja01445a008 .
- ↑ Георг Брауэр: Справочник по препаративной неорганической химии, том I, стр. 391, Wiley, 1963.
- ↑ Опасные реагенты , братья Робинзоны
- ^ Trost, J .; Хорнбергер, К. (2009). «Парадокс Хунда и столкновительная стабилизация киральных молекул». Phys. Rev. Lett . 103 (2): 023202. arXiv : 0811.2140 . Bibcode : 2009PhRvL.103b3202T . DOI : 10.1103 / PhysRevLett.103.023202 . PMID 19659202 .
- ^ Месячный расчет разрешает квантовый парадокс 82-летней давности , Physics Today, сентябрь 2009 г., стр. 16
- Перейти ↑ Stein, Wilkinson, G (2007). Семинары по общей психиатрии взрослых . Королевский колледж психиатров. ISBN 978-1-904671-44-2.