В области органической химии , правилу Марковникова , или правила Марковникова в описывает исход некоторых реакций присоединения . Правило было сформулировано русским химиком Владимиром Марковниковым в 1870 году. [1] [2]
Объяснение [ править ]
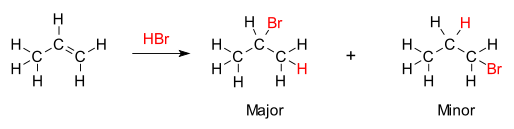
Правило гласит, что с добавлением протонной кислоты HX или другого полярного реагента к асимметричному алкену кислотный водород (H) или электроположительная часть присоединяется к углероду с большим количеством водородных заместителей, а группа галогенида (X) или электроотрицательная часть присоединяется к углероду с большим количеством алкильных заместителей. В качестве альтернативы можно сформулировать правило, согласно которому атом водорода добавляется к углероду с наибольшим числом атомов водорода, в то время как компонент X добавляется к углероду с наименьшим числом атомов водорода. [3]
То же самое верно, когда алкен реагирует с водой в реакции присоединения с образованием спирта, который включает образование карбокатионов. Гидроксильная группа (ОН) связывается с углеродом , который имеет большее количество углерода-углеродные связи, в то время как водородные связи с атомом углерода на другом конце двойной связи, которая имеет более углерод-водородные связи.
Химической основой правила Марковникова является образование наиболее стабильного карбокатиона в процессе присоединения. Добавление иона водорода к одному атому углерода в алкене создает положительный заряд на другом углероде, образуя промежуточный карбокатион. Чем более замещен карбокатион, тем он более стабилен за счет индукции и гиперконъюгации.. Основным продуктом реакции присоединения будет продукт, образованный из более стабильного промежуточного продукта. Следовательно, основной продукт присоединения HX (где X представляет собой на несколько атомов более электроотрицательный, чем H) к алкену имеет атом водорода в менее замещенном положении и X в более замещенном положении. Но другой, менее замещенный, менее стабильный карбокатион все равно будет образовываться при некоторой концентрации и будет оставаться второстепенным продуктом с противоположным, конъюгированным присоединением X.
Антимарковские реакции [ править ]
Механизмы, которые не включают промежуточный карбокатион, могут реагировать через другие механизмы, которые имеют другие региоселективности, не продиктованные правилом Марковникова, такие как присоединение свободных радикалов . Такие реакции называются антимарковниковскими , поскольку галоген присоединяется к менее замещенному углероду, что противоположно реакции Марковникова.
Правило антимарковникова можно проиллюстрировать на примере добавления бромистого водорода к изобутилену в присутствии перекиси бензоила или перекиси водорода. Реакция HBr с замещенными алкенами была прототипом при изучении свободнорадикальных присоединений. Ранние химики обнаружили, что причина вариабельности соотношения продуктов марковниковской и антимарковниковской реакции была связана с неожиданным присутствием свободнорадикальных ионизирующих веществ, таких как пероксиды. Объяснение заключается в том, что связь OO в пероксидах относительно слабая. С помощью света, тепла или иногда даже просто действуя самостоятельно, связь OO может расщепляться с образованием 2 радикалов.. Радикальные группы могут затем взаимодействовать с HBr с образованием радикала Br, который затем реагирует с двойной связью. Поскольку атом брома относительно большой, он с большей вероятностью встретит и прореагирует с наименее замещенным углеродом, поскольку это взаимодействие вызывает менее статические взаимодействия между углеродом и радикалом брома. Кроме того, как и положительно заряженные частицы, радикалы наиболее стабильны, когда неспаренный электрон находится в более замещенном положении. Радикальный интермедиат стабилизируется сверхсопряжением . В более замещенном положении больше углерод-водородных связей выровнено с электронно-дефицитной молекулярной орбиталью радикала. Это означает, что есть более сильные эффекты гиперконъюгации, так что это положение более благоприятно. [4] В этом случае концевой углерод является реагентом, который дает первичный продукт присоединения вместо вторичного продукта присоединения.
Новый метод антимарковниковского присоединения был описан Гамильтоном и Ничевичем, которые используют ароматические молекулы и световую энергию низкоэнергетического диода для превращения алкена в катион-радикал. [5] [6]
Антимарковское поведение распространяется на большее количество химических реакций, чем на добавки к алкенам. Поведение Анти-Марковникова наблюдаются в гидратации из фенилацетилена по аурическому катализу, который дает ацетофенон ; хотя со специальным рутениевым катализатором [7] он обеспечивает другой региоизомер 2-фенилацетальдегид : [8]
Антимарковниковское поведение также может проявляться в определенных реакциях перегруппировки . В титана (IV) , хлорид -catalyzed формального нуклеофильного замещения в энантиомерно 1 в приведенной ниже схеме, образуются два продукта - 2a и 2b , из - за двух хиральных центров в молекуле - мишени, углерод , несущий хлора и атом углерода , несущий метил и ацетоксиэтильной группы должны быть образованы четыре различных соединения: 1R, 2R- (показано как 2b), 1R, 2S- 1S, 2R- (показано как 2a) и 1S, 2S-. Следовательно, обе изображенные структуры будут существовать в D- и L-форме. : [9]
Это распределение продукта можно рационализировать, предполагая , что потеря гидроксильной группы в 1 дает третичный карбокатионе А , который перегруппировывается на первый взгляд менее устойчивой вторичной карбокатионной B . Хлор может приближаться к этому центру с двух сторон, что приводит к наблюдаемой смеси изомеров.
Другим ярким примером антимарковниковской добавки является гидроборирование .
См. Также [ править ]
- Правление Зайцева
Ссылки [ править ]
- ^ В. Марковников (1870). "Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren" . Annalen der Pharmacie . 153 (1): 228–59. DOI : 10.1002 / jlac.18701530204 .
- ^ Хьюз, Питер (2006). «Было ли правило Марковникова надуманной догадкой?». Журнал химического образования . 83 (8): 1152. Bibcode : 2006JChEd..83.1152H . DOI : 10.1021 / ed083p1152 .
- ^ Макмерри, Джон. «Раздел 7.8: Ориентация электрофильных реакций: правило Марковникова». Органическая химия (8-е изд.). п. 240. ISBN 9780840054548.
- ^ Clayden, Джонатан (2012). Органическая химия . Издательство Оксфордского университета. С. 977, 985.
- ^ Drahl, Кармен. «Реакция, управляемая светом, изменяет двойные связи с нетрадиционной избирательностью - Выпуск от 15 апреля 2013 г. - Том 91 Выпуск 15 - Новости химии и машиностроения» . cen.acs.org .
- ^ Гамильтон, Дэвид S .; Ничевич, Дэвид А. (2012). «Прямая каталитическая антимарковская гидроэтерификация алкенолов» . Журнал Американского химического общества . 134 (45): 18577–18580. DOI : 10.1021 / ja309635w . PMC 3513336 . PMID 23113557 .
- ^ каталитическая система, основанная нареакции рутеноцена in situ с Cp- и нафталиновыми лигандами и вторым объемным пиридиновым лигандом
- ^ Лабонн, Орели; Криббер, Томас; Хинтерманн, Лукас (2006). «Высокоактивные катализаторы in situ для антимарковской гидратации концевых алкинов». Органические буквы . 8 (25): 5853–6. DOI : 10.1021 / ol062455k . PMID 17134289 .
- ^ Нисидзава, Мугио; Асаи, Юмико; Имагава, Хироши (2006). "TiCl 4- индуцированная антимарковниковская перегруппировка". Органические буквы . 8 (25): 5793–6. DOI : 10.1021 / ol062337x . PMID 17134274 . .
Внешние ссылки [ править ]
- Лекция ханской академии


