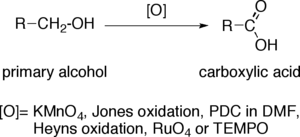
Окисление первичных спиртов с карбоновыми кислотами является важным окислением реакции в органической химии .
Когда первичный спирт превращается в карбоновую кислоту , концевой атом углерода увеличивает степень окисления на четыре. Окислители, способные выполнять эту операцию в сложных органических молекулах, содержащих другие чувствительные к окислению функциональные группы, должны обладать значительной селективностью. Наиболее распространенными окислителями являются щелочной перманганат калия (KMnO 4 ) или подкисленный дихромат калия . Реагент Джонса , PCC в DMF , окисление Хейнса, четырехокись рутения (RuO 4 ) и TEMPO также используются.
Перманганат калия [ править ]
Перманганат калия (KMnO 4 ) - очень сильный окислитель, способный реагировать со многими функциональными группами, такими как вторичные спирты, 1,2-диолы, альдегиды, алкены, оксимы, сульфиды и тиолы. В контролируемых условиях KMnO 4 очень эффективно окисляет первичные спирты до карбоновых кислот. Эта реакция, которая была впервые подробно описана Фурнье [1] [2] , обычно проводится путем добавления KMnO 4 к раствору или суспензии спирта в щелочном водном растворе. Полученную смесь перемешивают до полного окисления. Чтобы реакция протекала эффективно, спирт должен быть, по крайней мере, частично растворен в водном растворе. Этому может способствовать добавление органического сорастворителя, такого какдиоксан , пиридин , ацетон или трет- BuOH. KMnO 4 легко вступит в реакцию с двойной углерод-углеродной связью перед окислением первичного спирта.
Обычно эти окисления проводят в сильных щелочных условиях, потому что это способствует большей скорости и селективности окисления. В субстратах, чувствительных к сильному основанию, реакцию можно проводить при более низком pH - или даже в кислых условиях - за счет значительного снижения скорости реакции.

KMnO 4 разлагается в воде с образованием диоксида марганца (MnO 2 ) и газообразного кислорода. Это разложение катализируется кислотой, основанием и MnO 2 . Поскольку степень этого разложения трудно оценить во время окисления первичных спиртов, количество KMnO 4 необходимо регулировать во время окисления, добавляя его последовательно, пока окисление не завершится.
Окисление Джонса [ править ]
Так называемый реагент Джонса получают растворением триоксида хрома (CrO 3 ) в водной серной кислоте , что приводит к образованию красноватого раствора, содержащего хромовую кислоту (H 2 CrO 4 ) и ее олигомеры. Добавление реактива Джонса к раствору первичного спирта в ацетоне (как впервые было описано Джонсом [4] [5] ) приводит к окислению спирта до карбоновой кислоты. Этот классический протокол, предполагающий прямое добавление , используется очень часто, несмотря на то, что он часто приводит к образованию значительных количеств сложных эфиров.(имеющий структуру R-CO-O-CH 2 -R), полученный в результате окислительной димеризации первичных спиртов. Холланд и Гилман [6] доказали, что эту побочную реакцию можно в значительной степени подавить, следуя протоколу обратного добавления , при котором раствор первичного спирта в ацетоне медленно добавляют к реагенту Джонса в условиях, насколько это целесообразно разбавить.
Реагент Джонса взаимодействует со вторичными спиртами, что приводит к окислению до кетонов. [7] Обработка соединений, содержащих как первичные, так и вторичные спирты, реактивом Джонса приводит к образованию кетокислот.
Проблемы, возникающие при использовании больших количеств токсичного и опасного для окружающей среды триоксида хрома, побудили Чжао [8] разработать каталитическую процедуру, включающую обработку избытком периодной кислоты (H 5 IO 6 ) в присутствии около 1,2 мол.% CrO 3 . Методика Чжао по использованию каталитического CrO 3 очень хорошо подходит для крупномасштабных реакций. [9]

PDC в DMF (Кори и Шмидт) [ править ]
Дихромат пиридиния (PDC) представляет собой ярко-оранжевое твердое вещество с формулой (C 5 H 5 NH) 2 Cr 2 O 7 , которое очень часто используется для окисления первичных и вторичных спиртов до альдегидов и кетонов соответственно. С другой стороны, в 1979 году Кори и Шмидт сообщили [11], что реакция насыщенных первичных спиртов с PDC с использованием диметилформамида (Me 2NCHO, DMF) в качестве растворителя приводит к окислению до карбоновых кислот, а не до альдегидов. Аллиловые и бензильные первичные спирты не окисляются до карбоновых кислот. Процедура Кори и Шмидта для окисления насыщенных первичных спиртов до карбоновых кислот выполняется в практически нейтральных условиях.
Окисление Хейнса [ править ]
При окислении курицы окисляющий реагент представляет собой комбинацию кислорода и платины .
Четырехокись рутения [ править ]
Четырехокись рутения широко используется в органической химии в качестве окислителя. Это агрессивный агент, допускающий мягкие условия реакции.
Двухступенчатое окисление спиртов до кислот через изолированные альдегиды [ править ]
Поскольку многие из вышеупомянутых условий окисления первичных спиртов до кислот являются суровыми и несовместимы с обычными защитными группами, химики-органики часто используют двухэтапную процедуру окисления до кислот. Первичный спирт окисляют до альдегида, используя одну из многих существующих процедур (например, окисление IBX , периодинан Десса-Мартина ). Затем альдегид можно подвергнуть условиям окисления Пинника с использованием хлорита натрия . [12] Эта последовательность часто используется в синтезе природных продуктов, Nicolaou et al. применили его в синтезе Платенцина. [13]
Ссылки [ править ]
- Перейти ↑ Fournier, HM (1907). "Transformation des alcools primaires saturès en acides monobasiques Соответствующие". Comptes Rendus Acad. Sci. : 331.
- ↑ Fournier, HM (20 июля 1909 г.). "Sur la preparation des acides gras et de leurs anhydres" . Бык. Soc. Чим. Пт. : 920.
- ^ Чуфолини, Массачусетс; Сваминатан, С. (1989). «Синтез модельного депсипептидного сегмента лузопептинов (BBM 928), мощных противоопухолевых и антиретровирусных антибиотиков». Tetrahedron Lett. 30 (23): 3027. DOI : 10.1016 / S0040-4039 (00) 99393-6 .
- ^ Heilbron, I .; Джонс, ERH; Sondheimer, F. (1947). «315. Исследования ацетиленовых соединений. Часть XIV. Изучение реакций легкодоступного этинилэтиленового спирта пент-2-ен-4-ин-1-ола». J. Chem. Soc. : 1586 DOI : 10.1039 / jr9470001586 .
- ^ Heilbron, I .; Джонс, ERH (1949). «129. Исследования по ацетиленовым соединениям. Часть XV. Окисление первичных ацетиленовых карбинолов и гликолей». J. Chem. Soc. : 604. DOI : 10.1039 / jr9490000604 .
- ^ Голландия, Британская Колумбия; Гилман, Н.В. (1974). «Улучшенная процедура окисления алкинолов до алкиновых кислот». Synth. Commun. 4 (4): 203. DOI : 10,1080 / 00397917408062073 .
- ^ См. Окисление спиртов до альдегидов и кетонов .
- ^ Чжао, М .; Li, J .; Песня, З .; Desmond, R .; Tschaen, DM; Грабовски, EJJ; Рейдер, П.Дж. (1998). «Новый триоксид хрома, катализируемый окислением первичных спиртов до карбоновых кислот». Tetrahedron Lett. 39 (30): 5323. DOI : 10.1016 / S0040-4039 (98) 00987-3 .
- ^ Песня, ZJ; Чжао, М .; Desmond, R .; Devine, P .; Tschaen, DM; Tillyer, R .; Frey, L .; Heid, R .; Сюй, Ф .; Фостер, Б .; Li, J .; Reamer, R .; Volante, R .; Грабовски, EJJ; Dolling, UH; Рейдер, П.Дж. (1999). «Практический асимметричный синтез антагониста рецептора эндотелина». J. Org. Chem. 64 (26): 9658. DOI : 10.1021 / jo991292t .
- ^ Crimmins, MT & DeBaillie, AC (2006). «Энантиоселективный тотальный синтез бистрамида А» . Варенье. Chem. Soc. 128 (15): 4936–7. DOI : 10.1021 / ja057686l . PMC 2546575 . PMID 16608311 .
- ^ Кори, EJ; Шмидт, Г. (1979). «Полезные методы окисления спиртов с участием дихромата пиридиния в апротических средах». Tetrahedron Lett. 20 (52): 399. DOI : 10.1016 / S0040-4039 (01) 93515-4 .
- ^ Бал Б.С.; Чайлдерс младший МЫ; Пинник HW (1981). «Окисление α, β-ненасыщенных альдегидов». Тетраэдр (аннотация). 37 (11): 2091. DOI : 10.1016 / S0040-4020 (01) 97963-3 .
- ^ Николау KC; Scott Tria G .; Эдмондс DJ (2008). «Полный синтез платенцина». Энгью. Chem. 120 (9): 1804. DOI : 10.1002 / ange.200800066 .
Дальнейшее чтение [ править ]
- Маркос Фернандес; Габриэль Тохо (2006). Окисление первичных спиртов до карбоновых кислот: руководство по современной общепринятой практике (основные реакции в органическом синтезе) . Берлин: Springer. ISBN 0-387-35431-X.