Фосфатидилэтаноламины - это класс фосфолипидов, обнаруженных в биологических мембранах . [1] Они синтезируются путем добавления цитидиндифосфата - этаноламина к диглицеридам , высвобождая цитидинмонофосфат . S- аденозилметионин может впоследствии метилировать амин фосфатидилэтаноламинов с образованием фосфатидилхолинов . В основном его можно найти во внутренней ( цитоплазматической ) листке липидного бислоя . [2]
Функция [ править ]

PtdCho - фосфатидилхолин ;
PtdEtn - фосфатидилэтаноламин;
PtdIns - фосфатидилинозитол ;
PtdSer - фосфатидилсерин .
В ячейках [ править ]
Фосфатидилэтаноламины обнаружены во всех живых клетках, составляя 25% всех фосфолипидов. В физиологии человека, они обнаружили , особенно в нервной ткани , такие как белое вещество из мозга , нервов, нервной ткани, а также в спинном мозге , где они составляют 45% всех фосфолипидов. [3]
Фосфатидилэтаноламины играют роль в слиянии мембран и в разборке сократительного кольца во время цитокинеза при делении клеток . [4] Кроме того, считается, что фосфатидилэтаноламин регулирует кривизну мембраны . Фосфатидилэтаноламин является важным предшественником, субстратом или донором в нескольких биологических путях. [3]
Как группа с полярной головкой, фосфатидилэтаноламин создает более вязкую липидную мембрану по сравнению с фосфатидилхолином . Например, температура плавления диолеоилфосфатидилэтаноламина составляет -16 ° C, а температура плавления диолеоилфосфатидилхолина составляет -20 ° C. Если бы липиды имели две пальмитоильные цепи, фосфатидилэтаноламин плавился бы при 63 ° C, тогда как фосфатидилхолин плавился бы уже при 41 ° C. [5] Более низкие температуры плавления соответствуют, в упрощенном представлении, более жидким мембранам.
У людей [ править ]
Считается, что у людей метаболизм фосфатидилэтаноламина важен в сердце. Когда кровоток к сердцу ограничен, асимметричное распределение фосфатидилэтаноламина между листочками мембраны нарушается, и в результате мембрана разрушается. Кроме того, фосфатидилэтаноламин играет роль в секреции липопротеинов в печени. Это связано с тем, что везикулы для секреции липопротеинов очень низкой плотности, выходящие из аппарата Гольджи, имеют значительно более высокую концентрацию фосфатидилэтаноламина по сравнению с другими везикулами, содержащими липопротеины очень низкой плотности. [6] Фосфатидилэтаноламин также показал способность размножать инфекционные прионы.без помощи каких-либо белков или нуклеиновых кислот , что является его уникальной характеристикой. [7] Считается, что фосфатидилэтаноламин также играет роль в свертывании крови, поскольку он работает с фосфатидилсерином, увеличивая скорость образования тромбина , способствуя связыванию с фактором V и фактором X , двумя белками, которые катализируют образование тромбина из протромбина . [8] Синтез эндоканнабиноидного анандамида выполняется из фосфатидилэтаноламина последовательного действия ферментов, 2 с N - ацетилтрансферазы ифосфолипаза -D. [9]
В бактериях [ править ]
Если фосфатидилхолин является основным фосфолипидом у животных, то фосфатидилэтаноламин является основным фосфолипидом у бактерий . Одна из основных ролей фосфатидилэтаноламина в бактериальных мембранах - распространение отрицательного заряда, вызванного анионными мембранными фосфолипидами . В бактерии E. coli фосфатидилэтаноламин играет роль в поддержке активного транспорта лактозы в клетку пермеазами лактозы, а также может играть роль в других транспортных системах. Фосфатидилэтаноламин играет роль в сборке пермеазы лактозы и других мембранных белков. Он действует как «шаперон», помогая мембранным белкам правильно складывать свои третичные структуры.чтобы они могли нормально функционировать. Когда фосфатидилэтаноламин отсутствует, транспортные белки имеют неправильную третичную структуру и не работают правильно. [10]
Фосфатидилэтаноламин также позволяет бактериальным переносчикам нескольких лекарственных препаратов функционировать должным образом и позволяет образовывать промежуточные соединения, которые необходимы для правильного открытия и закрытия переносчиков. [11]
Структура [ править ]
Как лецитин , фосфатидилэтаноламин состоит из комбинации глицерина, этерифицированного двумя жирными кислотами и фосфорной кислотой . В то время как фосфатная группа объединяется с холином в фосфатидилхолине, она объединяется с этаноламином в фосфатидилэтаноламине. Две жирные кислоты могут быть одинаковыми или разными и обычно находятся в положениях 1,2 (хотя они могут находиться в положениях 1,3).
Синтез [ править ]
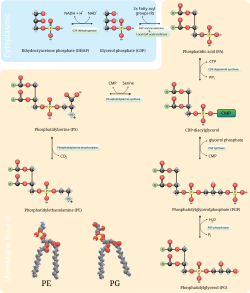
Путь декарбоксилирования фосфатидилсерина и пути цитидиндифосфат-этаноламин используются для синтеза фосфатидилэтаноламина. Фосфатидилсерин декарбоксилаза - это фермент, который используется для декарбоксилирования фосфатидилсерина на первом пути. Путь декарбоксилирования фосфатидилсерина является основным источником синтеза фосфатидилэтаноламина в мембранах митохондрий . Фосфатидилэтаноламин, продуцируемый митохондриальной мембраной, также транспортируется через клетку к другим мембранам для использования. В процессе, который отражает синтез фосфатидилхолина , фосфатидилэтаноламин также производится по пути цитидиндифосфат-этаноламин с использованиемэтаноламин в качестве субстрата. Через несколько этапов, происходящих как в цитозоле, так и в эндоплазматическом ретикулуме , путь синтеза дает конечный продукт фосфатидилэтаноламин. [12] Фосфатидилэтаноламин также в большом количестве содержится в соевом или яичном лецитине и коммерчески производится с использованием хроматографического разделения.
Регламент [ править ]
Синтез фосфатидилэтаноламина через путь декарбоксилирования фосфатидилсерина происходит быстро во внутренней митохондриальной мембране . Однако фосфатидилсерин производится в эндоплазматическом ретикулуме . Из-за этого транспорт фосфатидилсерина из эндоплазматического ретикулума к митохондриальной мембране, а затем к внутренней митохондриальной мембране ограничивает скорость синтеза по этому пути. Механизм этого транспорта в настоящее время неизвестен, но может играть роль в регуляции скорости синтеза в этом пути. [13]
Присутствие в пище, проблемы со здоровьем [ править ]
Фосфатидилэтаноламины в пище распадаются с образованием продуктов Амадори, связанных с фосфатидилэтаноламином, как часть реакции Майяра . [14] Эти продукты ускоряют перекисное окисление липидов мембран , вызывая окислительный стресс в контактирующих с ними клетках. [15] Окислительный стресс, как известно, вызывает ухудшение качества питания и ряд заболеваний. Значительные уровни продуктов Амадори-фосфатидилэтаноламина были обнаружены в большом количестве продуктов, таких как шоколад , соевое молоко , детские смеси и другие обработанные пищевые продукты. . Уровни продуктов Амадори-фосфатидилэтаноламина выше в пищевых продуктах с высокими концентрациями липидов и сахара, которые подвергаются высоким температурам при переработке. [14] Дополнительные исследования показали , что Амадори-фосфатидилэтаноламин может играть определенную роль в сосудистых заболеваниях , [16] действуют как механизм , с помощью которого сахарных диабет может увеличить частоту рака , [17] и , возможно , играет определенную роль в других заболеваниях , а также. Амадори-фосфатидилэтаноламин имеет более высокую концентрацию в плазме у пациентов с диабетом, чем у здоровых людей, что указывает на то, что он может играть роль в развитии болезни или быть ее продуктом. [18]
См. Также [ править ]
- N- ацилфосфатидилэтаноламин
- Фосфатидилэтаноламин метилтрансфераза
Ссылки [ править ]
- ^ Велнер, Нильс; Diep, Thi Ai; Янфельт, Кристиан; Хансен, Харальд Северин (2012). «N-ацилирование фосфатидилэтаноламина и его биологические функции у млекопитающих». Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов . 1831 (3): 652–62. DOI : 10.1016 / j.bbalip.2012.08.019 . PMID 23000428 .
- ^ Мишкинд, Майкл (2000). «Фосфатидилэтаноламин - в крайнем случае». Тенденции в клеточной биологии . 10 (9): 368. DOI : 10.1016 / S0962-8924 (00) 01826-2 .
- ^ a b Вэнс, Жан Э .; Тассева, Гергана (2012). «Образование и функция фосфатидилсерина и фосфатидилэтаноламина в клетках млекопитающих». Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов . 1831 (3): 543–54. DOI : 10.1016 / j.bbalip.2012.08.016 . PMID 22960354 .
- ^ Emoto, K .; Кобаяши, Т; Ямаджи, А; Aizawa, H; Яхара, я; Иноуэ, К; Умеда, М. (1996). «Перераспределение фосфатидилэтаноламина в борозде дробления делящихся клеток во время цитокинеза» . Труды Национальной академии наук . 93 (23): 12867–72. Bibcode : 1996PNAS ... 9312867E . DOI : 10.1073 / pnas.93.23.12867 . JSTOR 40713 . PMC 24012 . PMID 8917511 .
- ^ См. Ссылки в Wan et al. Биохимия 47 2008 [ необходима проверка ]
- Перейти ↑ Vance, JE (2008). «Серия тематических обзоров: Глицеролипиды. Фосфатидилсерин и фосфатидилэтаноламин в клетках млекопитающих: два метаболически связанных аминофосфолипида» . Журнал исследований липидов . 49 (7): 1377–87. DOI : 10,1194 / jlr.R700020-JLR200 . PMID 18204094 .
- ^ Deleault, NR; Пиро, младший; Уолш, диджей; Wang, F .; Ma, J .; Geoghegan, JC; Супаттапон, С. (2012). «Выделение фосфатидилэтаноламина в качестве единственного кофактора для образования прионов в отсутствие нуклеиновых кислот» . Труды Национальной академии наук . 109 (22): 8546–51. Bibcode : 2012PNAS..109.8546D . DOI : 10.1073 / pnas.1204498109 . PMC 3365173 . PMID 22586108 .
- ^ Majumder, R .; Лян, X .; Куинн-Аллен, Массачусетс; Кейн, WH; Ленц, BR (2011). «Модуляция сборки и активности протромбиназы фосфатидилэтаноламином» . Журнал биологической химии . 286 (41): 35535–42. DOI : 10.1074 / jbc.M111.260141 . PMC 3195639 . PMID 21859710 .
- Перейти ↑ Isidro, F. (2014). «Каннабиноиды для лечения болезни Альцгеймера: движение к клинике» . Границы фармакологии . 5 : 37. DOI : 10.3389 / fphar.2014.00037 . PMC 3942876 . PMID 24634659 .
- ↑ Christie, WW (16 апреля 2012 г.). «Фосфатидилэтаноламин и родственные липиды» . Библиотека липидов AOCS. Архивировано из оригинального 21 августа 2012 года . Проверено 3 сентября 2012 года .
- ^ Gbaguidi, B .; Hakizimana, P .; Vandenbussche, G .; Ruysschaert, J.-M. (2007). «Конформационные изменения в бактериальном переносчике множества лекарственных средств зависят от фосфатидилэтаноламина». Клеточные и молекулярные науки о жизни . 64 (12): 1571–82. DOI : 10.1007 / s00018-007-7031-0 . PMID 17530171 . S2CID 2078590 .
- ↑ Келли, Карен (28 июля 2011 г.). «Биосинтез фосфолипидов» . Библиотека липидов AOCS . Проверено 3 сентября 2012 года .
- ^ Kuge, Осама; Нисидзима, Масахиро (1 апреля 2003 г.). «Биосинтетическая регуляция и внутриклеточный транспорт фосфатидилсерина в клетках млекопитающих» . Журнал биохимии . 133 (4). Архивировано из оригинала на 30 января 2021 года . Проверено 30 января 2021 года .
- ^ a b Дуб, Чон-Хо; Накагава, Киётака; Миядзава, Теруо (2002). «УФ-анализ Амадори-гликозилированного фосфатидилэтаноламина в пищевых продуктах и биологических образцах» . Журнал исследований липидов . 43 (3): 523–9. PMID 11893788 .
- ↑ Дуб, Чон-Хо; Накагава, Киётака; Миядзава, Теруо (2000). «Синтетически полученный гликозилированный Амадори фосфатидилэтаноламин может запускать перекисное окисление липидов посредством свободнорадикальных реакций» . Письма FEBS . 481 (1): 26–30. DOI : 10.1016 / S0014-5793 (00) 01966-9 . PMID 10984609 . S2CID 23265125 .
- ↑ Дуб, Чон-Хо; Накагава, Киётака; Оикава, Шиничи; Миядзава, Теруо (2003). «Амадори-гликозилированный фосфатидилэтаноламин индуцирует ангиогенные дифференцировки в культивируемых эндотелиальных клетках пупочной вены человека» . Письма FEBS . 555 (2): 419–23. DOI : 10.1016 / S0014-5793 (03) 01237-7 . PMID 14644453 . S2CID 33974755 .
- ^ Эйцука, Такахиро; Накагава, Киётака; Оно, Юичи; Татеваки, Наото; Нисида, Хироши; Курата, Тадао; Сёдзи, Наоки; Миядзава, Теруо (2012). «Амадори-гликированный фосфатидилэтаноламин повышает активность теломеразы в клетках карциномы поджелудочной железы человека PANC-1» . Письма FEBS . 586 (16): 2542–7. DOI : 10.1016 / j.febslet.2012.06.027 . PMID 22750441 . S2CID 5452160 .
- ^ Ариидзуми, Кен; Koike, T; Охара, S; Иномата, Y; Abe, Y; Иидзима, К; Иматани, А; Ока, Т; Симосегава, Т. (2008). «Заболеваемость рефлюкс-эзофагитом и инфекцией H.pylori у больных диабетом» . Всемирный журнал гастроэнтерологии . 14 (20): 3212–7. DOI : 10,3748 / wjg.14.3212 . PMC 2712855 . PMID 18506928 .
Внешние ссылки [ править ]
- Фосфатидилэтаноламины в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Фосфатидилэтаноламин в липидной библиотеке AOCS.