 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 2,2'-Bi (1,3-дитиолилиден) | |
| Другие имена Δ2,2-Bi-1,3-дитиол | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.045.979 |
PubChem CID | |
| UNII | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| C 6 H 4 S 4 | |
| Молярная масса | 204,34 г · моль -1 |
| Внешность | Желтое твердое вещество |
| Температура плавления | От 116 до 119 ° C (от 241 до 246 ° F, от 389 до 392 K) |
| Точка кипения | Разлагается |
| Нерастворимый | |
| Растворимость в органических растворителях | Растворимый [ неопределенный ] |
| Структура | |
| 0 Д | |
| Опасности | |
| Основные опасности | горючий |
| R-фразы (устаревшие) | R43 |
| S-фразы (устаревшие) | S36 / 37 |
| Родственные соединения | |
Родственные соединения | TCNQ , тиофен |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
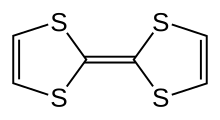
Тетратиафульвалена представляет собой сероорганическое соединение с формулой (Н 2 С 2 S 2 C) 2 . Исследования этого гетероциклического соединения способствовали развитию молекулярной электроники . TTF связан с углеводородным фульваленом (C 5 H 4 ) 2 заменой четырех групп CH атомами серы. Более 10 000 научных публикаций обсуждают TTF и его производные. [1]
Подготовка [ править ]
Высокий уровень интереса к TTF привел к разработке многих синтезов TTF и его аналогов. [1] Большинство препаратов включают связывание циклических C 3 S 2 строительных блоков, таких как 1,3-дитиол-2-тионы или родственные 1,3-дитиол-2-оны. Для самого TTF синтез начинается с тритиокарбоната H 2 C 2 S 2 CS, который S-метилируется, а затем восстанавливается с образованием H 2 C 2 S 2 CH (SCH 3 ), который обрабатывают следующим образом: [2]
- ЧАС
2C
2S
2CH (SCH
3) + HBF
4→ [H
2C
2S
2CH+
] BF-
4+ HSCH
3
- 2 [H
2C
2S
2CH+
] BF-
4+ 2 Et
3N → (H
2C
2S
2C)
2+ 2 Et
3NHBF
4
Свойства окислительно-восстановительного потенциала [ править ]
Сам объемный TTF обладает ничем не примечательными электрическими свойствами. Однако отличительные свойства связаны с солями его окисленных производных, такими как соли, полученные из TTF + .
Высокая электрическая проводимость солей TTF может быть связана со следующими особенностями TTF: (i) его планарность, которая позволяет π-π-стэкинг его окисленных производных, (ii) его высокая симметрия, которая способствует делокализации заряда, тем самым минимизируя кулоновское отталкивание. и (iii) его способность подвергаться окислению при умеренных потенциалах с образованием стабильного катион-радикала. Электрохимические измерения показывают, что TTF может окисляться обратимо дважды:
- TTF → TTF+
+ e - (E = 0,34 В)
- TTF+
→ TTF2+
+ e - (E = 0,78 В относительно Ag / AgCl в растворе MeCN)
Каждое дитиолилиденовое кольцо в TTF имеет 7π электронов: 2 для каждого атома серы, 1 для каждого sp 2 атома углерода. Таким образом, окисление превращает каждое кольцо в ароматическую 6π-электронную конфигурацию, в результате чего центральная двойная связь остается по существу одинарной, поскольку все π-электроны занимают кольцевые орбитали.
История [ править ]
Соль [TTF+
] Cl-
В 1972 году сообщалось, что это полупроводник. [4] Впоследствии было показано, что соль с переносом заряда [TTF] TCNQ является полупроводником с узкой запрещенной зоной . [5] Рентгеноструктурные исследования [TTF] [TCNQ] выявили стопки частично окисленных молекул TTF, прилегающих к анионным стопкам молекул TCNQ. Этот мотив «сегрегированной стопки» был неожиданным и отвечает за отличительные электрические свойства, то есть высокую и анизотропную электропроводность . Со времени этих ранних открытий были приготовлены многочисленные аналоги TTF. Хорошо изученные аналоги включают тетраметилтетратиафульвален (Me 4TTF), тетраметилселенафульвалены (TMTSFs) и бис (этилендитио) тетратиафульвален (BEDT-TTF, CAS [66946-48-3]). [6] Некоторые соли тетраметилтетратиафульвалена (называемые солями Фабра ) имеют определенное значение в качестве органических сверхпроводников .
См. Также [ править ]
- Соль Бехгаард
Ссылки [ править ]
- ^ а б Бендиков, М; Wudl, F; Перепичка Д. Ф. (2004). «Тетратиафульвалены, олигоаценены и их производные бакминстерфуллерена: кирпич и строительный раствор органической электроники». Химические обзоры . 104 (11): 4891–4945. DOI : 10.1021 / cr030666m . PMID 15535637 .
- ^ Wudl, F .; Каплан, ML (1979). 2,2'Bi-1,3-дитиолилиден (тетратиафульвален, TTF) и его радикальные катионные производные . Неорг. Synth. Неорганические синтезы. 19 . С. 27–30. DOI : 10.1002 / 9780470132500.ch7 . ISBN 978-0-470-13250-0.
- ^ Д. Шассо; Г. Комбертон; Ж. Готье; К. Хау (1978). «Пересмотр структуры комплекса гексаметилен-тетратиафульвален-тетрацианохинодиметан» . Acta Crystallographica Раздел B . 34 (2): 689. DOI : 10,1107 / S0567740878003830 .
- ^ Wudl, F .; Wobschall, D .; Hufnagel, EJ (1972). «Электропроводность системы бис (1,3-дитиол) -бис (1,3-дитиолий)». Варенье. Chem. Soc. 94 (2): 670–672. DOI : 10.1021 / ja00757a079 .
- ^ Феррарис, Дж .; Коуэн, Д.О.; Walatka, VV, Jr .; Перлштейн, JH (1973). «Электронный перенос в новом высокопроводящем донорно-акцепторном комплексе». Варенье. Chem. Soc. 95 (3): 948–949. DOI : 10.1021 / ja00784a066 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Ларсен, J .; Ленуар, К. (1998). «2,2'-Би-5,6-дигидро-1,3-дитиоло [4,5-b] [1,4] дитиинилиден (BEDT-TTF)» . Органический синтез .CS1 maint: несколько имен: список авторов ( ссылка ); Сборник , 9 , стр. 72
Дальнейшее чтение [ править ]
- Ровира, К. (2004). «Бис (этилентио) тетратиафульвален (BET-TTF) и родственные диссимметричные доноры электронов: от молекулы до функциональных молекулярных материалов и устройств (OFET)». Химические обзоры . 104 (11): 5289–5317. DOI : 10.1021 / cr030663 + . PMID 15535651 .
- Иода, М; Hasegawa, M; Мияке, Y (2004). «Bi-TTF, Bis-TTF и родственные олигомеры TTF». Химические обзоры . 104 (11): 5085–5113. DOI : 10.1021 / cr030651o . PMID 15535643 .
- Frere, P .; Скабара, П.Дж. (2005). «Соли расширенных аналогов тетратиафульвалена: взаимосвязь между молекулярной структурой, электрохимическими свойствами и организацией твердого тела». Обзоры химического общества . 34 (1): 69–98. DOI : 10.1039 / b316392j . PMID 15643491 .
- Горги, Ален; Худомм, Питрик; Salle, Марк. (2004). «Высокофункциональные тетратиафульвалены: синтетический след от электрофильных алкинов». Химические обзоры . 104 (11): 5151–5184. DOI : 10.1021 / cr0306485 . PMID 15535646 .
- Физические свойства тетратиафульвалена из литературы.